氧化还原敏感型元件调控大肠杆菌氧化胁迫耐受性
李婷婷,王 亮,刘晨光
(1.上海交通大学 生命科学技术学院 微生物代谢国家重点实验室,上海 200240;2.大连工业大学 生物工程学院,辽宁 大连 116034)
随着全球对清洁可持续能源及化学品的需求持续增加,微生物转化来源丰富的木质纤维素原料生产生物基化学品成为了研究热点[1]。但木质纤维素组分复杂、结构致密,须经过预处理才能大量释放出可发酵糖[2],该过程伴随着抑制物的产生,包括有机酸、呋喃醛类以及酚类化合物[3]。当微生物以木质纤维素水解液为原料进行发酵生产时,这些抑制物会影响菌株的生长,降低发酵效率[4]。
抑制物对于细胞的影响主要在于:1)诱导细胞产生大量的活性氧(ROS)自由基,ROS造成DNA、蛋白质、脂质等损伤,破坏细胞组分和结构[5],影响微生物生长和发酵性能[6];2)微生物在转化抑制物的过程中,伴随着还原力NAD(P)H(NADH为烟酰胺腺嘌呤二核苷酸,还原型辅酶Ⅰ;NADPH为烟酰胺腺嘌呤二核苷酸磷酸,还原型辅酶Ⅱ)的消耗,造成胞内辅因子不平衡[7],影响细胞的能量和物质代谢过程[8]。已有研究证明,调控胞内氧化还原电位不仅可以改变代谢物流向,有利于目标产物积累[9],还能通过ROS、谷胱甘肽(GSH)、NAD(P)H等胞内氧化还原物质积极响应环境胁迫,进而增强细胞对环境胁迫的耐受性[10],因此通过氧化还原电位的调控可以提高菌株的抗氧化能力。近年来,胞内氧化还原敏感型转录因子也备受关注,SoxR是其中机制研究较为成熟的一种感应氧化胁迫的转录因子[11]。
大肠杆菌中转录因子SoxR能够感受胞内的氧化还原电位[12]。soxR基因与调控基因soxS组成soxRS调节子,二者在基因组上头对头紧密串联,共用一段双向启动子PsoxS[13]。转录因子SoxR感受到胞内氧化刺激被氧化以后,与PsoxS相应序列结合激活soxS基因的表达,SoxS蛋白水平上升,进而激活下游多个抗氧化基因的表达,实现胞内氧化还原电位的全局性调控[14]。因此,大肠杆菌中的转录因子SoxR是一个天然存在的氧化还原敏感型元件的开关。通过蛋白序列比对,发现乙醇生产菌株运动发酵单胞菌(Zymomonasmobilis)中也具有转录因子SoxR[15],其与大肠杆菌SoxR的序列相似性为53.47%,但关于Z.mobilisSoxR的研究尚未报道,其与大肠杆菌SoxR是否具有相似功能有待研究。
本研究在大肠杆菌中对两种菌的转录因子SoxR进行了氧化胁迫抗性及元件通路验证。基于氧化还原敏感型转录因子SoxR,设计构建了单基因菌株,提高了大肠杆菌对H2O2以及糠醛的胁迫耐受性,进一步通过双基因组合菌株提高了细胞对混合抑制物的胁迫耐受性,为提高菌株的鲁棒性提供了新思路。
1 材料与方法
1.1 菌株与质粒
本实验所使用的菌株为E.coliDH5α,质粒表达载体为pEZ15Asp[16]。大肠杆菌转录因子SoxR(E-SoxR)的基因来源于模式菌株MG1655[17](NC_000913.3,Gene ID:948566),运动发酵单胞菌转录因子SoxR(Z-SoxR)的基因来源于模式菌株Z.mobilisZM4(NC_006526.2,Gene ID:58027697)。
1.2 试剂和培养基
限制性核酸内切酶:NEB(北京)有限公司;DNA marker:宝生物工程(大连)有限公司;C115(2×ClonExpress Mix)、高保真酶(Phanta Max Super-Fidelity)、2×Taq Plus Master MixⅡ:南京诺唯赞生物科技股份有限公司;琼脂糖凝胶DNA回收试剂盒:广州美基生物科技有限公司;PCR产物纯化试剂盒:天根生化科技(北京)有限公司;质粒小量制备试剂盒:上海捷瑞生物工程有限公司;壮观霉素(Spectinomycin,Spec):生工生物工程(上海)股份有限公司。
LB(Luria-Bertani)培养基(g/L):10 胰蛋白胨、5酵母提取物、10 NaCl、固体培养基中加入琼脂粉20。RM培养基组分(g/L):20葡萄糖、2 KH2PO4、10酵母提取物,固体培养基加入琼脂粉20。
1.3 菌株活化与培养
大肠杆菌活化:取-80 ℃保存的重组大肠杆菌在含有100 mg/L Spec的LB液体培养基中,37 ℃、150 r/min过夜振荡培养。运动发酵单胞菌活化:取-80 ℃保存的运动发酵单胞菌于RM固体培养基上,采用三区法划线活化,置于30 ℃培养箱中静置培养2~3 d。
1.4 重组菌株构建
以大肠杆菌MG1655基因组为模板,设计引物经PCR扩增分别获得PgapA、soxR、PsoxS、soxR-PsoxS、soxRS、katE、sodB、trxB、fpr、zwf基因片段。以运动发酵单胞菌ZM4基因组为模板,设计引物经PCR扩增获得ZM4-soxR基因片段。荧光蛋白mCherry的基因为实验室保存。
限制性内切酶EcoRⅠ和XbaⅠ切割pEZ15Asp质粒,经凝胶电泳切胶纯化后,利用同源重组的方法,将相应基因片段连接在线性化载体pEZ15Asp上,热激法转化大肠杆菌DH5α,获得大肠杆菌重组菌株。转化子通过测序验证无误后保存于-80 ℃备用。本实验使用的菌株见表1,所用引物见表2,质粒表达载体构建示意图如图1所示[18]。

表1 本实验使用的菌株Table 1 Strains used in this experiment
1.5 SoxR表达菌株的生长及耐受性能测定
重组大肠杆菌经活化后,种子培养至OD600约0.5、按体积分数为10%接种于LB培养基中,每隔4 h左右吸取200 μL菌液置于透明96孔板中,利用全波长扫描仪在600 nm下读取吸光值。在耐受性能评估实验中,在接种前分别在培养基中,加入H2O210 mmol/L或糠醛10 mmol/L。
1.6 mCherry表达菌株的荧光定量分析
重组大肠杆菌经活化后,种子培养至OD600约0.5,取一定量菌体离心培养基,用等体积新鲜Luria-Bertani培养基混匀;配制浓缩一倍的含抑制物培养基体系,取1 mL菌液于48孔板中,接入1 mL不同浓度的抑制物体系,37 ℃、200 r/min摇床振荡培养3 h后,取800 μL菌液8 000 r/min离心1 min舍弃上清培养基,磷酸缓冲液(PBS)洗两遍后,用600 μL的PBS重悬细胞,吸取200 μL于黑色背景96 孔板中,使用多功能酶标仪(Spark175型,帝肯(上海)实验器材有限公司),在587 nm的激发光和610 nm的发射光下,测定其荧光强度,另吸取200 μL于透明96孔板中,利用全波长扫描仪(Infinite 200型,瑞士Tecan公司)在600 nm下读取吸光值。

表2 本实验使用的引物Table 2 Primers used in this experiment

续表
无胁迫条件下,菌株的荧光表达量定义为本底表达,响应强度=胁迫条件下荧光最大表达量/本底表达[19]。
1.7 SoxR及抗性基因表达菌株的耐受性测定
重组大肠杆菌经活化后,种子培养至OD600约0.5、按体积分数为10%接种于LB培养基中。本实验选择的抑制物为5/10 mmol/L H2O2和10 mmol/L糠醛。初始单胁迫刺激:培养基分别添加H2O2、糠醛;对数期单胁迫刺激:培养4 h后,分别添加H2O2、糠醛;对数期双胁迫刺激:培养4 h后,同时添加H2O2和糠醛。取样测量OD600,绘制生长曲线[20]。
改造菌株的生长提升量定义为I:I=(OD改造-OD空载)/OD空载×100%。
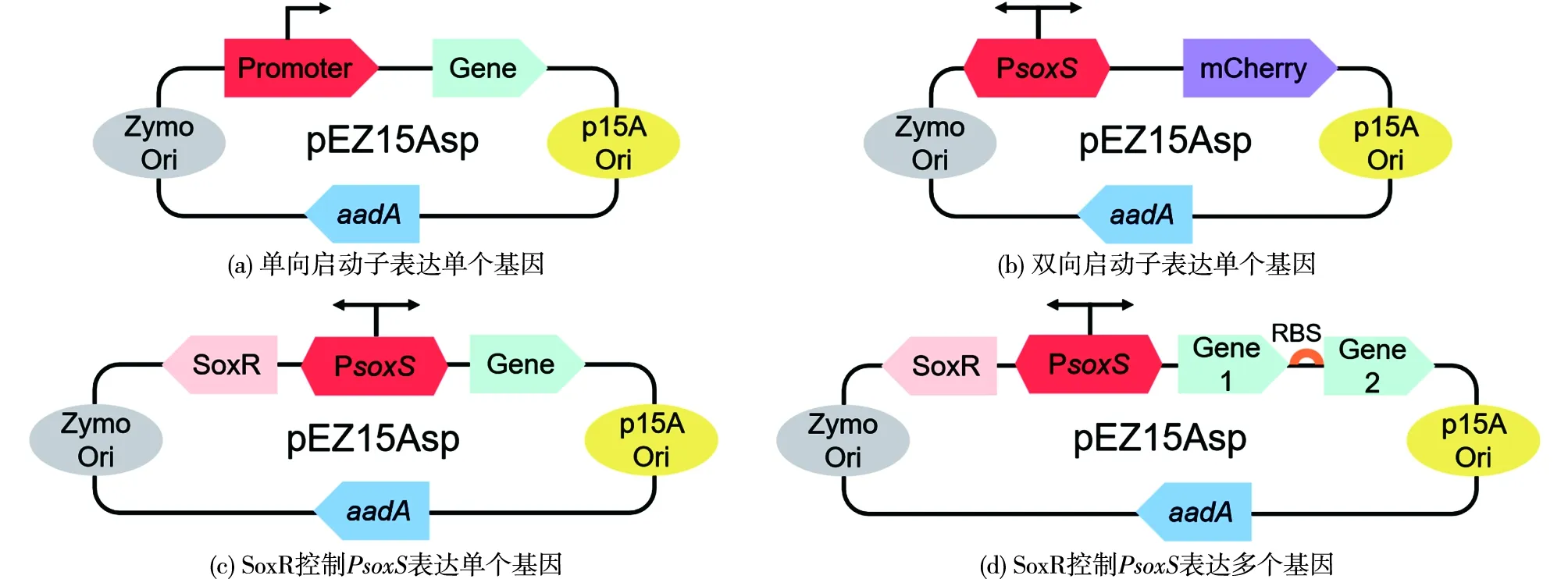
pEZ15Asp—质粒表达载体;Promoter—启动子;Gene—目的基因;Zymo Ori/p15A Ori—转录复制起始位点;aadA—Spec抗性基因;PsoxS—双向启动子;SoxR—转录因子;RBS—来自Gene2所在基因组上游40 bp图1 质粒表达载体构建示意Fig.1 Schematic diagram of plasmid expression vector construction
1.8 胞内活性氧(ROS)检测
使用探针2,7-二氯二氢荧光素二乙酸酯(H2DCFDA)测定H2O2和糠醛在胁迫条件下,大肠杆菌SoxR及抗性基因表达菌株和对照菌株细胞内的ROS水平。于不同条件下生长差异较大点取350 μL菌液,PBS洗两遍菌体,后用1 mL经PBS稀释的H2DCFDA悬浮细胞,于37 ℃、200 r/min反应45 min左右。离心收集细胞,再用PBS洗去多余的荧光染料,后用500 μL的PBS重悬细胞,吸取200 μL于黑色背景96 孔板中,使用多功能酶标仪(Spark175型,帝肯(上海)实验器材有限公司),在488 nm的激发光和525 nm的发射光下,测定其荧光强度,另吸取200 μL于透明96孔板中,利用全波长扫描仪(Infinite 200型,瑞士Tecan公司),在600 nm下,读取吸光值,ROS的量以单位OD600的荧光强度表示,以空载菌株作标准化处理。
2 结果与讨论
2.1 E. coli和Z. mobilis来源的SoxR表达对于大肠杆菌的生长影响
NCBI数据库检索获得大肠杆菌及运动发酵单胞菌的soxR基因序列,蛋白序列比对表明二者序列相似性为53.47%。利用质粒pEZ15Asp在E.coliDH5α中表达E-SoxR或Z-SoxR,目的基因表达使用大肠杆菌强启动子PgapA[21](质粒构建参照图1(a))。以空载菌株pEZ作为对照,E-SoxR表达菌株命名为ER,Z-SoxR表达菌株命名为ZR。
E.coliDH5α野生型及重组菌株在无胁迫条件下的生长测试结果如图2(a)所示,与野生型菌株相比,质粒pEZ15Asp空载表达、过表达或异源表达目的基因对菌株生长几乎没有影响。E.coliDH5α在H2O2及糠醛胁迫条件下的生长结果如图2(b)和图2(c)所示,与空载菌株相比,过表达或异源表达的SoxR均未能明显改善重组菌株在胁迫条件下的生长。过表达大肠杆菌自身的SoxR还在一定程度上影响了菌株的胁迫耐受性。类似的,文献[22]报道在酵母细胞中过表达氧化还原敏感型转录因子Yap1同样不能增强菌株在胁迫条件下的耐受性,因此,单独转录因子过表达并不是增加菌株抑制物胁迫耐受性的有效途径。为了解决这一问题,需要联合下游基因共同作用。
2.2 SoxR对抑制物的响应
转录因子SoxR绑定PsoxS,因此在PsoxS下游连接荧光蛋白mCherry的基因进行SoxR功能的验证。利用质粒pEZ15Asp在E.coliDH5α中设计表达荧光蛋白mCherry的基因,以组成型启动子PgapA表达mCherry(质粒构建参照图1(a))作为对照,以受转录因子SoxR调控的启动子PsoxS表达mCherry[23](质粒构建参照图1(b))用于检测菌株自身基因组表达SoxR对抑制物的响应程度,同时在自身基因组SoxR表达的基础上检测过表达(E-SoxR-PsoxS)和异源表达(Z-SoxR-PsoxS)转录因子SoxR(质粒构建参照图1(c))引起的荧光变化。各菌株分别命名为:PgapA、PsoxS、ER-PsoxS和ZR-PsoxS。
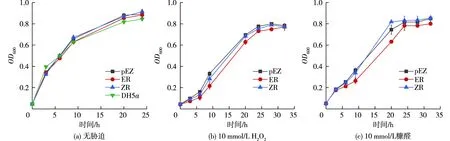
图2 E. coli DH5α野生型、空载pEZ、重组菌株ER/ZR生长分析Fig.2 E. coli DH5α growth analysis of wild-type,empty PEZ and recombinant strains ER/ZR
E.coliDH5α中在过H2O2和糠醛胁迫条件下荧光定量分析结果如图3所示,各元件的响应情况如表3所示。组成型启动子PgapA菌株在不同浓度抑制物条件下恒定表达,不能实现对抑制物浓度变化的智能响应。在不同浓度H2O2胁迫条件下,PsoxS、ER-PsoxS和ZR-PsoxS菌株荧光水平随H2O2浓度的增加而上升;相较于PsoxS菌株,过表达大肠杆菌自身SoxR可以提升菌株对抑制物的响应程度,ER-PsoxS本底表达和H2O2响应强度分别是PsoxS响应强度的1.1、1.2倍;而异源表达运动发酵单胞菌SoxR反而使得菌株的荧光表达水平降低,ZR-PsoxS本底表达低于PsoxS,H2O2响应强度与ER-PsoxS相近(表3)。不同浓度糠醛胁迫条件下,PsoxS、ER-PsoxS和ZR-PsoxS菌株荧光水平随糠醛浓度的增加先上升后稳定,过表达大肠杆菌自身SoxR可以提升菌株对抑制物的响应强度,ER-PsoxS的糠醛响应强度是PsoxS响应强度的1.3倍,而异源表达运动发酵单胞菌SoxR反而使得荧光水平降低,但其糠醛响应强度与ER-PsoxS响应强度一致(表3)。

图3 大肠杆菌中元件通路的验证Fig.3 Verification of element pathway in E. coli
大肠杆菌自身SoxR过表达增强菌株对胞内氧化还原电位的感应,能够更大程度地激活下游基因的表达。运动发酵单胞菌SoxR使得基因组荧光水平降低,推测其潜在机制包括:1)SoxR表达分流削弱了双向启动子表达mCherry的水平;2)表达分流基础上,运动发酵单胞菌SoxR也可以绑定到大肠杆菌SoxR的调控位点,但是起到了阻遏作用,使得荧光水平进一步降低。表3中过表达与异源表达元件的响应强度几乎一致,表明大肠杆菌和运动发酵单胞菌SoxR对荧光水平的影响幅度一致,结合二者序列相似性较高的分析,推测第二种原因的可能性更大。

表3 大肠杆菌和运动发酵单胞菌中的元件响应Table 3 Element response in Escherichia coli and Zymomonas mobilis
基于以上结果,笔者发现联合下游基因过表达大肠杆菌自身的SoxR能够增强菌株对抑制物的智能响应,因此可以在过表达大肠杆菌SoxR的基础上,联合下游受其调控的抗性基因,提升菌株的耐受性。
2.3 单基因菌株对于胁迫的响应
在E.coliDH5α中,利用质粒pEZ15Asp及soxR基因连接启动子PsoxS分别控制多种相关抗性基因的表达[24](质粒构建参照图1(c))。本实验选择的抗性基因有:fpr(编码铁氧还蛋白还原酶)[25]、katE(编码过氧化氢酶)[26]、soxS[27]、sodB(编码超氧化物歧化酶)[28]、trxB(编码硫氧还蛋白还原酶)[29]、zwf(编码葡萄糖-6-磷酸脱氢酶)[30]。对照菌株为空载pEZ,过表达菌株分别命名为:FPR、KAT、RS、SOD、TRX、ZWF,对改造菌株在各种条件下的生长性能进行测试。
大肠杆菌(单基因)改造菌株无胁迫及初始胁迫生长测试如图4所示,在无胁迫条件下,大肠杆菌重组菌株与空载菌株的生长几乎没有差异。初始添加10 mmol/L H2O2或糠醛的条件下,相较于只导入空载体的菌株,重组菌株均没有表现出生长优势,其中FPR菌株生长明显变差,说明表达fpr基因使得重组菌株变得更加敏感,这可能与胞内辅因子水平变化相关。

图4 大肠杆菌(单基因)改造菌株无胁迫及初始胁迫生长测试Fig.4 No stress and initial stress growth test of E. coli(single gene)modified strains
在OD600约0.5、体积分数为10%的接种量条件下,初始添加H2O2或糠醛不利于菌株建立耐受性,因此,选择菌株生长4 h后添加H2O2或糠醛。大肠杆菌(单基因)改造菌株对数期胁迫生长测试如图5所示,4 h添加5 mmol/L的H2O2后,培养20 h时,各菌株生长差异明显,ROS检测表明,菌株的生长状况与胞内活性氧水平有一定的相关性,即菌株生长越好,相较于空载菌株,胞内活性氧水平越低,其中表达katE基因使得生长提升量约15.1%(表4);4 h添加10 mmol/L的H2O2会对菌株生长造成暂时性抑制(4~5 h),20 h ROS水平与OD状况耦联。不同浓度H2O2胁迫表明,相较于空载菌株,表达katE基因可以稳定改善菌株生长,表达trxB基因不利于生长。4 h添加10 mmol/L的糠醛会对菌株生长造成15 h左右抑制,20 h后,菌株生长差异逐渐明显,45 h ROS水平与OD状况偶联,即相较于空载菌株,生长略有改善的重组菌株胞内的活性氧水平略低,生长越差的重组菌株胞内活性氧水平越高。糠醛胁迫表明,相较于空载菌株,表达sodB、trxB、zwf基因在33 h时,生长量分别提升11.5%、19.3%、15.5%(表4)。
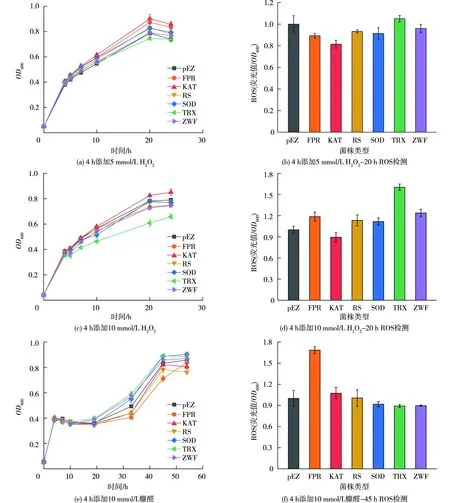
图5 大肠杆菌(单基因)改造菌株对数期胁迫生长测试Fig.5 logarithmic stress growth test of E. coli(single gene)modified strains
2.4 双基因菌株对于胁迫的响应
在H2O2单胁迫条件下选定katE基因,糠醛单胁迫条件下选定sodB、trxB和zwf基因,利用质粒pEZ15Asp分别构建了3株受SoxR控制表达的双基因菌株(质粒构建参照图1(d)),命名为PSK-SOD、PSK-TRX、PSK-ZWF。分别在无胁迫、单胁迫及双胁迫条件下对重组菌株的生长性能进行测试。
大肠杆菌(双基因)改造菌株无胁迫及对数期胁迫生长测试如图6所示,无胁迫条件下,双基因表达菌株PSK-TRX与空载菌株生长差异不大,PSK-SOD和PSK-ZWF菌株生长明显变差;结合图4(a)单基因表达菌株的生长状况,结果表明katE与sodB或zwf基因共表达为菌株带来较大的生长负担。菌株生长在4 h、添加10 mmol/L H2O2胁迫(图6(b))条件下,相较于无胁迫条件菌株生长变慢,但总体趋势不变;结合图5(a)和图5(c)分析可知,双基因共表达使得katE基因在H2O2胁迫条件下的抗性优势消失,并且katE与sodB或zwf基因共表达为菌株生长带来较大负担,导致生长速率降低且稳定期生物量低于空载菌株。在菌株生长4 h时、添加10 mmol/L糠醛胁迫(图6(c))条件下,相较于空载菌株,PSK-SOD和PSK-ZWF菌株能够在糠醛胁迫下较快地恢复生长,在19 h时,菌株生长量分别提升48.5%和12.0%(表4)。结合图5(e)和图6(a)分析可知,katE与sodB或zwf双基因共表达使得改造菌株在糠醛胁迫条件下能够克服生长负担,并且表现出更强的抗性优势。

图6 大肠杆菌(双基因)改造菌株无胁迫及对数期胁迫生长测试Fig.6 No stress and logarithmic stress growth test of E. coli(dual gene)modified strains
在菌株生长4 h时、添加H2O2和糠醛双胁迫条件下,单基因及双基因菌株的生长测试结果如图7所示,菌株生长4 h时,PSK-SOD和PSK-ZWF菌株的生物量略低于其他菌株的生物量,这是由于生长负担造成的,但添加抑制物后,相较于其他菌株,PSK-SOD和PSK-ZWF菌株能够极早结束延滞期恢复生长,表现出明显的生长优势。虽然双基因共表达更为高效地解决了糠醛和H2O2双胁迫的影响,但在解除胁迫之后,双基因的表达对大肠杆菌而言,反而成为一种生长负担,使改造菌株最终生物量低于空载菌株。28 h ROS检测表明,katE与sodB或zwf基因共表达能够快速有效清除胞内的活性氧,生长量分别提升53.0%和46.3%(表4)。
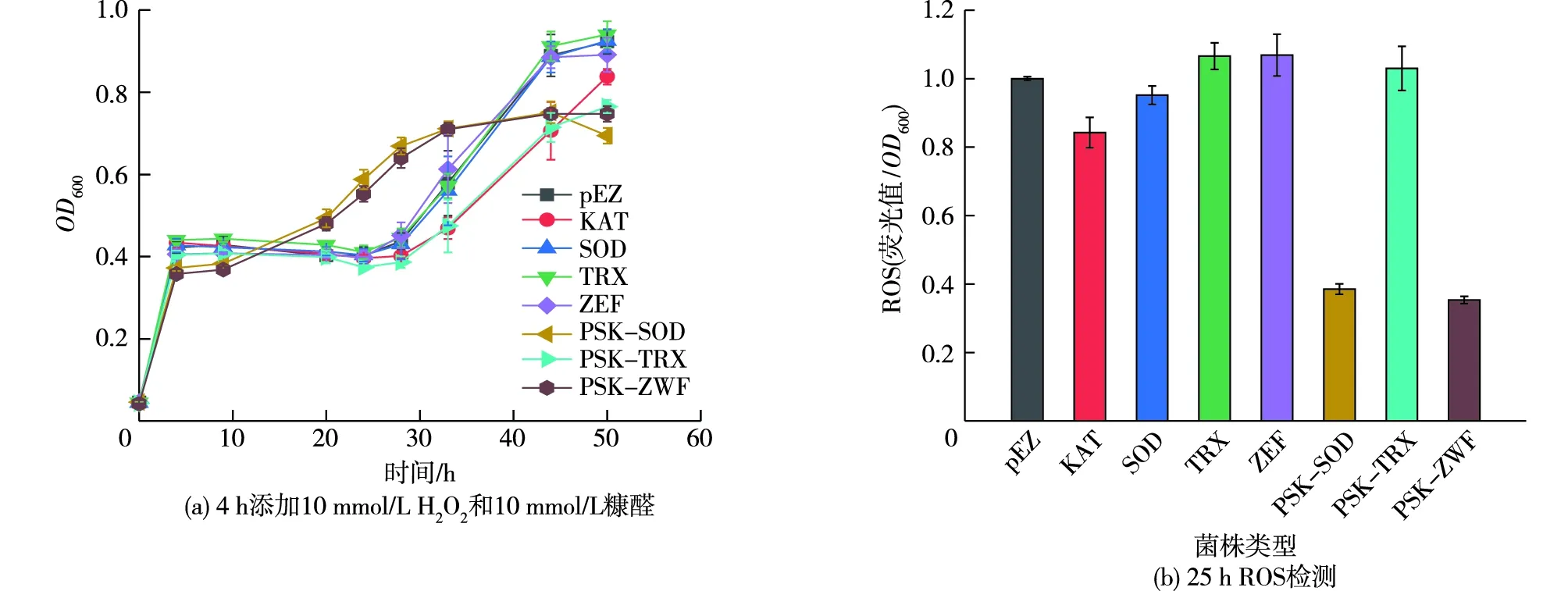
图7 大肠杆菌改造菌株双胁迫生长测试Fig.7 Double stress growth test of E. coli modified strains

表4 大肠杆菌改造菌株在抑制物条件下的生长改善Table 4 Growth improvement of modified Escherichia coli strains under inhibitor conditions
3 结论
1)氧化胁迫条件下,在E.coli中单纯表达soxR基因不能提高菌株的胁迫耐受性;
2)E-SoxR能够有效感应外界氧化刺激并控制下游基因的表达强度,Z-SoxR则体现出抑制下游基因表达的作用;
3)E-SoxR下游基因改造使菌株生长耐受性提高,菌株可以在复杂胁迫条件下,通过氧化原敏感型元件智能响应胁迫。
本研究利用合成生物学策略开发了针对性更强的干预系统,提高了细胞对复杂混合抑制物的胁迫耐受性,为高耐受性菌株的基因改造奠定了基础,对扩大微生物的工业应用具有十分重要的意义。

