甲基营养菌代谢过程新进展与代谢工程改造
周狄霏,冯晨曦,宋书真,杨 松,2,3*,马增新,2,3*
(1.青岛农业大学 生命科学学院,山东 青岛 266109;2.青岛农业大学 山东省应用真菌重点实验室,山东 青岛 266109;3.青岛农业大学 青岛生物沼气环境微生物国际合作基地,山东 青岛 266109)
第一次工业革命以来,随着石油和煤炭等传统碳基能源的开发和利用,人类社会的劳动生产率得到了极大提高,但推动社会进步的同时,也产生了严重的环境问题,CO2和甲烷等温室气体的大量外排,造成了全球温室效应的逐渐加剧,对人类的生存和持续发展构成重大威胁[1]。应对环境危机,世界各国积极响应减少温室气体排放,我国国家主席习近平在第七十五届联合国大会上提出了中国将于2030年前实现碳达峰,2060年前实现碳中和的目标[2]。如何更加有效地减少甚至利用这些温室气体作为化工原料,成为生物化工领域的近期研究热点和焦点之一,2019年国家科技部合成生物学重点专项和2021年绿色生物制造重点专项都将C1生物催化转化的研究和应用示范作为专项资助。近期Li等[3]、Wang等[4]发现CO2通过化学催化方法可以高选择性、高稳定性加氢合成甲醇。还有研究者发现CO2还可加氢高效合成甲酸[5]。甲醇和甲酸作为CO2的衍生物是甲基营养菌生长的天然碳原料[6],因而对甲基营养菌的代谢工程改造,不但将助力于CO2减排的持续发展需求,而且为生物化工行业利用甲醇和甲酸这类重要替代原料提供了可能的甲基细胞工厂[6]。
甲基营养菌是一类可以天然利用C1作为唯一碳源和能源生长的微生物[7]。前期研究报道了代谢工程改造的甲基营养菌可催化转化甲烷和甲醇合成各类平台化学品[7-9],近期研究者还发现一些甲基营养菌可以吸附和利用环境中的稀土元素,具有稀土金属生物富集冶炼的潜在能力,因此,甲基营养菌成为一类重要的应用于生物制造和环境修复的细胞底盘,受到了研究者的广泛关注[10-12]。甲基营养菌中心代谢主要包含3个代谢模块(图1),即C1氧化模块、异化模块以及同化模块。甲烷和甲醇通过氧化途径耦合异化途径可以彻底被氧化为CO2,该过程为同化途径和合成代谢提供还原力和能量;另一部分甲烷和甲醇的氧化产物(甲醛和甲酸)通过同化途径进入中心代谢,为生物大分子合成提供前体碳[13]。作为甲基营养菌中心代谢的起始点,甲醇脱氢酶的研究受到了极大的关注,主要研究集中在提高其在胞内表达水平和催化活性,从而提高甲醇消耗效率和中心代谢通量[14-15]。近年研究发现稀土元素(如,La、Ce、Gd、Nd)成为甲烷和甲醇氧化的关键调控因子,控制了不同类型的甲醇脱氢酶(即,MxaFⅠ和XoxF)的表达,影响中心代谢的通量分配[11-12,16-18]。基于对甲基营养菌中心代谢的逐步理解,研究者为了进一步提高甲基营养菌同化代谢效率,减少能量和还原力的额外损耗,提出了新的代谢工程改造策略,如,构建协同同化途径[19]、构建卡尔文循环[20](Calvin-Benson-Bassham cycle,CBB)、引入乙醛酸循环[21](glyoxylate cycle)和利用转录调控因子耦合生物传感器改造(sensor-assisted transcriptional regulator engineering,SATRE)[22],这些新策略为进一步提高甲基营养菌合成目标产品所需的代谢前体物奠定了一定的理论基础。
近年来,陶雨萱等[23]、Zhang等[24]、高教琪等[25]、Zhou等[26]、张卉等[27]和Wang等[15]已从微生物甲醇转化以及天然甲基营养型和合成甲基营养微生物细胞工厂构建等方面系统综述C1研究。本文主要侧重于阐述甲基营养菌依赖稀土元素氧化甲烷和甲醇的代谢调控机制,并综述了甲烷氧化菌为例的甲基营养菌中心代谢的新认知和甲醇利用菌代谢工程改造的新策略,以期为甲基营养菌进一步深入研究和改造利用提供一定的参考。

浅绿色区域—氧化代谢模块;粉红色区域—异化代谢模块;绿色区域—4种不同类型的同化代谢模块;XuMP cycle—木酮糖单磷酸途径;RuMP cycle—核酮糖单磷酸途径;Serine cycle—丝氨酸循环;CBB cycle—卡尔文循环;H4MPTP pathway—四氢蝶呤途径;Ru5P—5-磷酸核酮糖;He6P—6-磷酸己酮糖;Xu5P—5-磷酸木酮糖;F6P—6-磷酸果糖;FBP—果糖-1,6-二磷酸;G3P—甘油醛-3-磷酸;DHAP—二羟基丙酮磷酸;6PG—6-磷酸葡萄糖酸;RuBP—1,5-二磷酸核酮糖;PGA—3-磷酸甘油酸;PEP—磷酸烯醇式丙酮酸;Serine—丝氨酸;Malate—苹果酸;Glycerate—甘油酸;Glycine—甘氨酸;Acetyl-CoA—乙酰辅酶A;FDH—甲酸脱氢酶;MMOs—甲烷单加氧酶;NADPH—还原型烟酰胺腺嘌呤二核苷酸磷酸;NADP+—烟酰胺腺嘌呤二核苷酸磷酸;NADH—还原型烟酰胺腺嘌呤二核苷酸;NAD+—还原型烟酰胺腺嘌呤二核苷酸图1 甲基营养菌利用不同代谢模块同化甲醛、甲酸和CO2Fig.1 Formaldehyde,formate and carbon dioxide assimilated by methylotrophs used different metabolic modules
1 稀土元素对甲基营养菌中心代谢的调控
近年来研究发现,稀土元素的添加有利于甲基营养菌生长。该现象除了与“镧开关”调控两种类型甲醇脱氢酶的差异表达有关,还可能涉及中心代谢调控。2018年,Good等[35]以甲基营养菌M.extorquensAM1为研究对象,在添加和未添加La3+条件下,通过RNA-seq(RNA测序)转录组和靶向代谢组分析,发现在添加La3+后,M.extorquensAM1的甲醇氧化途径代谢物浓度发生了明显的变化,随着胞内甲酸盐浓度增加,丝氨酸循环途径和乙基丙二酰辅酶A途径(ethylmalonyl-CoA pathway,EMC pathway)也发生了显著改变,即,丝氨酸循环途径除乙醛酸外,大部分代谢物浓度不同程度减少,EMC途径中除甲基琥珀酰辅酶A(Methylsuccinyl-CoA)和甲磺酸辅酶A(Mesaconyl-CoA)浓度上调,其他代谢物均不同程度下调。在添加La3+后,研究者推测可能这些中心代谢物的变化导致了M.extorquensAM1菌生长速率提高15%~22%,生物量提高10%~12.5%。2018年,Akberdin等[18]对甲烷氧化菌M.alcaliphilum20ZR在添加La3+后的中心代谢变化进行了多维组学分析,发现在添加La3+后,菌体生长速率提高了28%,但碳转化率降低了30%~40%,结合蛋白质组和代谢物组数据,发现添加La3+导致脂肪酸降解途径强化,TCA循环(tricarboxylic acid cycle,TCA cycle)中间代谢物及下游氨基酸(如,谷氨酸、谷氨酰胺及天冬酰胺等)含量增加,而核酮糖单磷酸途径(ribulose monophosphate pathway,RuMP pathway)中多个代谢物含量降低(如,果糖-6-磷酸、葡萄糖-6-磷酸、磷酸烯醇式丙酮酸等)。作者推测XoxF甲醇脱氢酶可能具备直接氧化甲醇生成甲酸的功能,XoxF与pMMO(particulate MMO,微粒型甲烷单加氧酶)耦合效率高,有利于电子传递,强化了甲烷的氧化,从而提高了菌体的生长速率,但RuMP途径的代谢流受限,降低了生物量的碳转化效率。以上研究表明,两种甲醇脱氢酶系统的存在,增强了菌体对动态变化环境的适应性和竞争能力,也加深了对稀土元素调控不同类型甲基营养菌中心代谢途径的认知。

—金属螯合剂;+激活;-—抑制;TonB—TonB依赖的转运体;ABC—ABC转运蛋白;XoxF—XoxF型甲醇脱氢酶编码基因;mxaF—MxaF型甲醇脱氢酶编码基因;MxcQ—膜传感器信号转导组氨酸激酶;MxcE—双组分转录调控因子;MxbM—双组分转录调节因子(反应调节因子);MxbD—双组分转录调节因子(传感器激酶);mxbDM—编码双组分转录调节因子MxbD和MxbM的基因图2 甲基营养菌中La3+对甲醇脱氢酶的调控机制Fig.2 The regulation mechanism of lanthanum ionson methanol dehydrogenase in methylotrophs
随着上述理论研究的发现,也为利用稀土元素强化甲基细胞工厂合成化学产品提供了一定的借鉴,例如,在聚羟基脂肪酸(PHA)合成工程菌株M.extorquensAM1中添加La3+可强化菌体的生长[36];在△mxaF敲除的甲烷氧化菌MethylosinustrichosporiumOB3b中通过稀土元素(Ce3+)的添加和消除的两阶段培养,实现菌体生长和甲醇生产的不断切换[37]。未来随着研究者逐步阐明稀土元素调控甲醇脱氢酶以及中心网络的代谢机制,不但有助于进一步认识甲基营养菌甲烷和甲醇的代谢调控过程,而且为代谢工程改造甲基营养菌提高C1的中心代谢效率提供了新的思路。
2 甲烷氧化菌的中心代谢新认知
甲烷在全球储量巨大,估计约为2 000亿立方米[38],它被认为是下一代的碳原料,同时也是仅次于CO2的第二大温室气体,是减少温室气体排放的主要控制目标。甲烷氧化菌可以利用甲烷作为唯一的能源和碳源生长,在甲烷减排上具有广阔的应用前景。根据代谢途径的不同,可将甲烷氧化菌分为三类[39]:1)利用核酮糖单磷酸途径的Ⅰ类甲烷氧化菌(Ⅰ型和Ⅹ型,如M.buryatense5GB1、M.alcaliphilum20Z);2)利用丝氨酸循环途径的Ⅱ类甲烷氧化菌(Ⅱ型,如M.trichosporiumOB3b);3)利用卡尔文循环的Ⅲ类甲烷氧化菌(Ⅳ型,如Verrucomicrobia),如表1所示。
在Ⅰ型甲烷氧化菌中,由于M.buryatense5GB1菌具有生长速率快(比生长速率为0.23 h-1)、耐盐碱能力强(培养条件:质量分数为0.75%的NaCl、pH为9.5时生长最佳)等生理生化特点,是甲烷生物转化极具应用前景的细胞工厂[40-42]。2017年,Fu等[43]首次报道了基于13C标记的M.buryatense5GB1中心代谢通量分配,阐述了Ⅰ型甲烷氧化菌的中心代谢网络的代谢流分配特点。当M.buryatense5GB1以甲烷为碳源生长时,利用13C标记研究发现,RuMP途径将3分子甲醛缩合为1分子C3化合物(如,丙酮酸、磷酸烯酮式丙酮酸(PEP)),会导致所有中间代谢物都被13C完全标记,而丙酮酸和PEP下游羧化和脱羧反应会导致下游代谢物13C标记位置和程度发生改变,这为代谢通量模拟计算提供了可能性。同时通过对中心代谢一些重要中间代谢物(如,苹果酸、草酰乙酸)的标记模式进行分析,发现以甲烷为碳源生长时,M.buryatense5GB1菌的氧化型TCA循环是完整的,在分别敲除fumA和fumC(编码TCA循环的延胡索酸酶基因)突变菌株中进行13C示踪分析,发现突变菌株与野生型菌株相比,在苹果酸和草酰乙酸的13C标记模式上存在着明显差异。此外,阻断TCA循环将导致菌株合成还原力及能量受限,细胞生长缓慢。这些结果表明,TCA循环不仅为菌体合成生物量提供前体代谢物,还可以提供还原力和能量。该研究进一步补充对M.buryatense5GB1中心代谢的认知,为进一步代谢改造提供了更多的可能性。

表1 甲烷氧化菌的分类Table 1 Classification of methanotrophs
M.buryatense5GB1菌的培养过程,不仅培养基组分复杂,而且不同培养条件会对其细胞生长、碳代谢流分配、还原力以及能量再生等方面具有显著影响。2021年,Hu等[44]、郭树奇等[45]探究了M.buryatense5GB1菌在甲烷和O2不同摩尔比下优化生长的过程,发现在n(CH4)∶n(O2)为0.93时,获得最高比生长速率为0.287 h-1,进而通过比较转录组和代谢物组分析,阐述了其相关机制,结果表明与甲烷同化途径、磷利用途径和氮固定途径的相关基因转录水平提高以及丙酮酸浓度增加有关,该研究为后期代谢工程改造提供了一定的理论借鉴。M.buryatense5GB1是一种仅能以甲烷和甲醇为唯一碳源和能源生长的专性甲基营养菌[40],长期以来人们认为,在甲烷和甲醇作为碳源生长时,其中心代谢网络是相同的[40,46]。直到2019年,Fu等[47]通过代谢组和13C标记的代谢通量分析等方法证明了在分别以甲烷和甲醇作为碳源时,中心代谢发生明显变化。当以甲烷为唯一碳源时,甲烷首先氧化为甲醇,氧化所需电子大部分源于甲醇氧化,仅小部分来自NADH,而以甲醇作为碳源时,甲醇氧化所产生的电子直接进入呼吸链传递并泵出质子产生ATP,这些结果表明在以甲醇为唯一碳源时产生过量ATP。因此,与以甲烷为碳源生长相比,M.buryatense5GB1在甲醇上生长,NADH脱氢酶表达较低且通过NADH氧化磷酸化产生的ATP偏少。为进一步平衡ATP代谢,M.buryatense5GB1菌在甲醇生长时改变中心代谢通量分布,代谢流主要去往产生能量较少的2-酮-3-脱氧-6-磷酸葡萄糖酸途径(Entner-Doudoroff,ED途径),而不是糖酵解途径(Embden-Meyerhof-Parnas pathway,EMP途径)。基于上述研究,2021年,Nguyen等[42]进一步阐明ED途径是M.buryatense5GB1一个重要的代谢途径。当以甲烷作为碳源和能源时,研究者尝试敲除ED途径中编码磷酸葡萄糖酸脱水酶和2-酮基-3-脱氧-6-磷酸葡萄糖醛酸酯酶的基因edd和eda,但无法成功敲除,这证明了ED途径对M.buryatense5GB1以甲烷为碳源生长的重要性。随后研究者用诱导型启动子替换了edd-eda的天然启动子动态调控ED途径的edd和eda表达水平,通过生长表型、酶活分析以及代谢通量模拟(flux balance analysis,FBA),进一步证明了加强ED途径代谢流会导致合成ATP的减少,使得细胞生长缓慢,但细胞仍需要edd-eda低水平表达以平衡细胞的能量和还原力合成通量。虽然到目前为止,还没有成熟的机制解释 ED 途径的重要性,但ED途径在维持中心代谢通量平衡方面确实具有重要的调节作用。
在甲烷氧化菌中除了以上关于能量和还原力方面的研究外,在碳转化效率方面的研究也有一些进展。前人研究发现Ⅱ型甲烷氧化菌的代表性菌株M.trichosporiumOB3b在固定CO2方面具有更高效的能力。2013年,Yang等[48]和Matsen等[49]基于转录组、代谢组和13C标记代谢通量等分析策略,发现了M.trichosporiumOB3b(以甲烷为碳源,比生长速率为(0.038±0.004) h-1),其中有超过60%的生物量来自CO2固定,明显高于M.extorquensAM1中约50%的生物量来源于CO2(以甲醇为碳源,比生长速率为(0.118±0.004)h-1)。研究者推测M.trichosporiumOB3b通过有效利用中心代谢途径的羧化酶,如,磷酸烯醇丙酮酸羧化酶 (PEPC)、丙酰辅酶A羧化酶(PCC)、NADP+依赖性苹果酸酶(ME)、乙酰辅酶A羧化酶(ACC)、丙酮酸羧化酶(PCX),在同化6分子亚甲基四氢叶酸(methylene-tetrahydrofolate,Meh4F)的过程中固定8分子CO2,因此相比于M.extorquensAM1具有更强的CO2固定效力。上述研究为其他研究者改造M.trichosporiumOB3b催化甲烷合成3-羟基丙酸等产品的研究提供了借鉴[42]。
总之,甲烷氧化菌作为一个极具开发前景的C1细胞平台,对其生理生化特性、代谢网络以及调控机制的深入认知,将为甲烷氧化菌的代谢工程改造提供了新的思路。
3 甲醇利用菌中心代谢改造的新策略
甲醇利用菌的代表性模式菌是M.extorquensAM1,其中心代谢存在反应步骤多、能量和还原力消耗水平较高、同化效率偏低等制约问题[50],因此将其作为甲基细胞工厂,在合成高附加值化学品(如,3-羟基丙酸[19,51]、甲羟戊酸[22,52]、蛇麻烯[53]、1-丁醇[54]、异丁醇[55]、丁二烯[56]等)方面存在着前体物供给不足、能量和还原力受限、生长及产物合成速率偏低等限制问题,制约其作为高效甲基细胞工厂的发展潜力[27,52]。目前对于甲醇利用菌中心代谢网络改造主要有以下策略:利用同化途径转录调控因子突变体库耦合生物传感器高通量筛选,强化中心代谢途径中关键前体物的供给,提高下游产品产量[22,51];引入CBB循环,将中心代谢同化途径和异化途径解耦联,尝试利用CO2合成生物量而甲醇提供能量和还原力的混合营养型生长[20];引入乙醛酸循环途径替代EMC途径[21];整合天然甲基同化途径,构建更加高效、节能的协同同化途径[19](图3)。
2017年,Liang等[22]、Zhu等[52]以M.extorquensAM1作为细胞底盘工厂,引入异源基因构建了甲羟戊酸合成途径,但由于其前体物乙酰辅酶A是丝氨酸循环、TCA循环和EMC途径的关键节点,导致难以理性改造提高其胞内浓度,不利于为下游产品合成提供充足前体碳流。基于此,研究者开发基于甲羟戊酸生物传感器的转录调控工程策略,调控中心代谢通量重新分配。转录因子QscR能够调控丝氨酸循环中多个顺反子sga-hpr-mtdA-fch(分别编码丝氨酸乙醛酸氨基转移酶-羟基丙酮酸还原酶-NADP依赖性亚甲基四氢甲蝶呤/亚甲基四氢叶酸脱氢酶-次甲基四氢叶酸环化水解酶)、mtkA-mtkB-ppc-mclA(分别编码果酸硫激酶-磷酸烯醇丙酮酸羧化酶-苹果酰辅酶A裂解酶)和glyA(编码丝氨酸羟甲基转移酶)的表达。研究者利用易错PCR(polymerase chain reaction)方法对QscR进行随机突变,导致胞内中心代谢通量发生改变,进而通过甲羟戊酸生物传感器进行筛选发现了使乙酰辅酶A含量提升7%的QscR突变序列,从而导致甲羟戊酸产量提高1.6倍。应用类似生物传感器策略,未来可通过对中心代谢通量的动态扰动,寻找提高相应下游产物合成的重要突变位点,具有重要的理论和应用价值。
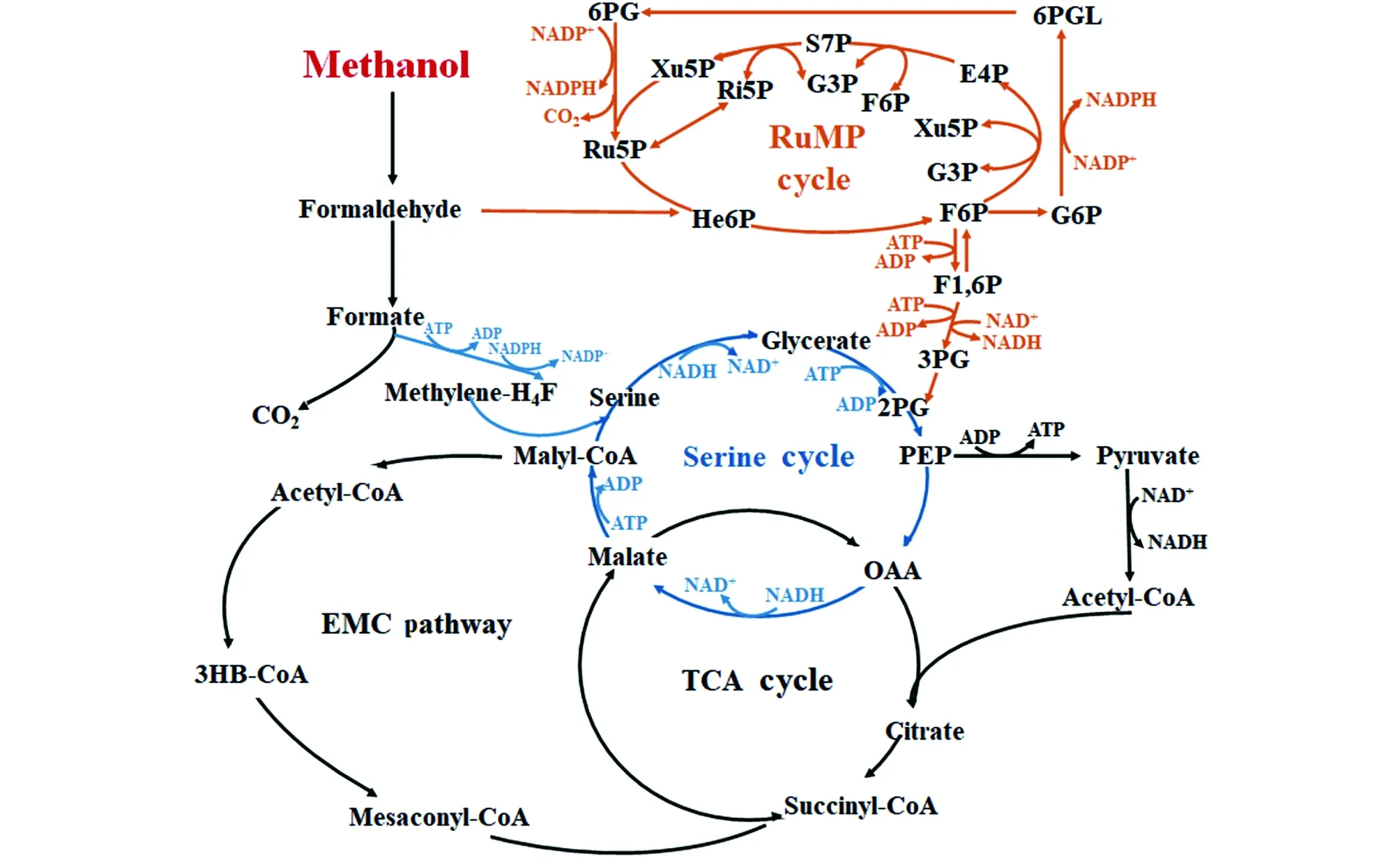
G6P—葡萄糖-6-磷酸;6PGL—6-磷酸葡萄糖酸内酯;Ri5P—核糖-5-磷酸;S7P—景天庚酮糖-7-磷酸;E4P—赤藓糖-4-磷酸;2PG—2-磷酸甘油酸;3PG—3-磷酸甘油酸;OAA—草酰乙酸;Malyl—CoA-苹果酰辅酶A;Pyruvate—丙酮酸;Citrate—柠檬酸;Succinyl—CoA-琥珀酰辅酶A ;Mesaconyl-CoA—中康酰辅酶A;3HB-CoA—3-羟基丁酰辅酶A;EMC Pathway—乙基丙二酰辅酶A途径图3 甲基营养菌协同同化途径Fig.3 Synergistic assimilation pathway of methylotrophs
2018年,Schada等[20]在M.extorquensAM1中异源表达用于CO2固定的CBB循环途径,尝试构建混合营养型甲基细菌。通过敲除甲醇同化途径必需基因ftfL(编码甲酸四氢叶酸连接酶),将同化途径和异化途径解耦联。敲除基因ftfL导致突变菌不能在甲醇上生长,作者进而引入驱动CBB循环的必需基因prk(编码核酮糖磷酸激酶)和ruBiosCO(编码1,5-二磷酸核酮糖羧化酶),使菌体生物量合成源于CO2的固定,能量和还原力由甲醇氧化供给。通过生长表型测定、13C示踪分析和蛋白质组实验[20],证明了该方法可以实现固定CO2合成生物量,但由于CBB途径不足以合成充足的乙醛酸、甘氨酸和丝氨酸等生长所需的前体物,使得同化效率低,不能维持菌体的持续生长。未来还需通过适应性进化(ALE)等策略进一步强化CBB循环重要底物核酮-1,5-二磷酸的供给以及CBB产物向生物量的转化。
2018年,Schada等[21]在M.extorquensAM1中又引入了乙醛酸循环途径,阻断了本源乙醛酸合成的EMC途径,尝试利用EMC途径的中心代谢物合成目标产品巴豆酸。作者通过过表达异柠檬酸裂解酶(aceA)和苹果酸合酶(aceB)引入了异源的乙醛酸循环途径,但在阻断了EMC途径的突变株中验证,均不能在甲醇上生长。酶活分析表明,甲醇氧化途径中的关键酶MeDH(甲醇脱氢酶)和FDH(甲酸脱氢酶)活性不足是造成甲醇生长缺陷的原因之一。作者进一步尝试添加乙酸作为碳源,强化了TCA循环,实现了基于乙醛酸循环的细胞生长,进而在敲除编码巴豆酰辅酶A 羧化酶/还原酶基因ccr的菌株中,异源表达CoA-硫酯酶,实现了提高巴豆酸的合成量。该研究证明了M.extorquensAM1中心代谢重塑的潜力,并为未来利用甲基营养菌 EMC途径的中间代谢物合成下游产品提供了一定的借鉴。
M.extorquensAM1利用丝氨酸循环同化甲醛时存在着代谢反应步骤多、高耗能、高耗还原力等缺陷,每生成1分子乙酰辅酶A时,消耗3分子ATP和3分子NAD(P)H,不利于高还原度产品的合成。而Ⅰ型甲基营养菌的RuMP途径耦合非氧化性磷酸戊糖途径(non-oxidative pentose phosphate pathway)及EMP途径时,每生成1分子乙酰辅酶A时,产生1分子ATP和2分子NADH,比丝氨酸循环具有明显的还原力和能量合成优势,但也存在同化过程中产生CO2导致三分之一的碳损失问题。2021年,Yuan等[19]基于基因组尺度的代谢通量分析预测,将RuMP途径引入M.extorquensAM1菌中,构建与丝氨酸循环协同同化甲醛的细胞底盘,显著提高菌体的生长效率,结果见图3。研究者首先在M.extorquensAM1中敲除丝氨酸循环相关基因hprA(编码羟基丙酮酸还原酶),构建了甲醇同化缺陷型菌株,进而引入RuMP途径必需基因hps(编码己酮糖-6-磷酸合成酶,HPS)和phi(编码己酮糖-6-磷酸异构酶,PHI),通过甲醇和琥珀酸双碳源体系筛选出hps-phi的最佳组合。为进一步提高RuMP途径同化甲醛的效率,增加前体物Ru5P的供给,研究者过表达氧化型磷酸戊糖途径关键基因zwf(编码葡萄糖-6-磷酸脱氢酶),并引入异源磷酸果糖激酶(PFK),使代谢通量能够从F6P去往C3中间代谢物,使得协同同化途径进一步加强,细胞比生长速率提高了16.5%,甲醇消耗速率提高13.1%,还原力NADPH含量提高了1.3倍。以该底盘细胞生产3-羟基丙酸,摇瓶产量是对照菌产量的3.1倍,初步发酵罐放大培养后,产量达到0.857 g/L。该研究证明构建协同同化途径是提升甲基营养菌中心代谢碳效率以及还原力水平的有效策略,但是目前构建的协同同化菌株RuMP途径同化效率仍然较低,未来需要进一步的优化改造。
4 展望
虽然人们发现了稀土元素对于甲基营养菌的甲醇和甲烷代谢存在调控作用,也发现了其中参与的一些关键元件,但其确切调控机制还有待于进一步挖掘,例如,甲基营养菌是如何感知并转运稀土元素,以及稀土元素如何通过MxcQE/MxbDM调控系统对xoxF、mxaF基因启动子进行调控[29],xoxF如何对mxaF转录进行调控[17]等。稀土元素对于甲基营养菌调控机制的系统阐明,将有助于进一步认识甲基营养菌对于甲醇和甲烷代谢的调控机制,拓展其在金属富集冶炼和化学品生物合成等[58]领域的应用。
目前,关于甲基营养菌中心代谢的工程优化改造仍存在一些问题,首先将 C1利用的异源途径(如,RuMP途径)引入天然底盘菌中构建协同同化途径[19],虽然加快了菌体生长速率,促进了胞内代谢物合成,但未能明显加强碳转化率,且引入的异源同化途径和本源同化途径适配性不高,产品合成效率偏低,因此如何进一步提高RuMP和丝氨酸循环途径的协同性,强化RuMP关键底物核酮糖-5-磷酸的供给,仍然是亟待解决的科学问题。未来通过对中心代谢路径更加优化的理性设计,以及结合适应性进化策略,从而对菌株的代谢网络结构进行更合理改造是行之有效的解决思路。
近年来,随着对甲基营养菌的深入研究,遗传改造工具得到快速开发利用,如,2019年,Carrillo等[59]以M.extorquensAM1为宿主,成功构建出不同表达水平的IPTG(异丙基-β-D-硫代半乳糖吡喃糖苷)诱导型启动子,该系列启动子的发现为未来甲基营养菌深入工程改造提供一个备选的工具;2020年,笔者实验室和清华大学邢新会课题组合作,Mo等[60]首次在甲醇利用菌M.extorquensAM1中构建CRISPRi(短回文重复序列)技术,为挖掘M.extorquensAM1的潜在功能基因以及从甲醇中生产高附加值产品提供了另一个有用的改造工具。Small regulatory RNA(小调控核糖核酸,sRNA) 作为细菌中一个重要的调控因子,已被应用于多种菌株的基因抑制,2021年,Zhu等[61]以M.extorquensAM1为宿主,构建了一个与大肠杆菌MicC和内源性Hfq结合的sRNA系统,该系统通过靶向干扰类胡萝卜素合成相关基因crtl,减少类胡萝卜素的产生。此外针对甲烷氧化菌异源基因表达,大多数方法还是通过菌菌结合方式实现,耗时较长、操作复杂,而且需要帮助菌株进行辅助[62]。2021年,Hu等[63]优化了甲烷氧化菌M.buryatense5GB1的电击转化技术,显著提高了转化效率。这些遗传改造工具的开发,为促进甲基营养菌的细胞工厂构建提供了有效技术支撑。
当今甲基营养菌已经成为直接或间接催化转化温室气体(甲烷、CO2)及其衍生物(甲醇、甲酸)生产高附加值产品的重要细胞工厂之一,未来随着对甲基营养菌的深入研究及其遗传改造工具的日趋完善,将会进一步促进甲基营养菌在生物化工领域的广泛应用。

