人工多元产甲烷系统的设计与构建研究进展
钱宇磊,沙蕴璐,陆春艳,雍晓雨,颜 素,贾红华,周 俊
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 生物能源研究所,江苏 南京 211800)
甲烷(CH4)的热值高达890 kJ/mol,是废弃碳资源高值化利用的重要产品之一,被誉为最有潜力的清洁燃料。从甲烷出发的生物、化工平台可实现H2、甲醇、乙烯等众多高价值化学品的转换。在我国“双碳”政策背景下,废弃碳资源的生物甲烷化技术,可同时实现环境污染物的转化与清洁能源的量产,兼具节能、减排和资源化利用的三重战略意义。
厌氧消化技术是目前进行废弃物处理与能量回收的有效且可持续的主流技术之一。传统厌氧消化体系存在天然的多菌群分步代谢过程,众多水解菌、产酸菌对废弃碳资源进行分解转化,最后被产甲烷菌利用产生以甲烷为主的沼气。传统厌氧消化体系多菌群、多反应、多相的复杂条件给现有废弃碳资源厌氧消化制甲烷体系的可控性与稳定性带来巨大挑战。通过人工构建互营产甲烷体系,厌氧消化系统中发酵菌与产甲烷菌间独特的电子连接方式,即,种间电子传递机制被逐步挖掘。近十年来,科研工作者对直接种间电子传递(DIET)的研究颠覆了人们对产甲烷微生物群落功能的理解,重新设计与优化电活性细菌与产甲烷菌的DIET途径与通量,有望在沼气工程厌氧消化效率的提升方面带来新的突破。
随着合成生物学、生物信息学、纳米材料科学和光电催化等领域的交互研究日益深入,通过集成机械元件(高太阳能/电能转换效率)与生物催化(可再生性和高选择性)的优势,实现太阳能到化学品的高效转换,显著超越了自然光合作用的固碳效能。由光电催化装置传导的外源电子将作为生物电子的补充,极大地加速了微生物的胞外及种间电子传递过程,同时,可再生电能/太阳能是克服生物甲烷的八电子转移能垒的重要能源策略。这类生物-材料杂合产甲烷系统成为生物甲烷的前沿技术之一,筛选高效能量转化的催化材料、借助基因工程构建特异性的电活性产甲烷菌株/菌群,再经过设计组装实现混合体系的高效稳定运行,为新型生物甲烷系统的放大与应用提供有效的理论指导。
综述了传统厌氧消化系统中的常用改进措施与潜在问题,重点解析了厌氧消化过程中的潜在电子转移机制,介绍了采取合成生物学手段强化产甲烷的策略,最后提出了在光电催化材料辅助下的新型生物甲烷体系的设计与构建策略,为高效稳定的人工多元产甲烷多细胞系统的构建提供理论指导。
1 传统混菌厌氧消化系统产甲烷强化措施
厌氧消化分为水解、产酸、产乙酸和产甲烷4个阶段(图1),由于其庞大的底物处理范围而被广泛推行。废水、污泥、农畜粪便、农林废弃物和餐厨垃圾等不同的厌氧消化底物的组成成分具有很大差异,为了确保不同底物中的碳水化合物、蛋白质和脂类这三类主要有机成分的平衡,有效激活厌氧消化过程,常用的一种策略是多种底物进行共消化[1]。共消化的优势在于通过消化过程中的协同作用调整碳/氮质量比、pH、微量元素、毒性物质等厌氧消化过程中的基础参数,从而构建一个稳定有效的有机垃圾综合资源化处理系统[2]。例如,餐厨垃圾在单独消化过程中,由于水解速度过快,会导致挥发性有机酸的积累,与污泥或动物粪便的共消化可有效缓解系统的酸抑制效应,Yin等[3]采用餐厨垃圾与污泥共消化,将原有每克挥发性固体底物的单日甲烷产量从(97.6±0.6) mL 提升到(121.8±0.2) mL;Chuenchart等[4]将餐厨垃圾与鸡粪以7∶3的挥发性固体质量比混合,在优化挥发性有机酸积累量的同时,甲烷产量相较单底物消化提高了88%。此外,利用生物添加剂(真菌、功能菌群、酶等)进行预处理相较物理预处理方法(机械处理、热处理、微波处理等)具有条件温和可控、操作简便、低能耗等优势。一些白腐真菌(Fusarium、Pleurotus、Polyporus、Phanerochaete、Ceripoioposis、Trametes等)能够同时降解纤维素、半纤维素和木质素等难利用原料,从而提高水解这一限速步骤的速度,加速后续步骤的进行[5]。除了真菌添加剂外,Zhong等[6]将真菌酵母(Saccharomycescerevisiae、Coccidioidesimmitis、Hansenulaanomala)、纤维素分解/半纤维素分解/木质素分解细菌(Bacilluslicheniformis、Pseudomonassp.、B.subtilis、P.florida)和乳酸菌(Lactobacillusdeiliehii)进行组合,添加至以秸秆为底物的厌氧消化系统中,其甲烷产量增加了25%~96.6%。由不同功能菌种组成的微生物菌群用以增强底物中纤维素、半纤维素和木质素降解,同时稳定水解阶段的pH等环境参数,增加底物的可利用性,从而提升甲烷产率;此外,一些纤维素酶、半纤维素酶和脂肪酶等酶蛋白的直接施用也能在一定范围内提高甲烷产量[7]。导电材料作为非生物添加剂,经常被添加在厌氧消化系统中,提高效率与稳定性,碳基导电材料,例如,生物炭兼具吸附毒性物质和固定微生物的作用,为细菌与古菌提供适宜的生长环境,缩短种间距离,促进种间电子传递[8]。历经4个阶段厌氧消化底物产生的沼气通常还包含CO2、H2S等杂质,需要利用沼气工程的下游工艺专一性提高甲烷纯度,即沼气提纯。该过程可以通过耦合微生物电解槽与厌氧消化系统实现,通过引入外源H2,氢营养型产甲烷菌在阴极利用阳极电解水产生的质子和外电路电子可以原位实现CO2到甲烷的转化[9]。类似的生物法进行原位沼气提纯相较变压吸附、水洗、化学吸收等理化方法,具有环保与低成本的优势。由于生物的特异性催化,以CO2为主的杂质气体可被转化为不同多碳化学品被循环利用。

图1 厌氧消化甲烷生成过程示意Fig.1 Schematic diagram of methane formation in anaerobic digestion
在厌氧消化的上游阶段,需要仔细评估混合多种不同底物进行反应的实际效果,由于底物化学成分和生物组成背景的复杂性,共消化过程中的微生物群落结构将受到显著冲击而改变。一些简单的外源添加剂尽管结构组成信息较为清晰,在放大生产中同样需要兼顾一系列问题,例如,生物添加剂的活性与纯度、非生物材料的回收与二次污染等[10]。下游阶段集中解决的问题为甲烷提纯,目前引入电化学系统来提供氢和电子是完成沼气提纯的主要技术手段,但其装置搭建和运行成本等问题成为制约沼气工程的规模化与产业化的难点[11]。此外,作为厌氧消化过程中的核心,厌氧微生物群落在各种发酵处理条件下的结构组成和功能转变仍未被研究透彻,利用元组学技术、高通量测序等手段能够从分子层面深入挖掘其响应机制,从而构建更为合理的系统动力学模型,并反馈到实际厌氧消化过程中[12]。
2 人工互营产甲烷体系中电子传递机制分析
为了更好地理解混菌厌氧消化体系中的菌群互作机制与共生网络关系,常用的一种研究手段是从厌氧消化菌群中提炼出几种特定功能菌种,针对性地构建人工互营产甲烷体系[13-15]。该体系中涉及的微生物主要可分为两大类,即,胞外电活性细菌(EAB)和电营养型产甲烷菌(electrotrophic methanogen)[16-18]。前者氧化分解低分子醇类或挥发性脂肪酸,产生产甲烷前体甲酸、乙酸、H2/CO2等,同时能直接将电子传递至胞外其他微生物或导电矿物等。后者直接或间接接受来自电活性细菌的电子,通过氢营养型、乙酸营养型或甲基营养型途径完成产甲烷过程。电活性细菌氧化有机底物产生过量的还原力,产甲烷菌作为微生物电子汇(electron sink)吸收并消耗这些还原力用作自身新陈代谢,两者间进行电子转移的能量“交易”过程,即种间电子传递(IET)[14,19]。IET可区分为间接(IIET)和直接(DIET)两种电子传递方式,IIET通过可扩散化合物(H2、甲酸盐等)或电子穿梭体(半胱氨酸、核黄素等)介导电子转移,DIET以种间直接接触、导电菌毛或细胞色素c蛋白的表达等实现电子传递,该过程在碳基导电材料等参与下得到强化(图2)。上述互营模式激发了菌株间的代谢生长,巧妙地消除了环境中分解代谢障碍与能源缺乏问题[20],例如,互营体系中氢营养型产甲烷菌利用这部分气体用于电活性发酵细菌,产生大量H2从而缓解体系中的热力学抑制现象[21]。

图2 种间电子转移方式的类型Fig.2 Schematic diagram showing different mechanisms of interspecies electron transfer
近50年来,互营产甲烷系统的种间电子转移是主要以H2为中介体的电子传递过程(HIT)[22-25]。电子供体菌以脂肪酸、醇和芳香化合物等作为底物,代谢产生H2,产甲烷菌通过氢化酶等吸收H2并转移至胞内,进而完成下游链式生化反应,该过程是厌氧土壤、污泥沉积地和人工厌氧消化池等环境中最为基础的电子转移方式[21]。H2的种间迁移符合菲克扩散定律(Fick’s diffusion law),H2的缓慢扩散导致种间电子转移效率低下[26]。一旦H2的消耗量跟不上产量,例如,在糖类和氨基酸发酵过程中,过量H2导致挥发性脂肪酸等中间产物积累,引起pH骤降和热力学能垒障碍,使互营体系崩溃[27-28]。在一些环境中,由于甲酸盐的扩散系数是H2的3倍,由甲酸盐介导的间接电子传递成为主要形式[29-30]。尽管基于HIT的微生物生理生化过程的研究已大量开展[20,31],目前还鲜有工程策略能够精准强化种间H2/甲酸盐电子转移过程。
为此,研究人员致力于挖掘IIET以外的种间电子传递方式。2010年,Summers等[32]通过人工构建Geobactermetallireducens(Gm)-Geobactersulfurreducens(Gs)两种电活性细菌的共培体系,首次证明了直接种间电子传递(DIET)的存在,Gm-Gs共生体偶联了单菌所无法完成的乙醇氧化和富马酸还原的电子转移过程。这类电子传递方式不需要H2和甲酸盐作为中介体,也不依赖腐殖酸、核黄素等氧化还原电子穿梭体,是一种新型的自由且高效的电子传递方式,此后大量关于DIET的研究集中于Geobacter的互营体系,并逐步扩展到甲烷古菌的共培养体系中(表1)。

表1 人工互营体系中直接种间电子传递研究进展Table 1 Recent studies on direct interspecies electron transfer in artificial syntrophic consortia
互营体系的DIET依靠特殊的电活性膜蛋白结构完成细胞-细胞的偶联。纳米导线(nanowire)是电活性细菌编码并组装的具有导电性的胞外纳米丝状蛋白,能够向外源电子受体(三价铁氧化物或产甲烷菌等)以微米级尺度长程传递电子,通过形成导电性生物膜促进电极-细胞间的电荷传输[44-46](图3)。以典型的Gs菌为例,其纳米导线结构分为导电菌毛和OmcS细丝两种。导电菌毛(e-pili)是由61个氨基酸的单体蛋白PilA组装而成的四型菌毛蛋白,其直径约为3 nm,单个菌毛的导电性可达51 S/cm(pH=7.0),导电性的产生可能源于芳香族氨基酸π-π轨道的堆积重叠[47-48]。在对e-pili 的三维结构进行分析的过程中,利用冷冻电镜意外地发现了OmcS细丝,这种包含6个血红素的细胞色素蛋白构成的纳米导线并非典型的菌毛结构[49],对其进行敲除实验后发现细菌仍可依靠e-pili实现三价铁的还原,证明这类导电细丝与e-pili功能上的差异性[46]。与Gs菌的导电菌毛的同源基因可以延伸至Betaproteobacteria、Deferribacteres等种属[50],由此可见,纳米导线在厌氧环境中的广泛存在,但对其电子传递机制的推论(类金属导电性假说[51]、电子跃迁假说[52]等)众多,有待进一步验证。
细胞色素是与细胞膜结合的一类金属蛋白,通过改变自身的氧化还原状态参与到胞外电子传递(EET)过程中[18]。Geobacter中存在多种细胞色素c蛋白,除前文中提及的OmcS外,常见的细胞色素蛋白包括OmcB、OmcZ、PpcA、PccH等,能够完成电极表面的电子交互过程和实现三价铁还原,在共培体系中体现表达差异[53]。电活性细菌ShewanellaoneidensisMR-1的EET过程主要依赖金属还原途径(Mtr pathway),其主要蛋白成分为CymA、MtrA、MtrB、MtrC和OmcA,除MtrB作为联通MtrA和MtrC的孔蛋白外,其余均为细胞色素蛋白,可通过其多个血红素辅基中Fe2+/Fe3+的氧化还原价态变换快速介导电子传递。主干部分为mtrCAB基因编码的3个蛋白形成孔蛋白-细胞色素c复合物MtrCAB,胞内电子由内膜的CymA传递至周质蛋白MtrA,经由MtrC传递至胞外OmcA或外部电子受体[54]。另外,不同于上述情况,自养光合细菌沼泽红假单胞菌利用位于细胞膜的细胞色素Pio蛋白复合体进行胞外电子的单向获取,并将电子传递至光合反应系统,进行ATP能量合成[55-56]。部分细胞色素可以单独作为基体构成纳米导线参与DIET,如,ShewanellaoneidensisMR-1的“纳米导线”实际是长链囊泡-连续细丝的外膜和周质的延伸过程演化而来,其导电性源于纳米导电线外围的多血红素细胞色素复合结构[57]。在最新的研究中,通过原子力显微镜直接观测到了上述野生型Gs菌中细胞色素OmcS构成的纳米导线,其长度为4 nm,占比约为e-pili的十分之一,具有与e-pili相似的导电能力[58]。通过多个细胞色素蛋白直接接触形成的电子传递发生在甲烷氧化菌ANME-2和硫还原菌(SRB)的互营体系中,细胞色素c不仅附着于两菌的细胞膜上,在胞外细胞空间也大量分布构成了紧密连接的生物导电网络,尽管通过血红素染色实验证实了细胞色素c的存在,通过这种方式实现的长程电子传递仍缺乏直接证据[37],此外,在Geobacter的共培实验中单一表达细胞色素并不能完全支持DIET的进行[59],细胞色素的潜在电子传递能力和其与纳米导线间的功能交叉将是今后DIET研究的一个重点方向。
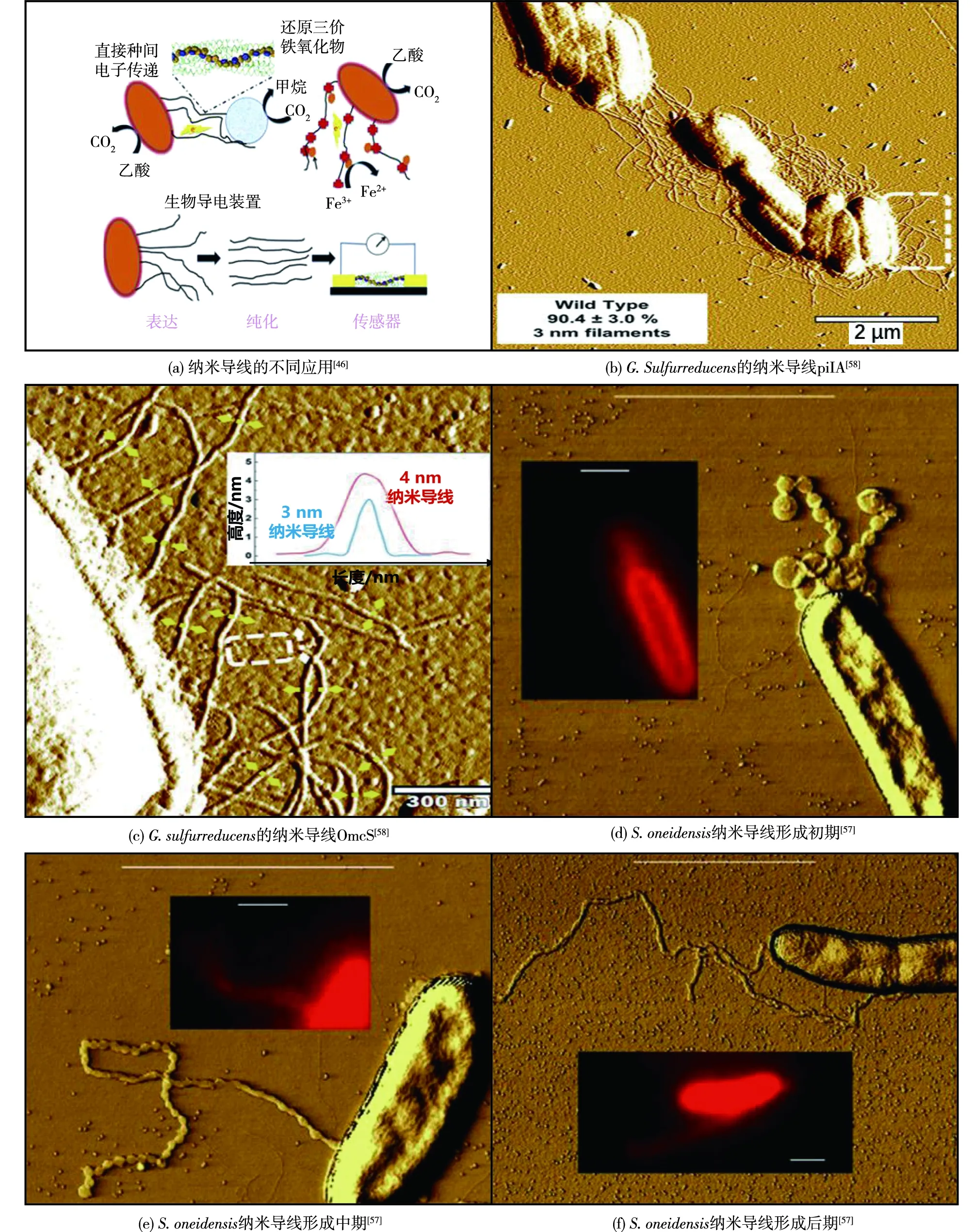
图3 纳米导线的功能与结构观测Fig.3 Functional and morphological characterization of nanowire
甲烷古菌胞外电子传递的方式呈现多样性。与电活性细菌Geobacter和Shewanella类似,Methanosarcinales存在膜结合的细胞色素蛋白介导胞外电子转移。Methanosarcinabarkeri细胞膜上存在能量转换氢酶(Ech)、F420还原氢酶(Frh)和甲基苯丙嗪依赖性氢化酶(Vht)具备显著的电子传递能力,与作为电子载体的辅酶(Fd、F420、MP、CoB)共同作用形成跨膜质子梯度,进行ATP能量合成驱动产甲烷过程。对上述氢酶进行基因敲除,古菌在阴极负载仍具有电催化产甲烷活性,表明有独立于氢酶的电子传递机制存在[60]。在转录组学分析HIET和DIET的差异实验中,F420脱氢酶(Fpo)和CoB-S-S-CoM还原酶(HdrABC)被上调表达,Fpo将还原型MP氧化并传递电子给辅酶F420,在胞内HdrABC的作用下,还原型F420的电子被分叉转移至Fd和CoB的还原,从而激活产甲烷通路[61-62]。特别地,专性氢营养型产甲烷菌Methanospirillumhungatei合成一种被称为古菌菌毛(archaella)胞外细丝[63],其结构和起源类似于Geobacter中的四型菌毛,其导电性通过原子力显微镜测定,其中一个紧密堆积的苯丙氨酸核心结构被认为是导电性的关键[64],这暗示在古菌体系中可能存在e-pili。大多数甲烷古菌(Methanococcales、Methanobacteriales、Methanomicrobiales和Methanopyrales等)并未存在与细胞膜结合的细胞色素蛋白,仅通过H2/甲酸盐作为电子中介体,还原CO2产甲烷,以Methanococcusmaripaludis为例,其分泌氢化酶和甲酸脱氢酶等与阴极表面接触催化H2和甲酸盐的形成,被快速利用产生甲烷[65-66]。
导电矿物(例如,磁铁矿、黄铁矿等)在自然界中广泛存在,被推断在某些环境中(深海沉积地等)促进微生物的远距离电子转移[67]。这类金属矿物的导电性能远超生物结构且省去了生物表达电活性蛋白所需的能量需求。导电材料(例如,活性炭、生物炭、高分子导电聚合物和其他碳基纳米材料等)投加到纯培养互营体系或是厌氧混菌发酵反应器中,可以显著促进直接种间电子传递(DIET)过程,这类细胞-导电材料-细胞的接触模式被划归为种间电子传递的一种新模式细胞-导电材料-细胞的接触模式(CIET),文献[14,68-71]已对CIET的机制进行了详细的综述。导电材料的添加可以弱化或替代共培体系中电活性蛋白的表达,例如,无法表达菌毛的Gs-Methanosarcinabarkeri(Mb)双菌在颗粒活性炭(GAC)的介导下完成互营[36]。部分导电材料(GAC、生物炭)本身由于特殊的多孔结构与表面官能团,而具有催化与吸附性能,能够对体系中潜在的难降解有毒化学物质(挥发性有机酸、偶氮染料等)进行捕获或分解,从而提升产甲烷生物活性[70,72]。不同导电材料的尺寸和比表面积差异很大,其促进DIET的机制也大不相同。碳基材料具有较大的比表面积,为微生物提供生物膜黏附位点,有利于菌群团聚和直接接触,从而加速代谢信息交换[73]。纳米尺寸的小型导电材料可以穿透微生物细胞膜,并在种间形成电子导管,促进电子传递,甚至可以取代部分膜结合导电蛋白发挥作用[74]。互营体系中的DIET效能可以直接通过导电率(electrical conductivity)来反映[69],导电材料可通过改变菌群结构来调整体系的导电率。早期实验证明导电材料可显著富集Geobacter,该菌通过表达pili结构在材料表面交联成具有高导电性的生物膜,同时使菌群中的电子转移方式更倾向于DIET[75-76]。然而大多数情况下Geobacter的种群占比很小,甚至不存在,不能排除富集其他功能菌对DIET的潜在促进作用。值得一提的是,某些导电材料的添加直接提升了产甲烷菌的活性,例如,不同浓度的碳纳米管(CNT)对4种产甲烷菌的代谢产气均有促进,这是导电材料独立于DIET以外影响甲烷产率的又一大因素[77]。导电材料的化学性质(导电性、氧化还原电位)及物理性质(尺寸、比表面积、粗糙度等)区别较大,其对DIET的贡献也不可一概而论,后续的CIET研究将集中于总结出不同性质的材料与电子传递和产甲烷活性间的规律。
随着越来越多的微生物被证实具有胞外电子传递活性,涉及种间电子传递的互营体系已不局限在Geobacter与产甲烷菌种之间。例如,Ha等[40]报道了光自养绿色硫细菌Prosthecochlorisaestaurii(Pa)和Geobactersulfurreducens之间存在的厌氧光互营DIET机制,Gs菌通过氧化乙酸向Pa菌传递电子,使后者完成固碳和生物质积累。上述互营体系的DIET依赖于细胞-细胞的直接接触和膜结合细胞色素的表达。近来,Liu等[78]研究的两种特殊DIET互营体系都聚焦在光合细菌Rhodopseudomonaspalustris(Rp)上,这类微生物具备多样的营养利用途径,且被证实能够向电极传递电子。在与Gm菌进行共培的实验中,Gm菌氧化乙酸作为电子供体伙伴向Rp菌直接传递电子,使其完成CO2的固定,Rp菌基于卡尔文循环的固碳作用通常在厌氧光自养状态下完成,在化能自养条件下,生长又需要O2参与,而Gm-Rp形成的涉及DIET的厌氧黑暗固碳模式在该研究中被首次揭露。另一项实验[43]将Rp与Methanosarcinabarkeri进行共培,Rp菌捕获光能进行代谢,直接向Mb提供产甲烷所需的电子,被视作天然的全细胞生物光敏剂,为构建人工光能-甲烷生物转化体系提供了全新的视角。
3 产甲烷底盘微生物的筛选与设计
图4为生物甲烷产生的主要途径[79-80,98]。传统的甲烷古菌,大部分均能以氢营养途径依靠Wolfe循环完成CO2—CH4的七步八电子还原反应[79];而乙酸型产甲烷菌(例如Methanosaeta)需要互营细菌经过Wood-Ljungdahl反应产生产乙酸再被自身代谢利用,少数产甲烷古菌(Methanosarcinacea、Methanomassiliicoccus和Methanosphaera)也可以依靠甲基营养型途径产甲烷[80]。不同产甲烷途径中均涉及多种辅酶的氧化还原再生,一类是电子载体(铁氧还蛋白Fd、F420、甲烷吩嗪MP等),另一类作为碳载体(甲烷呋喃MF、四氢甲烷蝶呤H4MPT、四氢八叠甲烷蝶呤H4SPT、辅酶M、CoM等)。辅酶的再生依靠能量传递蛋白(如EchA-F、VhoACG-HdrDE、MvhADG-HdrABC、Frh等),其多数分布于膜结合区域,具有胞外电子传递能力[62]。特别地,甲基辅酶M还原酶Mcr催化CH3-S-CoM还原产生甲烷,作为产甲烷的最后一步在任一营养途径中均存在,编码Mcr的其中一个基因(mcrA)被广泛用于产甲烷古菌的存在与活性鉴定[81]。为适应不同环境下的底物浓度变化,编码或不编码细胞色素蛋白的甲烷古菌利用不同的转录激活/抑制因子来调节产甲烷过程[82],然而任何一步的终止或抑制均导致产甲烷过程的中断,且体系的严格厌氧要求和古菌复杂的基因背景为传统产甲烷途径的分子生物学改造带来困难。

图4 生物甲烷产生途径Fig.4 Biomethane metabolic pathways
尽管越来越多的甲烷古菌基因组和转录组测序已逐步完成,对甲烷古菌的遗传特性的认知逐步深入,而应用于古菌的基因改造工程研究仍处于起步阶段[83-84]。以生物甲烷的高效产生为目的,需要扩大功能菌的底物利用范围和胞外电子/还原力转移通量,典型的工作如,在Methanosarcinaacetivorans中异源表达来自Pseudomonasveronii的酯酶,使其能够利用乙酸甲酯或丙酸丙酯等代谢产甲烷[85]。鉴于甲烷菌的复杂遗传背景和人工互营体系的优势,合成生物学改造的方向可以转向与甲烷菌互营的电子供体菌上。以电活性模式菌S.oneidensisMR-1为例,引入葡萄糖、木糖、甘油等代谢途径,拓宽了原本以乳酸等有机酸为主的底物限制,更适应现实环境中的发酵要求[86-87]。另外,优化电子传递过程中的功能蛋白表达量与组成(例如,过表达内膜导电蛋白CymA[88]、血红素合成基因cctA替换电子争夺蛋白基因[89]等)、强化电子载体的合成(异源表达核黄素合成基因簇ribADEHC[90]等)、生物膜电活性改造(生物膜致密程度[91]、亲疏水性[92]等)这些策略能够显著改善细菌-电极的电流功率密度,加强向互营菌的胞外电子传输能力,进而提升互营体系中的种间电子传递性能。筛选高效的基因工程电活性细菌,充当产甲烷菌的“供能伙伴”,进一步合理设计人工互营反应体系是简化传统生物甲烷生产工艺的重要策略之一。
另一项策略是从甲烷代谢的源头出发,寻找新型一步式还原酶“兼容”Wolfe循环中多步反应中的功能酶。固氮酶广泛存在于光合细菌体内,其起源可追溯到32亿年前,远早于有氧光合作用的产生。固氮酶的基本功能是将N2还原为氨,即完成氮固定过程,该多电子还原过程与CO2—CH4的八电子转移高度相似[93]。V型固氮酶已被证实具有显著的CO还原性,能够偶联多个CO分子产生短链烷烯烃如,甲烷、乙烯、乙烷和丙烯等[94]。Fe型固氮酶在不同的固氮细菌中具有天然的CO2甲烷化功能,能够支持与甲烷氧化菌的互营,从而通过碳循环影响微生物群落的相互作用[95]。在更普遍的条件下,光合细菌通过表达MoFe型固氮酶维持自养条件生长,对Azotobactervinelandii中的MoFe固氮酶α链进行双位点突变(V70AH195Q)的突变体,能够在优化条件下催化20 min,每nmol蛋白获得21 nmol的甲烷产量,此外该CO2还原过程与乙烯乙炔等其他底物偶联,可以形成丙烯等高价值化合物[96]。通过精准的基因调控,使固氮酶突变体进行高效的甲烷转化在全细胞体系中得以实现,Fixen等[97]通过在RhodopseudomonaspalustrisCGA009中引入自杀性质粒,获得稳定的重组MoFe固氮酶的基因表型,首次完成了全细胞一步式光催化CO2到CH4转化。后续的工作中,Ma等[98]对同源的RhodopseudomonaspalustrisCGMCC 1.2180进行固氮酶双位点突变改造,经过响应面优化后,每毫克细菌总蛋白的甲烷产率高达每小时14.58 μmol,超越了所有已知的光合细菌(photosynthetic bacterium,PSB)的甲烷产率。依靠蛋白质从头设计、金属辅因子组装和非天然氨基酸替代等先进的分子生物学手段对上述固氮酶系进行高水平表达和高转化率修饰,筛选天然宿主或设计合理的模式生物宿主,能够巧妙地替代传统古菌产甲烷功能,成为未来新型产甲烷生物催化剂的方向。基于基因序列的相似性,某些类似固氮酶的还原酶与硫代谢与转运相关,存在一种全新的蛋氨酸生物合成途径,催化C—S键的断裂同时伴随着厌氧乙烯和甲烷的生成,这类还原酶功能的解析区别于传统的古菌产甲烷途径,拓宽了构建生物甲烷酶催化体系的潜在模板[99]。
4 光电催化多元产甲烷系统的构建
微生物电化学系统(图5)是近年来兴起的用于从废弃有机物中回收能源与营养源的新型体系,CO2和废弃有机物的电化学转化整合了可再生能源开发、温室气体减排和资源利用的优势[100-101]。生物电催化产甲烷的概念在2009年被提出,这种CO2还原体系被称为生物电催化能量-气体转化(BEP2G)[102]。在双室电池中,在适当的电压供应条件下,阳极发生电解水反应,产生质子和氧,阴极上负载有产甲烷菌进行CO2还原产甲烷,从而将电能以甲烷的形式转化储存。实验室规模的电化学系统是研究生物电子传递机制的良好表征载体。一些甲烷古菌与电活性细菌类似,能够直接从碳/石墨电极上摄取电子产甲烷。Mayer等[103]研究了不同纯培养的甲烷菌在电化学系统中产甲烷情况,实验证明5种产甲烷菌在阴极上均能存活并产生甲烷,且电子交换方式倾向于DIET。作为电化学装置的基本参数之一,施加电压的高低将影响产甲烷菌的电子传递方式,Bai等[104]研究M.barkeri在-0.35 V至-1.2 V阴极电压下的甲烷产量和电子传递变化,随着电位降低,甲烷菌的电子摄取方式由直接电子转移转变为间接电子转移,归因于电极上细胞附着的减少和电子载体H2产量的提升。除甲烷外,在生物电催化能量-气体转换装置(BEP2G)中通过调整电催化参数可实现不同甲烷/H2体积比的天然气生产[102]。近十年时间中,将厌氧消化与微生物电化学系统进行耦合形成的混合体系(BEAD)的实际应用潜力被充分挖掘[105-108]。将电化学装置(MEC)与厌氧消化体系进行原位结合,在阳极区域进行有机底物的混菌分解,释放电子、质子与CO2。由于阴极区域H2的产生,氢营养型产甲烷菌(Methanobacterium、Methanocorpusculum、Methanoculleus等)被显著富集,由于这类古菌对低温和高氨条件的高耐受性,且生长速率相对较快,能够强化整个厌氧发酵体系的甲烷回收[107-108]。因此与传统厌氧消化体系相比,BEAD的显著优势在于应对厌氧消化中高有机负载率、底物性质突变引起的挥发性有机酸和pH冲击等不利情况,维持厌氧消化系统的长效稳定运行[105]。

图5 甲烷的生物电催化合成系统Fig.5 Methane-producing bioelectrochemical system
人工光合作用以模拟自然光合作用为基础,将具有高效光能捕获能力的半导体与高催化选择性地生物细胞/酶相结合,完成太阳能-高价值化学品的转换[109]。人工光合作用的目的之一是进行长效稳定的碳固定与转化,如,将CO2还原为乙酸、甲酸、聚羟基丁酸酯(PHB)和甲烷等。Ye等[110]在甲烷八叠球菌M.barkeri的培养体系中添加重金属Cr离子,成功诱导该菌在细胞膜表面自组装合成纳米半导体CdS,将半导体光激发电子经由膜结合的能量传递相关氢化酶(Ech、Vht等)和细胞色素(Hdr等)的胞外电子摄取途径,成功导入产甲烷古菌细胞内促进CO2的甲烷化,如图6(a)所示。在进一步的研究中,Ni掺杂剂作为有效电子阱,进一步加速M.barkeri-CdS杂合体系的光电子转移过程,通过高表达电子转移、能量代谢、CO2固定等蛋白改变细胞代谢状态,使甲烷产率对比先前提升约250%[111]。另外,半导体也可与酶进行组合,CdS纳米棒可以取代MoFe固氮酶中的Fe蛋白,向MoFe蛋白提供电子,实现光驱动体外固氮(N2→NH3)[112],对于固氮酶的改造已实现一步式产甲烷目标,有望通过与光催化半导体的结合构建新型的光驱动全细胞/酶杂合生物甲烷转化体系。与纳米半导体向全细胞提供光激发电子不同,人工光合作用的另一种模式是将来源于光合生物的光系统(PSⅠ或PSⅡ)作为光吸收剂,构建Z-型方式与半导体材料偶联,这类生物光敏剂导带上的电子被转移到非生物催化剂中,完成光驱动分解水产氢等原位催化反应。Chen等[113]将光养古菌Halobacteriumsalinarum紫色膜衍生囊泡包裹在多孔Pd-TiO2纳米光催化剂表面,膜蛋白作为光敏剂,向TiO2导带注入电子,同时充当质子,泵外排质子,通过电子和质子的协同作用,高效还原CO2为甲烷。类似上述研究中,将具有量子限制效应的低尺寸纳米半导体引入细胞中,可实现生物催化的“自光敏化”过程,从可再生能源转化的角度,为生物化学催化提供了全新的思路。
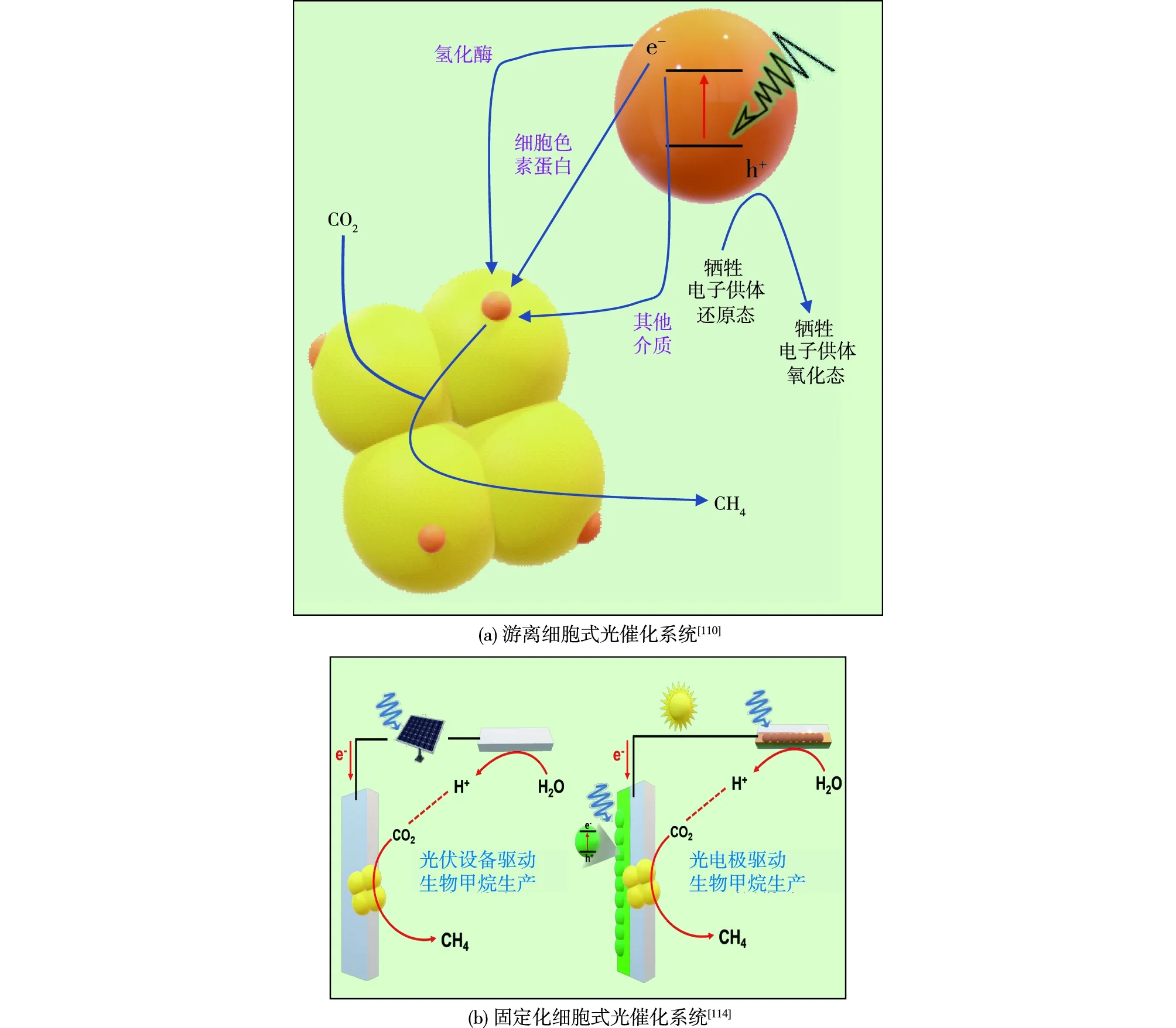
图6 两种不同类型的甲烷光电生物催化合成系统Fig.6 Two types of methane-producing biophotoelectrochemistry
上述将纳米半导体直接与微生物结合的杂合体系在均相培养环境中,以细胞游离的形式,实现光催化固碳过程。此外,将微生物固定于电极表面,同时引入光能的生物光电催化体系,也是目前研究的热点。通过连接光伏设备和电极表面负载光催化材料(制备光电极)两种途径实现光能的引入,从而完成太阳光-电能/化学燃料的转换(图6(b))[114]。在这类生物光电催化系统中,有效的催化区域发生在微生物-电极耦合的界面中,固定化的微生物与电极间的电子交换能力直接决定了CO2转换等氧化还原反应的效能[115]。除了电子的直接传递外,以H2为电子载体介导最为常见。Nichols等[116]将M.barkei整合到了以TiO2作为光阳极、p-InP-Pt作为光阴极的光电催化体系中。通过阳极光解水反应产生H2,传递至阴极区域被产甲烷菌利用驱动CO2还原为甲烷,该系统的法拉第电磁效率(FE)高达74%。H2的低溶解度和高生产电位使其成为光电催化系统中的一个劣势,通过连接具有紫外到近红外吸收的宽光谱利用范围的光伏设备,将光能传输进行“外包”,可以高效驱动水分解产氢,同时使用全氟碳纳米乳液可以有效加速H2传递以被细胞高效吸收。Fu等[117]采用TiO2纳米线阵列作为光阳极,在光照下产生光电子,通过外部电路到达负载有产甲烷菌群的生物阴极,被直接利用完成CO2向CH4转化,这种无需H2参与,进行直接电子传递的新生物光电催化体系的FE突破至96%。
5 结论与展望
传统厌氧消化系统是一个多菌群、多反应、多相的复杂系统,存在产气效率低、甲烷浓度低、过程能耗高等技术瓶颈问题,难以构建有效的调控策略,导致现有沼气工程依靠“政府输血”来维持运行。当前,科研人员一方面通过优化沼气工程的工艺参数来提升产甲烷效率,另一方面尝试对微生物互营代谢机制的解析来构建更为高效的多细胞产甲烷系统。甲烷产量的提高可以归因于互营菌与甲烷古菌间种间电子传递的改善。越来越多的功能菌属被证实参与到厌氧消化的种间电子传递过程中,利用合成生物学手段能够更精准地实现DIET过程的人工干预,如,将多样的固碳途径引入互营菌中,优化互营菌的胞外电子输出途径,为甲烷古菌提供充足的产甲烷前体和能量;另一方面,对甲烷古菌中的传统甲烷代谢过程进行从头设计,在模式微生物中表达具有产甲烷活性的新型还原酶,拓展产甲烷途径及微生物种类。半人工光合作用证实光生电子能够作为生物电子的补充,有效强化CO2甲烷化过程,催生了更为多元化的产甲烷系统。通过引入半导体材料与电极装置对微生物全细胞进行半机械化改造,能够利用可再生清洁能源高效特异性地驱动生物氧化还原反应的进行,但同时也显著改变了微生物的代谢状态,关键问题在于进一步改善催化材料的生物相容性,进一步解析材料-微生物交互界面的电子传导机制,亟待更为先进的分析手段来数据化与可视化监测产甲烷系统中的电子交换,推动细胞-细胞、细胞-半导体/电极之间信号响应机制的研究进程。最后,通过 1)解析种间电子传递机制,理解菌群间电子转移背后的信息和能量交换;2)改造已知产甲烷途径,挖掘新型产甲烷底盘微生物;3)合理组合高效产甲烷基因工程菌株和先进的光电催化材料,指导沼气工程的升级改造。在可预见的未来,通过对多元生物产甲烷体系的构建、调控、重构和强化,将推动废弃碳资源的利用及生物甲烷产业的快速发展,助力我国碳中和目标的实现。

