解脂耶氏酵母异源合成类胡萝卜素的研究进展
买 洁,余 霄,李文娟,聂志奎,纪晓俊
(1.南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 211800;2.江西新瑞丰生化股份有限公司,江西 新干 331300)
类胡萝卜素是一大类含有40个C原子的四萜类化合物,在自然界植物、真菌、藻类等中广泛存在。常见的有番茄红素、β-胡萝卜素、虾青素等。类胡萝卜素化学结构独特、抗氧化作用强,被广泛地应用于食品、医药和饲料等领域[1]。例如,番茄红素作为最常见的类胡萝卜素之一,因最早从番茄中发现而得名,具有延缓衰老、预防心血管疾病等功效,可被用于食品添加剂及保健品等。此外番茄红素还具有抗癌活性,可以预防前列腺癌及胃肠道癌等[2-3]。β-胡萝卜素是维生素A合成的前体,具有抗氧化、抗癌活性,也是食品添加剂、化妆品等的重要成分[4]。虾青素,一种红色的酮类类胡萝卜素,主要用作水产养殖的饲料及食品添加剂。淡水绿藻雨生红球藻(Haematococcuspluvialis)可以积累自身干重1.5%~3.0%的虾青素,是天然虾青素生产提取的重要来源[5]。因类胡萝卜素在食品、医药等领域的广泛应用,其市场价值在2017年已达到15亿美元,据预测2022年类胡萝卜素的市场需求有望增至20亿美元[6]。但是,植物提取和化学合成的方法产量过低、提取分离工艺复杂,难以满足当前市场需求,利用微生物合成类胡萝卜素逐渐成为一种有前景的生产方式。
类胡萝卜素已在许多非类胡萝卜素生产菌株如酿酒酵母和解脂耶氏酵母等微生物中实现了异源表达[7-10]。解脂耶氏酵母(Yarrowialipolytica)是一种非常规产油酵母,可以积累达到自身干重80%以上的油脂,是美国食品药品监督管理局(FDA)认证的安全微生物(GRAS),可以用于食品医药等行业的生产[11-13]。由于其安全高效、底物利用范围广等优势,解脂耶氏酵母近年来备受关注,已经被开发生产萜类[14-15]、功能性脂肪酸[16]、聚酮类[17]化合物等化学品。相比酿酒酵母的低脂质合成水平,解脂耶氏酵母具有丰富的乙酰CoA含量,自身脂质的积累有利于疏水性的类胡萝卜素的储存,解脂耶氏酵母是类胡萝卜素异源生成的理想的细胞工厂[18-20]。在番茄红素、β-胡萝卜素、虾青素等主要类胡萝卜素的合成能力方面,解脂耶氏酵母要显著优于酿酒酵母(表1)。本文综述了利用合成生物学策略促进解脂耶氏酵母合成类胡萝卜素的研究进展,并对合成策略进行总结分类,以便更好地厘清类胡萝卜素异源合成研究中的焦点问题及未来的研究方向。
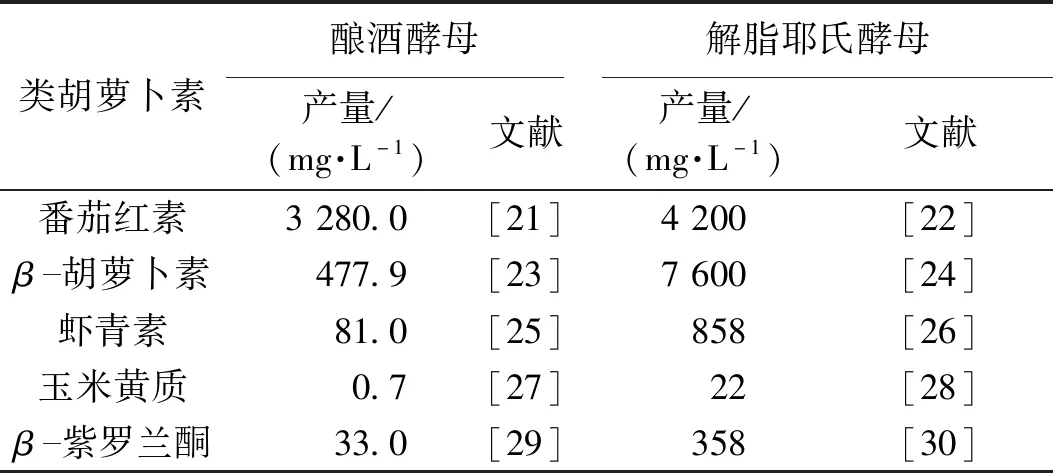
表1 酿酒酵母和解脂耶氏酵母中类胡萝卜素的合成Table 1 Biosynthesis of Carotenoids in Saccharomyces cerevisiae and Yarrowia lipolytica
1 类胡萝卜素生物合成途径
在解脂耶氏酵母中构建的类胡萝卜素的合成途径可以分为两部分,上游甲羟戊酸(MVA)途径合成前体香叶基香叶基焦磷酸(GGPP),以及下游不同类胡萝卜素的合成(图1)。MVA途径是存在于解脂耶氏酵母的内源途径,以乙酰CoA为底物,通过多步酶促反应,可以合成萜类的前体异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP),IPP和DMAPP可以作为C5单元继续合成萜类的直接前体香叶基焦磷酸(GPP)、法尼基焦磷酸(FPP)和GGPP,其中GGPP是类胡萝卜素合成共同的前体骨架[31]。该上游途径生成的前体GGPP对类胡萝卜素的产量具有重要影响,因此,对上游MVA途径进行调控以提高GGPP的合成,为下游类胡萝卜素的合成提供充足的前体具有重要作用。

Erg10—乙酰CoA硫解酶;Erg13—羟甲基戊二酸单酰CoA合成酶;HmgR—羟甲基戊二酸单酰CoA还原酶;Erg12—甲羟戊酸激酶;Erg8—甲羟戊酸磷酸激酶;Erg19—甲羟戊酸磷酸脱羧酶;Idi—异戊烯焦磷酸异构酶;Erg20—法尼基焦磷酸合成酶;Ggpps—香叶基香叶基焦磷酸合成酶;Erg9—角鲨烯合酶;CrtE—GGPP合酶;CrtB —八氢番茄红素合酶;CrtI/CarB—八氢番茄红素脱氢酶;Ccd1—类胡萝卜素裂解双加氧酶;CrtW—β-胡萝卜素酮化酶;CrtZ—β-胡萝卜素羟化酶;CarRP/CarRA/CrtYB—八氢番茄红素合酶/番茄红素环化酶图1 类胡萝卜素生物合成途径Fig.1 The biosynthetic pathways of carotenoids
下游不同类胡萝卜素的合成中,当前主要报道的有番茄红素、β-胡萝卜素和虾青素等。番茄红素是GGPP到类胡萝卜素中合成途径的第一个产物,通常通过异源表达GGPP合酶CrtE、八氢番茄红素合酶CrtB、八氢番茄红素脱氢酶CrtI[32]。CrtB催化前体GGPP缩合生成八氢番茄红素,再由CrtI催化连续的去饱和反应生成番茄红素。CrtI催化的番茄红素合成是该途径的限速步骤。番茄红素是β-胡萝卜素合成的前体,但在β-胡萝卜素的途径构建中CrtE、CrtB和CrtI并不是合成番茄红素的唯一选择,具有八氢番茄红素合酶/番茄红素环化酶的双功能酶(如,CarRP、CrtYB、CarRA)经常被用于β-胡萝卜素合成途径的构建。此外,Gao等[33]报道在解脂耶氏酵母中表达了一个新型CARS基因,该基因编码具有八氢番茄红素合酶、八氢番茄红素脱氢酶和番茄红素β-环化酶活性的多功能胡萝卜素合酶,成功检测到β-胡萝卜素的产生。以β-胡萝卜素为前体,可以分别生成虾青素和β-紫罗兰酮等多种类胡萝卜素[34]。β-酮化酶(CrtW)和β-羟化酶(CrtZ)催化β-胡萝卜素生成虾青素,虾青素的合成途径中存在多种中间类胡萝卜素产物,包括海胆酮、角黄素、玉米黄质等,根据两种酶不同的组合选择,虾青素的合成路径不同(图1)。
2 解脂耶氏酵母异源合成各种类胡萝卜素的研究进展
2.1 番茄红素
番茄红素是类胡萝卜素生物合成代谢途径中的第一个产物,通过在解脂耶氏酵母中异源表达CrtE、CrtB和CrtI,构建番茄红素的合成途径。由于明显的产物颜色和清晰的合成途径,番茄红素经常作为模式产物用于解脂耶氏酵母基因工程方法的验证和合成生物学工具的开发[35-36]。如IUP(异戊二烯醇利用)途径,是一种可以通过外源添加异戊烯醇经过两步磷酸化生成前体IPP和DMAPP的人工合成途径,曾被报道在大肠杆菌中构建,用于提高萜烯化合物前体的供应[37]。Luo等[22]首次在解脂耶氏酵母中导入了类似的IUP途径,以番茄红素为目标产物验证途径构建,通过外源添加异戊二烯醇,解脂耶氏酵母中的番茄红素显著提高。进一步,最终通过过表达异戊烯焦磷酸异构酶(Idi)、法尼基焦磷酸合成酶(Erg20),并增强脂质的合成,发酵得到了4.2 g/L的番茄红素。由于解脂耶氏酵母中非同源末端重组(NHEJ)发生的频率大于同源重组(HR),Bai等[36]在解脂耶氏酵母中过表达了DNA连接酶4dl4、促进蛋白Xrcc4、促进连接蛋白Paxx,并截短尿嘧啶(Ura)启动子增加筛选压力增加拷贝,建立了一种高效的基于NHEJ的迭代基因整合技术,导入番茄红素合成途径验证,番茄红素产量显著提高,番茄红素合成途径基因(CRTE、CRTB、CRTI)在解脂耶氏酵母菌株中呈现多拷贝,以CRTB拷贝数最多(图2)。此外,Schwartz等[35]在解脂耶氏酵母中构建了基于CRISPR/Cas9的HR整合,采用该方法后无筛选标记残留,在MFE1、AXP、XPR2、A08、D17位点高效地发生同源重组,重组效率为49%~69%,实现了番茄红素合成途径的高效导入,表明该方法有效可行。
2.2 β-胡萝卜素
β-胡萝卜素通过催化番茄红素环化生成,该步骤在解脂耶氏酵母中的实现通常通过导入具有八氢番茄红素合酶及番茄红素环化酶的双功能酶实现。Gao等[38]曾报道在解脂耶氏酵母中引入来自卷枝毛霉(Mucorcircinelloides)的双功能酶CarRP和八氢番茄红素脱氢酶CarB,通过“推-拉”策略过表达MVA途径关键基因及多拷贝β-胡萝卜素合成途径基因CARRP和CARB(5个拷贝的CARRP),最终发酵得到了4 g/L 的β-胡萝卜素。Liu等[39]则通过表达来自三孢布拉霉菌(Blakesleatrispora)的CarRA和CarB,以及相同过表达MVA途径基因,得到了1.7 g/L的β-胡萝卜素产量。在优化β-胡萝卜素生产的报道中,Larroude等[40]通过金门克隆(Golden Gate)组装技术介导的启动子改组技术,筛选出了β-胡萝卜素表达盒最优的翻译延伸因子(TEF)启动子,当β-胡萝卜素表达盒CarTEF增加至2个拷贝数,β-胡萝卜素产量达到6.5 g/L。最近,Liu等[24]报道了目前β-胡萝卜素的最高产量7.6 g/L。除传统代谢工程优化外,由于解脂耶氏酵母的二态性,β-胡萝卜素产量增加导致解脂耶氏酵母形态向菌丝体转变,敲除调节形态相关的编码基因CLA4和MHY1,成功将其形态调节至酵母态,β-胡萝卜素的产量相应增加了139%。β-胡萝卜素不仅自身是具有多种功能的类胡萝卜素,还是多种类胡萝卜素合成的前体,在虾青素、β-紫罗兰酮的合成过程中,积累β-胡萝卜素都是重要的一步。
2.3 虾青素
虾青素在解脂耶氏酵母中高产的关键是前体β-胡萝卜素的积累以及β-酮化酶和β-羟化酶的选择。Kildegaard等[34]首次在解脂耶氏酵母中实现了虾青素的生物合成,通过表达β-胡萝卜素合酶CrtYB和CrtI以及增强前体GGPP供应和下调竞争途径,β-胡萝卜素的产量达到了(797.1±57.2) mg/L。随后,通过表达来自副球菌属(Paracoccussp.)的β-胡萝卜素酮化酶PsCrtW和菠萝泛菌(Pantoeaananatis)的β-胡萝卜素羟化酶PaCrtZ以及后续的多拷贝优化组合,得到了54.6 mg/L(3.5 mg/g·DCW)(细胞干重)的虾青素产量。在提高前体β-胡萝卜素的积累方面,Tramontin等[5]在解脂耶氏酵母中比较了不同来源的GGPP合酶,发现来自蓝藻(Synechococcussp.)的GGPP合酶(Ggpps7)显著提高了β-胡萝卜素的产量。在解脂耶氏酵母合成虾青素的过程中,由于中间代谢产物的积累,酶的偏好性造成虾青素合成途径代谢不平衡,β-酮化酶和β-羟化酶的组合筛选优化可以平衡中间代谢物的产生,提高虾青素的产量。最近Ma等[26]报道的虾青素的合成达到了858 mg/L,他们筛选了最优的组合PsCrtW/HpCrtZ(来自雨生红球藻(H.pluvialis)的CrtZ),还将融合的酶定位到不同的亚细胞器中,包括脂滴、内质网和过氧化物酶体,有效减少中间代谢物的积累。Tramontin等[5]筛选比较β-酮化酶和β-羟化酶比率对虾青素合成的影响,发现n(HpBkt)∶n(HpCrtZ)的比率为1∶1时,虾青素产量最高,PsCrtW/PaCrtZ则在摩尔比为1∶3时,虾青素产量最高,符合之前报道的β-羟化酶是虾青素合成途径的限制步骤。最近,Zhu等[41]通过筛选及迭代整合最高表达活性的HpCrtW/HpCrtZ,虾青素产量达到了当前最高的3.3 g/L(41.3 mg/g·DCW)。值得注意的是,目前报道的途径组合均没有完全将中间代谢物转化为虾青素,在解脂耶氏酵母中提高虾青素的合成还需要进一步探索。
2.4 其他
类胡萝卜素结构多样,除微生物中常异源合成的番茄红素、β-胡萝卜素和虾青素外,还有许多其他类胡萝卜素的生物合成有待开展(表2)。其中,β-紫罗兰酮和玉米黄质的合成已有报道。以β-胡萝卜素为前体,Lu等[30]采用模块途径工程的手段在解脂耶氏酵母中优化了β-紫罗兰酮的生物合成。整个合成途径被分为3个模块:乙酰CoA供应、MVA途径以及β-紫罗兰酮合成。通过提高乙酰CoA供应、过表达MVA途径基因以及表达β-胡萝卜素合成途径基因(CARB、CARRP),导入矮牵牛(Petuniahybrida)的类胡萝卜素裂解双加氧酶 (Ccd1),最终β-紫罗兰酮的产量达到了0.98 g/L。玉米黄质是虾青素合成途径的中间代谢产物,最近也被报道在解脂耶氏酵母中实现异源合成。Xie等[28]通过在解脂耶氏酵母中积累β-胡萝卜素,筛选3种不同来源的CrtZ,玉米黄质的产量为(21.98±1.80)mg/L,产量偏低,还有待进一步优化。此外,杜邦公司的专利还报道了多种新的类胡萝卜素的生物合成方法,包括叶黄素、玉米黄质、角黄素、β-隐黄素等[42-43]。
3 解脂耶氏酵母积累类胡萝卜素的合成生物学策略
3.1 增加前体乙酰CoA供应
乙酰CoA是MVA途径的起始化合物,也是解脂耶氏酵母中碳代谢的中心代谢节点。增加酵母体内乙酰CoA的供应,也有利于增强类胡萝卜素的合成。MVA途径的乙酰CoA来源于解脂耶氏酵母胞浆,其主要来源于胞浆柠檬酸的裂解。因此过表达ATP-柠檬酸裂解酶编码基因ACL1/2,可以有效增加乙酰CoA的可用性,Zhang等[45]的工作验证了这一结论。他们还过表达了AMP脱氨酶(Ampd)以抑制异柠檬酸脱氢酶的活性,获得更多可用的柠檬酸,番茄红素的产量成功增加了3倍。但是在β-胡萝卜素的合成中过表达Ampd时,并没有观察到类似的产量提高。此外,Lu等[30]在解脂耶氏酵母中合成β-紫罗兰酮的研究中,构建了一种非氧化糖酵解途径(PK-PTA)增强乙酰CoA供应。该途径由磷酸酮醇化酶(Pk)和磷酸转乙酰基酶(Pta)组成,仅需四步就能从1 mol葡萄糖直接在细胞质中产生3 mol乙酰CoA。他们选取了两种异源Pk和Pta组合研究,以乙酸滴度筛选,最终选取了乙酸滴度最高的来自两歧双歧杆菌(Bifdobacteriumbifdum)的BbPk和来自枯草芽孢杆菌(Bacillussubtilis)的BsPta。在解脂耶氏酵母中整合BbPk-BsPta途径,β-紫罗兰酮的产量提高了32%。
3.2 优化表达途径关键基因
类胡萝卜素在解脂耶氏酵母中的表达策略,可以分为增强上游途径提高前体GGPP的供应,以及拉动下游类胡萝卜素分支途径,提高目标产物的合成。优化途径关键基因,包括上游MVA途径以及下游类胡萝卜素合成途径的关键基因,可以有效地提高相应类胡萝卜素的合成。HMG-CoA还原酶(Hmgr),催化HMG-CoA生成MVA,是MVA途径的限速步骤,过表达截短的Hmgr(tHmgr)能够有效地提高MVA途径的通量,是一种被广泛应用的策略[9,49]。在已报道的解脂耶氏酵母异源合成类胡萝卜素的研究中,Hmgr也被经常过表达以提高前体供应。而除了限速步骤Hmgr外,过表达MVA途径的所有基因也被用来提高类胡萝卜素前体供应,Gao等[38]通过推拉策略合成β-胡萝卜素以及Lu等[30]合成β-紫罗兰酮的工作中,MVA途径相关酶的编码基因的过表达均有效提高了目标产物的产量。此外,增加Hmgr的拷贝数也可以有效地提高类胡萝卜素的合成,这在Gao等[38]和Liu等[39]合成类胡萝卜素的工作中均有报道。Zhang等[48]则在过表达Hmgr的基础上额外过表达了MVA途径的基因ERG13,也成功了β-胡萝卜素的产量。此外,GGPP是合成类胡萝卜素的直接前体,解脂耶氏酵母中GGPP供应不足,因此过表达内源GGS1或者异源GGPP合酶如,CrtE、Ggpps7提高前体GGPP合成,是类胡萝卜素合成中最重要也是最通用的策略[5]。其次,由于下游类胡萝卜素合成途径的基因是异源导入解脂耶氏酵母中的,自身活性限制导致上下游通量不平衡,从而导致类胡萝卜素产量不高。因此,提高下游类胡萝卜素合成途径的拷贝数,可以显著提高类胡萝卜素产量。如,Bai等[36]以番茄红素为目标产物在解脂耶氏酵母体内建立NHEJ基因整合方法,筛选出的高产番茄红素的菌株。类似的,在解脂耶氏酵母异源合成β-胡萝卜素的报道中,β-胡萝卜素的合成途径基因均为多拷贝表达[48]。

表2 多种类胡萝卜素在解脂耶氏酵母中的异源合成Table 2 Heterologous biosynthesis of different carotenoids in Yarrowia lipolytica
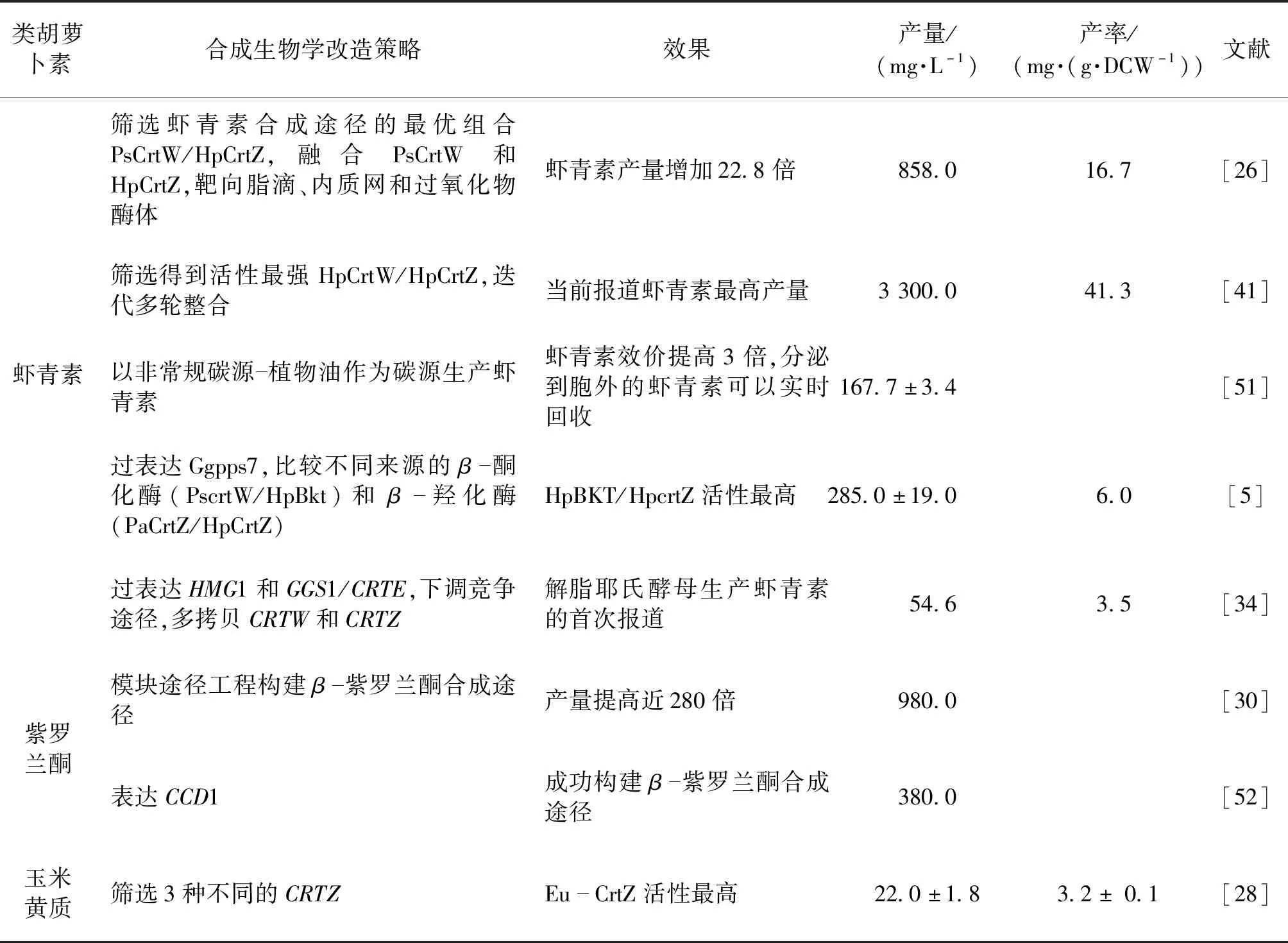
续表
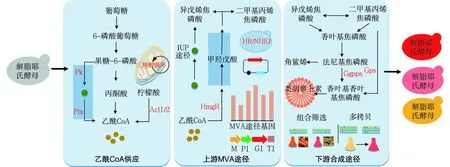
Acl1/2—ATP柠檬酸裂解酶;HmgR—羟甲基戊二酸单酰CoA还原酶;Ggpps—GGPP合成酶;Gps—GGPP合成酶;HR—同源重组;NHEJ—非同源末端重组图2 解脂耶氏酵母中异源合成类胡萝卜素的合成生物学策略Fig.2 Synthetic biology strategies for heterologous biosynthesis of carotenoids in Yarrowia lipolytica
3.3 下调副产物竞争途径
当在解脂耶氏酵母中构建目标类胡萝卜素产物的异源合成途径时,以FPP为前体的角鲨烯及麦角固醇合成途径是四萜类类胡萝卜素合成的竞争途径[34]。因为相比于异源的类胡萝卜素合成基因,内源的角鲨烯合酶Erg9具有较强的催化活性,所以FPP倾向于流向角鲨烯合成途径。但由于角鲨烯是麦角甾醇的前体,麦角甾醇对细胞的流动性具有重要作用,因此,不能通过简单的敲除角鲨烯的合成途径基因来降低其积累,只能通过截短ERG9的启动子或以弱启动子替换ERG9启动子达到下调竞争途径的作用[34,53]。
脂质合成途径由于和萜类合成共同竞争相同前体乙酰CoA,在解脂耶氏酵母的萜类化合物异源合成过程中是另一种竞争途径。另外,由于四萜类胡萝卜素是一种疏水性化合物,在解脂耶氏酵母胞内主要储存在脂滴中,因此脂质合成途径在类胡萝卜素合成的解脂耶氏酵母菌株中经常被上调。Luo等[22]在番茄红素的合成中,尝试过表达Dga1和Acc1提高脂质合成,番茄红素产量提高。由于脂质合成和番茄红素合成共同竞争乙酰CoA前体,可能存在乙酰CoA供应不足的问题,通过外源添加棕榈酸经由β-氧化途径提高乙酰CoA供应,番茄红素的产量提高了1.97倍。Matthäus等[9]通过敲除参与β-氧化的第一步基因POX1-6并敲除编码甘油-3-磷酸脱氢酶的基因GUT2,脂质体的积累增强了4倍,番茄红素的积累也显著增强。
4 结论与展望
解脂耶氏酵母与酿酒酵母相比,优势明显,已成为生产类胡萝卜素的常用底盘微生物之一。类胡萝卜素生产的代谢工程研究重点,主要集中在代谢中心节点乙酰CoA合成的增强、前体MVA途径的优化以及下游异源途径的优化等。利用解脂耶氏酵母合成的类胡萝卜素主要包括番茄红素、β-胡萝卜素和虾青素等。类胡萝卜素结构和种类多样,其他重要应用价值的类胡萝卜素产品,如,玉米黄质、叶黄素等的开发还有待进一步探索。此外,解脂耶氏酵母中生产类胡萝卜素的合成生物学策略有待进一步尝试,如,增加前体乙酰CoA的供应有多种途径可以实现,乙酰CoA穿梭途径中,肉碱乙酰转移酶Cat2也被报道有显著提高乙酰CoA的作用。前体GGPP的供应是类胡萝卜素合成的限制因素之一,未来可进一步挖掘不同来源的GGPP合酶,提高GGPP的供应。此外,对于类胡萝卜素合成途径中关键的活性限制,除提高编码基因的拷贝数外,定点突变和定向进化也可应用于提高相关酶的催化活性。这些策略均有望进一步优化和提高解脂耶氏酵母中类胡萝卜素的异源合成。

