输血前不规则抗体检测对输血安全性的影响分析
陈爱莲 马小宏
根据红细胞表面抗原A和抗原B的有无,人的血型分为A型、B型、O型和AB型,统称为ABO血型系统[1]。针对抗原A和B的抗体也被称为规则抗体,通常产生于生命的早期阶段,也称为天然抗体。在正常条件下人体内不会产生不规则抗体;然而在某些条件下,如输血、孕妇的母婴血型不相容及血液产品的免疫刺激等,可刺激人体产生不规则抗体。不规则抗体检测(irregular antibody detection,IAD)主要用于检测血液中除人类ABO血型系统抗体以外的所有抗体[2]。目前,ABO血型不合引起的快速溶血反应的发生率显著降低[3],而临床输血反应的主要原因是不规则抗体的存在[4]。不规则抗体可能引发新生儿溶血病,造成血型鉴定困难,并导致临床交叉配型结果无法判断[5],同时不规则抗体也与流产和死产有关[6]。因此,筛选不规则抗体是非常重要的。基于此,本研究以本院2019年1月—2020年1月需接受输血的患者4 202例为研究对象,探讨和分析输血前不规则抗体的检测对患者输血安全性的影响。
1 资料与方法
1.1 一般资料
本研究以本院2019年1月—2020年1月需接受输血的患者4 202例为研究对象,其中男2 325例,女1 877例,年龄为3 d~79岁,平均年龄(38.65±9.27)岁。按照计算机随机分配结果,将研究对象中的2 100例作为对照组,2 102例作为试验组。纳入标准:(1)患者具备急性出血、严重失代偿性贫血等明确输血适应证;(2)患者心肺功能正常,一般情况良好;(3)患者临床资料完整;(4)患者或其家属知晓输血后相关并发症,并自愿进行输血者。排除标准:年龄超过80岁的患者。本研究已经获得医院伦理委员会批准与患者或患者家属的知情同意。对照组和试验组年龄、性别、输血次数、妊娠史、输血史比较,差异无统计学意义(P>0.05),具有可比性,见表1。

表1 试验组与对照组的一般资料对比
表1 (续)
1.2 方法
(1)基本信息:在本院电子病历系统中获取患者的基本信息,如年龄、性别、输血史、输血次数、妊娠史、入住科室等。(2)对照组:对其输血前行一般常规输血检测(如ABO血型检测),但不施行IAD。(3)试验组:在常规检测基础上,采用微柱凝胶抗人球蛋白法施行IAD。在凝胶卡上标记Ⅰ、Ⅱ、Ⅲ,并在每个凝胶卡的微孔中加入50 μL浓度为0.8%的相对应不规则抗体筛选/鉴定试剂(Ⅰ、Ⅱ、Ⅲ号筛选红细胞稀释液)和25 μL患者血清,轻轻震荡使其均匀混合。将凝胶卡放置于孵育器中,在37℃条件下孵育15 min,使患者血清中的抗体与红细胞上的抗原充分发生反应,形成抗原抗体结合物。将凝胶卡离心10 min,在离心过程中使致敏红细胞聚集于凝胶中形成独特的凝集模式。将凝胶卡放置于照明良好的观察箱上,肉眼观察凝集反应,判断检测结果。阴性结果为Ⅰ、Ⅱ、Ⅲ号凝胶柱中红细胞全部沉积于胶底。阳性结果为Ⅰ、Ⅱ、Ⅲ号任何一种胶柱中出现红细胞凝集颗粒悬浮于凝胶中。对于阳性患者,进一步采用谱细胞进行抗体特异性鉴定。(4)两组患者输血后均进行必要看护与护理,观察患者输血后不良反应。如发生输血后不良反应(如过敏反应、非溶血性发热反应、溶血反应、休克等),立即采取适当措施。
1.3 统计学方法
采用IBM公司SPSS统计分析软件(22.0版本)进行所有的统计分析。使用()表示连续型正态分布的的计量资料;使用n(%)表示计数资料。计量资料组间比较采用t检验;计数资料组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 不良输血反应
对照组不良输血反应发生率为1.43%(30/2 100),试验组不良输血反应发生率为0.43%(9/2 102)。试验组的不良发生率明显低于对照组,差异有统计学意义(P<0.05),见表2。

表2 对照组与试验组输血不良反应比较
2.2 不规则抗体的筛查情况
试验组中共筛查出不规则抗体26例(26/2 102,1.24%)。如图1(1)所示,在26例含有不规则抗体的患者血清中,Rh血型系统抗体最多见,占比42.31%(11/26)。Rh血型系统中患者不规则抗体产生的频率依次为抗E 7例,抗D 3例,抗C 1例。同时,还检出其他多种血型系统的抗体:MNSs 5例(19.23%),Lewis 3例(11.54%),P 2例(7.69%),Kidd 2例(7.69%),Duffy 2例(7.69%),不明系统(other)1例(3.85%)。如图1(2)所示,在所有检出不规则抗体的患者中,来自内科的标本最多,共有7例(26.92%),此外为外科5例(19.23%),急诊科4例(15.38%)、妇产科4例(15.38%),血液科2例(7.69%),皮肤烧伤科2例(7.69%),肿瘤科2例(7.69%)。
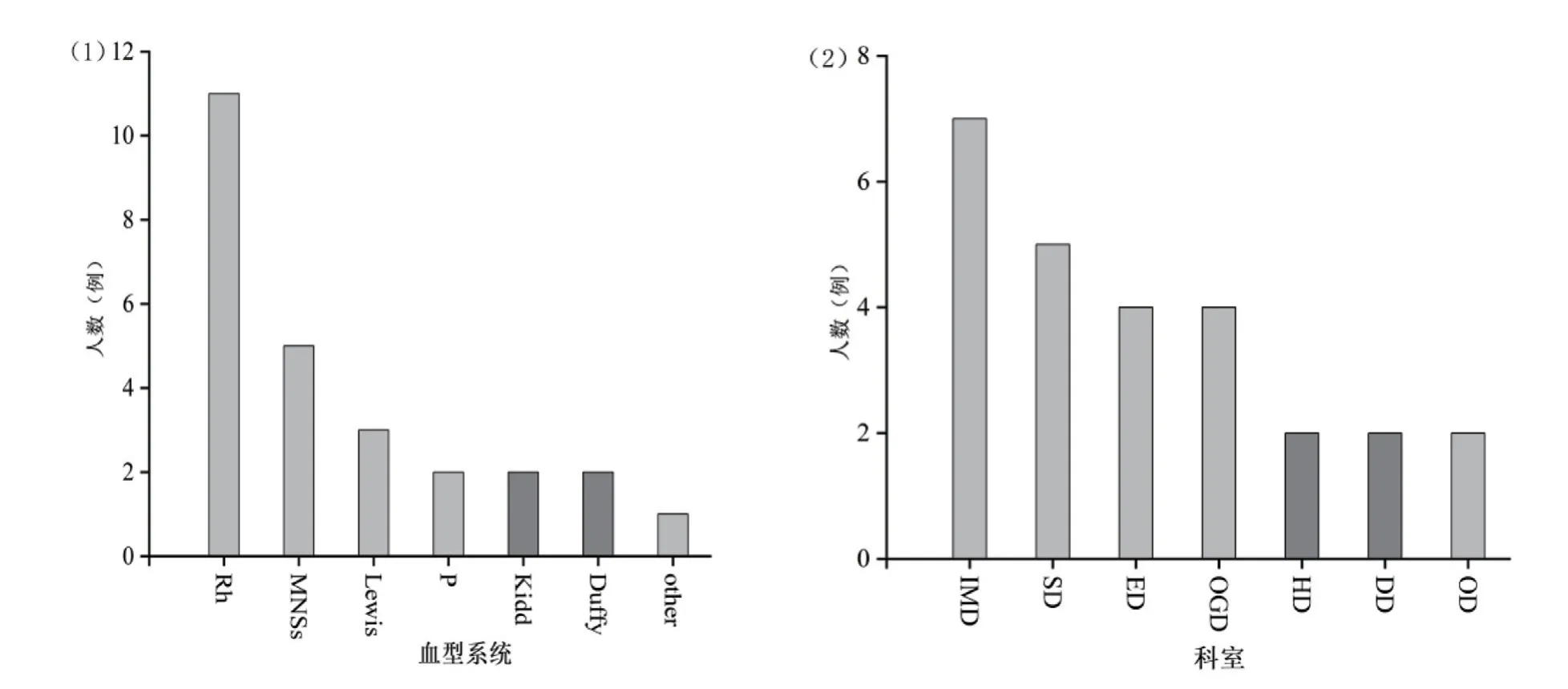
图1 不规则抗体类型系统及标本来源分布
在试验组中,比较检出不规则抗体患者与未检出不规则抗体患者的年龄、性别、妊娠史、输血史,检出组患者输血史、妊娠史的比例高于未检出组,差异有统计学意义(P<0.05),见表3。
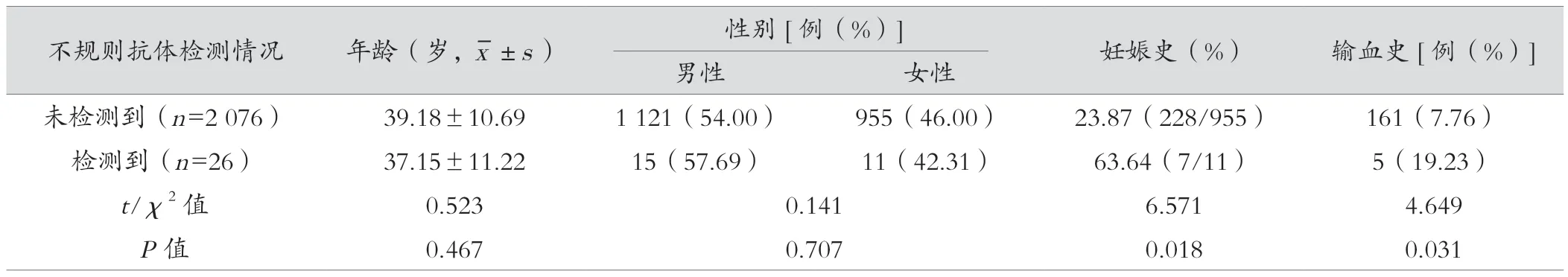
表3 试验组不同不规则抗体检测情况患者的一般资料比较
3 讨论
人体内的红细胞上附着有许多不同的抗原,其中最常见的就是抗原A和B,同时也可能存在其他多种抗原(如Rh血型系统抗原、MNSs/Lewis/P/Kidd/Duffy血型系统抗原等)[7]。不规则抗体就是人体血液中除ABO血型系统抗体以外的所有抗体[8]。不规则的抗体可存在于献血者/输血患者的血清/血浆中,它们具有生物功能,当与人类红细胞抗原接触时可与红细胞发生凝集反应,导致红细胞的破坏和溶血。20世纪90年代后,微柱凝胶技术常被用于筛选和鉴定不规则抗体。这种检测方法不仅操作简便、省时,而且易于标准化和阅读,已成为各国输血科实验室中最常用的技术[9]。
输血在临床上是一种重要的治疗手段,常被用于抢救急性出血患者[10]。此外,输血对慢性贫血、慢性消耗性疾病、严重感染、出血性疾病等有重要的治疗作用。为了提高输血的安全性,在输血前,实验室人员往往会对献血者/受血者进行一系列筛查,包括ABO血型鉴定、不规则抗体筛查、血液传播疾病的筛查等。总体来说,输血相关不良事件的发生率较低,由于献血者/受血者血液中不规则抗体存在而引起的输血反应更为少见[11]。在本次研究中,不规则抗体的检出率为1.24%(26/2 102),然而,当输入大量此类血浆或全血时,可能会引起溶血性输血反应(大量红细胞的加速破坏),严重时甚至可以危及患者生命。因此,对受血者/献血者进行IAD是输血前检测的重要部分。同时,在本次研究中,笔者发现进行IAD的试验组中患者输血后不良事件的发生率显著低于未进行IAD的对照组,说明输血前IAD的实施,可有效降低输血后不良反应的发生率,从而提高临床输血安全[12]。若IAD检测结果为阳性,还应进行特异性抗体的鉴定。
同时,笔者研究表明最常见的不规则抗体是Rh血型系统抗体,其次是MNSs抗体。人类有300多种血型,但只有少数血型会引起临床上显著的输血反应。在临床实践中最重要的两个系统是ABO和Rh系统。有文献[13]报道约有85%的北欧白人为RhD阳性,几乎100%的中国人为RhD阳性。Rh血型是血型系统中最复杂的血型之一,其中D抗原被认为是所有抗原中最具免疫原性的抗原。D抗原只存在于RhD阴性的人中,当RhD阴性患者被输注了RhD阳性的红细胞,或者RhD阴性的妇女怀有RhD阳性的婴儿时,IgG抗D抗体可引起急性或延迟的溶血性输血反应,并可能引起新生儿溶血病[14]。避免RhD阴性的患者/有生育潜力的妇女输入RhD阳性的红细胞输血可有效避免此类现象的发生,因此对有妊娠史或育龄妇女输血前的Rh系统不规则抗体的筛查至关重要。为了检测此类抗体,建议在怀孕早期采集孕妇血样,在怀孕10~16周时可进行ABO和RhD分型,并筛查是否存在其他红细胞不规则抗体。当抗体筛查为阳性时,应进一步进行检测,以确定抗体的特异性和意义。抗D是引起胎儿溶血病的最常见的抗体,如果检测到抗D阳性,常常需要进行适当的产前干预。同时,在本次研究中检出的Rh抗体患者中,抗E最常见,通常不会引起新生儿溶血病或引起轻微的新生儿溶血。笔者研究结果证实在有输血史和妊娠史的患者中更易检出不规则抗体,这与文献报道的输血和怀孕可能会刺激机体产生不规则抗体相符[15]。不规则抗体可在红细胞输注或在怀孕/分娩期间接触胎儿红细胞时的后天刺激下产生不规则抗体,这类抗体通常属于IgG类,如抗D和抗C等,能够穿过胎盘,可能造成胎儿溶血。有研究表明,不规则抗体的大量出现与患者的输血次数有关,在接受输血的病人身上发现不规则抗体的频率较高,最常见的抗体是Rh和Kell系统,输血后Rh抗体与Kell可能在留在体内数月后消失[16]。这些抗体中大多数具有重要意义的是Rh、Kell、Duffy和Kidd,而临床意义不大的是MNSs系统。因此,对于有输血史和妊娠史的患者,输血前有必须要进行IAD,尤其是Rh血型系统抗体的筛查,可能会发现具有临床意义的不规则抗体,避免不良输血反应的发生。
综上所述,IAD是对血液中所有非ABO抗体的检查,这种检测手段表现出重要的临床意义,对于安全输血和减少受血者输血反应至关重要。IAD是对ABO血液鉴定的补充,建议将IAD作为输血前基本检测标准方案中的一部分,特别是针对有输血史和妊娠史的患者。此文的研究结果为临城输血指南后期标准制定提供了借鉴内容。

