卵巢癌术后早期炎性肠梗阻危险因素及预防策略分析
丁珺 程贤鹦 叶惠琴 姚雪萍 周雯 吴青
术后早期炎性肠梗阻(early postoperative inflammatory small bowel obstruction,EPISBO)是腹部手术后肠梗阻的一种特殊类型[1],是腹部手术创伤或腹腔内炎症等原因引起肠壁水肿和渗出,形成的一种机械性与动力性并存的粘连性肠梗阻,若处理不及时或不当,可并发肠瘘、肠坏死、腹腔感染等[2]。妇科恶性肿瘤患者术前身体状况差、手术范围大、术后也容易发生肠梗阻,其中卵巢上皮性癌术后EPISBO发生率高达30.3%[3]。既往研究多为外科腹部手术后的危险因素,卵巢癌作为女性常见恶性肿瘤,具有人群和疾病独特性,且卵巢癌术后多需辅助化疗等,不能尽早预测或识别术后早期炎性肠梗阻,可能导致化疗延迟,进而影响卵巢癌预后。因此有必要对卵巢癌术后EPISBO发生的危险因素进行探究,预测术后EPISBO风险,尽早采取针对性预防措施,从而避免或减少EPISBO造成的风险。本研究对本院卵巢癌患者的相关临床资料进行了回顾性分析,总结卵巢癌术后EPISBO发生的危险因素,以利于预防EPISBO,现报道如下。
1 资料与方法
1.1 临床资料 选取2010年1月至2021年12月期间在浙江省人民医院妇科进行手术治疗的卵巢癌患者的临床资料进行回顾性分析。(1)纳入标准:手术方式为初次全面分期手术或肿瘤细胞减灭术;采用开腹或腹腔镜者;术后均经病理证实为卵巢癌;术中术后未发生需抢救的严重并发症。(2)排除标准:卵巢癌复发行二次以上手术者;机器人辅助手术者;术前采用放疗治疗者;资料不全,影响收集者;其他类型的肠梗阻。EPISBO诊断参照黎介寿院士提出的EPISBO诊断标准[4]。卵巢癌的手术病理分期参考国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)中的标准[5]。本研究经医院医学伦理委员会批准,所有患者签署知情同意书。
1.2 调查方法 参考既往研究中腹部和妇科术后发生EPISBO的危险因素[6],再根据卵巢癌手术特点分析可能存在的影响因素,最终确认收集年龄、腹部手术史、术前腹胀腹痛、术前肠梗阻、术前新辅助化疗、手术途径、手术方式、手术时间、术中出血量、术中输血、术中肠粘连程度、手术涉及肠道、临床-病理分期、术后中度以上贫血、术后低蛋白血症等资料纳入研究,根据患者术后是否发生EPISBO进行分组,对比分析上述指标的组间差异,多因素分析确认卵巢癌术后发生EPISBO的危险因素。
1.3 统计学方法 采用 SPSS 11.0 统计软件。计量资料符合正态分布以()表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验。采用多因素Logistic回归分析EPISBO危险因素,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入384例卵巢癌患者,其中术后发生EPISBO 82例,发生率21.35%,年龄17~84(57.13±14.86)岁,发生时间术后2~14(7.86±6.75)d。主要临床表现为恶心、呕吐26例,腹胀46例,腹痛10例(持续性腹痛4例,阵发性腹痛6例),76例术后第3~7天出现过排气或排便,少量进食后梗阻表现。异常体征主要为腹部轻压痛,无反跳痛,肠鸣音减弱或消失。辅助检查常提示病变区肠壁水肿增厚、粘连、肠管扩张、肠腔积液积气等。81例经保守治疗后痊愈,1例因发生肠瘘经手术治疗后康复。
2.2 不同临床特征的卵巢癌患者术后EPISBO构成比比较 患者年龄、术前肠梗阻、手术途径、手术方式、手术时间、术中输血、术中肠粘连程度、手术涉及肠道、临床-病理分期、术后低蛋白血症之间构成比在是否发生EPISBO两组患者之间比较,差异均有统计学意义(P<0.05)。见表 1。

表1 不同临床特征的卵巢癌患者术后EPISBO构成比较[n(%)]
2.3 卵巢癌患者术后发生EPISBO的多因素Logistic回归分析 以卵巢癌术后是否发生EPISBO为因变量(赋值:是=1,否=0),将单因素分析中的年龄(赋值:≤60岁=0,>60岁=1)、术前肠梗阻(赋值:是=0,否=1)、手术途径〔赋值:开腹=0,腹腔镜=1〕、手术方式(赋值:全面分期手术=0,肿瘤细胞减灭术=1)、手术时间(赋值:≤ 350(min)=0,>350(min)=1)、术中输血(赋值:是=0,否=1)、术中肠粘连程度(赋值:一般或无=0,严重=1)、手术涉及肠道(赋值:是=0,否=1)、术后临床-病理分期(赋值:Ⅰ期或II期=0,Ⅲ期或Ⅳ期=1)、术后中度以上贫血及术后低蛋白血症(赋值:是=0,否=1)作为自变量建立多因素Logistic回归分析,结果显示:手术方式、手术时间、手术涉及肠道、临床-病理分期、术后低蛋白血症均是卵巢癌患者术后发生EPISBO的独立危险因素,术中输血则是保护因素(P<0.05),见表 2。
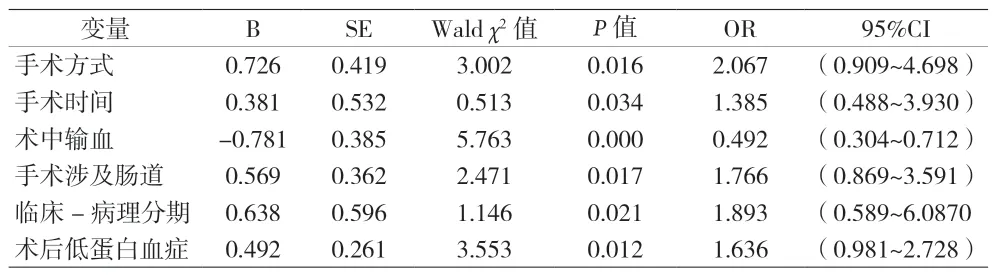
表2 卵巢癌患者术后发生EPISBO的多因素Logistic回归分析
3 讨论
EPISBO被认为是一种机械性与动力性同时存在的粘连性肠梗阻,发生机制可能与创面广泛,手术时肠管暴露时间长,术后腹腔积血积液、坏死组织和异物等刺激引起的肠壁炎症,肠壁长时间浸泡在血液、炎性渗出液、漏出液导致的肠管炎症水肿,肠袢间相互粘连,肠麻痹等因素密切相关[4]。卵巢癌常起病隐匿以致确诊时处于晚期,病变常广泛累及腹腔,其治疗以手术为主[7-10]。研究发现,卵巢癌术后EPISBO发生率高达30.3%,其中无肠切除的发生率为25.9%,伴有肠切除的发生率为38.5%[3]。本研究中卵巢癌患者术后发生EPISBO 84例,发生率21.35%,低于上述文献报道,但均高于腹部手术后0.69%~1.40%的发病率及良性病变的子宫切除术0.59%的发生率[7]。卵巢癌术后EPISBO导致恢复时间延长,治疗费用增加,甚至导致化疗延迟影响治疗结局,因此,分析EPISBO发生的危险因素,采取针对性干预措施来降低EPISBO具有重要临床意义。
本研究根据EPISBO的发病机制及其他腹部手术后发生EPISBO的危险因素[11-12],统计分析与卵巢癌术后EPISBO的相关因素,结果显示,手术方式、手术时间、临床-病理分期、术后低蛋白血症是卵巢癌术后发生EPISBO独立高危因素,即临床-病理分期为III-IV期、手术时间超过350 min行肿瘤细胞减灭术的晚期卵巢癌患者术后容易发生EPISBO,发生EPISBO的危险性分别是Ⅰ期或II期、手术时间≤350 min及全面分期手术的1.89倍、1.38倍和2.06倍。
分析卵巢癌术后EPISBO原因可能是III-IV期患者病变累及较大的范围,手术切除组织多,出血渗血多,创面大,手术操作时间长,肠管暴露时间较长。此外,肿瘤细胞减灭术也无法彻底消灭肿瘤细胞,残留的肿瘤细胞会继续增长而加重消耗体内营养,致使患者多种机能无法得到快速恢复,从而增加EPISBO风险。再者,术后常合并低蛋白血症,盆腹腔内渗血渗液增多,加重肠壁水肿和渗出,影响肠道功能恢复,也使其成为EPISBO发生的高危因素,其风险是无低蛋白血症患者的1.63倍。手术涉及肠管也是患者发生EPISBO高危因素,与BAKKUM-GAMEZ等[3]报道的结果相一致。一方面累及肠道的手术对肠功能的影响较大,术后肠道炎症渗出、水肿、肠管间粘连、蠕动减弱;另一方面需切除肠管的患者本身病变较严重,基础状态较差。本研究结果表明,术中输血是发生EPISBO的保护因素,可能与纠正贫血和低蛋白血症,提高红细胞携氧能力,改善凝血功能,有利于减轻组织水肿和渗液有关。
基于上述危险因素,为更好预防术后发生EPISBO,手术医师应提升技能,熟知盆腔内解剖结构,止血彻底,减少术中术后出血,准确评估出血情况,及时补充红细胞和血浆,避免肠管长时间外露,及时清除或引流腹腔积血、脓液,从而减少异物、细胞因子、炎性介质等[1-2]。对于晚期卵巢癌患者,术前、术后除加强营养支持,纠正水电解质酸碱失衡,应积极纠正低蛋白症,有利于肠壁水肿的消除,加快肠壁的血液循环,减轻炎症,从而预防EPISBO[13]。另有研究表明,通过咀嚼口香糖的假饲效应或饮用咖啡促进胃肠道蠕动,可缩短肠蠕动恢复时间,提高食物耐受能力,有助于降低术后肠梗阻发生率[14-15]。
本研究存在一定局限性,系回顾性、单中心研究,存在选择偏倚、样本量受限等问题;患者术前身体状态的评估也很难一致化,有待高质量前瞻性临床试验,寻找影响术后EPISBO的因素及有效干预措施。
综上所述,卵巢癌患者术后EPISBO发生率较高,手术时间超过350 min、涉及肠道的肿瘤细胞减灭术、术后低蛋白血症的卵巢癌III-IV期患者术后容易发生EPISBO,术中及时输血则可减少EPISBO发生,针对上述因素进行适当的干预可能有助于预防EPISBO的发生。

