富含半胱氨酸蛋白61对子宫内膜癌细胞增殖及细胞周期的影响及其机制研究*
李大众,黄敏敏,刘慧玲
(连云港市第二人民医院 妇科,江苏 连云港 222006)
子宫内膜癌(endometrial carcinoma, EC)是女性生殖道高发恶性肿瘤之一,占全部恶性肿瘤的7%左右,且发病率呈上升趋势[1]。目前EC 以手术治疗为主,辅助内分泌治疗、放化疗,远期预后较好,但仍是导致女性死亡的主要疾病之一,亟待更为有效的干预方式。近年来,国内外学者对EC发病机制进行了深入研究,旨在寻找其特异基因,为EC 的基因治疗提供靶点[2-3]。富含半胱氨酸蛋白61(cysteine-rich 61, CYR61)是 CNN 家族重要成员,促有丝分裂活性、趋化性作用显著,在肿瘤中表现为多样化的生物学功能。CHEN 等[4]研究发现,CYR61 在黑色素瘤中异常高表达,且上调CYR61将进一步促进肿瘤转移。然而,目前关于CYR61在EC 中的表达水平及作用尚不明确。本研究通过体外实验,观察CYR61 对EC 细胞株HEC-1B 增殖及细胞周期的影响,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞系 人正常子宫内膜腺上皮细胞由上海博湖生物科技有限公司提供并进行质量控制,EC 细胞株HEC-1B 购自上海酶研生物科技有限公司。
1.1.2 主要试剂 CYR61 过表达质粒pcDNA3.1 CYR61 及阴性对照质粒pcDNA3.1-NC(上海海吉浩格生物科技有限公司),β-catenin 通路激活剂LiCl(上海莼试生物技术有限公司),MTT Assay 试剂盒(美国Abcam 公司),兔抗人CYR61、β-catenin、Caspase-3、Cyclin D1 一抗(美国R&D 公司)。
1.1.3 主要仪器 DYCZ-24 电泳仪(北京六一生物科技有限公司),GelDoc XR+全自动凝胶成像系统(美国Bio-Rad 公司),Stat Fax-4200 酶标仪(美国Awareness 公司),EPICS XL 流式细胞仪(美国Beckman Coulter 公司)。
1.2 方法
1.2.1 细胞培养 将人正常子宫内膜腺上皮细胞、HEC-1B 细胞株培养于F12/DMEM 培养基中,含10%胎牛血清,链霉素0.1 g/L,青霉素105IU/L,置于标准环境(5% CO2、37℃、饱和湿度)中培养[5]。细胞贴壁约80%时,经0.25%胰蛋白酶(含0.01% EDTA)消化、传代,取对数生长期细胞用于后续实验。
1.2.2 细胞分组及干预 取对数生长期HEC-1B 细胞,按1×105个/mL 的密度接种至6孔板,每孔2 mL,培养过夜。将细胞随机分为Control 组、pcDNA3.1-NC 组、pcDNA3.1 CYR61 组、pcDNA3.1 CYR61+LiCl组。 Control 组不处理, pcDNA3.1-NC 组依据LipofectamineTM3000 脂质体转染说明书转染阴性对照 质 粒 pcDNA3.1-NC,pcDNA3.1 CYR61 组 转 染CYR61 过 表 达 质 粒 pcDNA3.1 CYR61,pcDNA3.1 CYR61+LiCl 组转染 pcDNA3.1 CYR61,并加入 LiCl 使其终浓度为60 mmol/L[7-8]。每组设置5 个复孔。培养48 h 用于后续实验。
1.2.3 Western blotting 检 测 CYR61、β -catenin、Caspase-3、Cyclin D1 蛋白的表达 取对数生长期人正常子宫内膜腺上皮细胞、HEC-1B 细胞株,加入预冷RIPA 细胞裂解液,转移至离心管,10 000 r/min离心15 min,BCA 法测定蛋白含量。取50 μg 待测蛋白,与上样缓冲液充分混合,金属浴煮沸5 min,离心取上清液,上样电泳后湿转至膜,封闭液室温摇床封闭2 h,TBST 清洗,加入兔抗人CYR61 一抗(1∶800),4℃摇床孵育过夜,TBST 清洗,加入山羊抗兔 I gG 二抗(1∶2 000),室温孵育 2 h,TBST 清洗[6]。加入ECL 发光液显色,暗室曝光,经全自动凝胶成像系统分析,以目的蛋白/内参GAPDH 灰度值表示蛋白相对表达量。
1.2.4 MTT法检测细胞增殖抑制率 取各组细胞,PBS 充分洗涤后用0.25%胰蛋白酶消化,重悬后调整密度至1×105/mL,接种至96 孔板,24 h、48 h、72 h后每孔加入20 μL MTT 溶液(5 mg/mL),2 h 后弃上清液,每孔加入150 μL DMSO 溶液,振荡10 min 至甲瓒结晶完全溶解,采用酶标仪检测各组490 nm波长处吸光度(Absorbance, A)值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-干预组A 值/Control组 A 值)×100%[9]。
1.2.5 PI 染色法检测细胞周期占比 取各组细胞,细胞生长至铺满底部>80%时用0.25%胰蛋白酶消化,轻吹细胞,移至15 mL离心管,4℃、3 500 r/min离心5 min;PBS 冲洗,继续离心 5 min;PBS 100 μL 重悬,加入70%预冷乙醇1 mL,混合均匀;4℃固定12 h,离心后 P BS 冲洗;加入染液(PI 染液 2 5 μL,RNaseA 10 μL,染色缓冲液 0 .5 mL),避光冰浴30 min;采用300 目细胞滤网过滤,在60 min 之内采用流式细胞仪检测细胞周期。所有操作重复3 次,取平均值[10]。
1.3 统计学方法
数据分析采用SPSS 26.0 统计软件。计量资料以均数±标准差()表示,比较用t检验或单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P<0.05 差异有统计学意义。
2 结果
2.1 人正常子宫内膜腺上皮细胞、HEC-1B 细胞CYR61蛋白相对表达量比较
人正常子宫内膜腺上皮细胞、HEC-1B 细胞CYR61 蛋白相对表达量分别为(1.25±0.27)和(0.41±0.06),经t检验,差异有统计学意义(t=6.971,P=0.000),与人正常子宫内膜腺上皮细胞比较,HEC-1B细胞CYR61蛋白相对表达量降低。见图1。
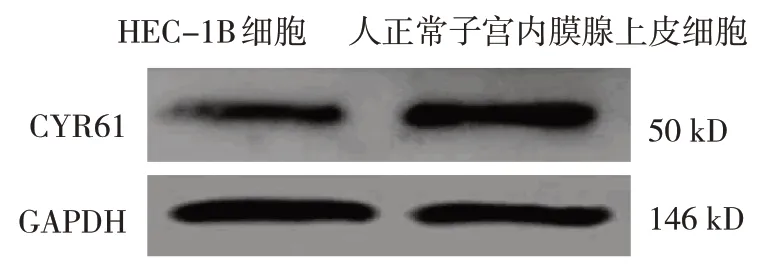
图1 两种细胞CYR61蛋白的表达
2.2 各组细胞CYR61蛋白相对表达量比较
转 染 48 h 后 ,Control 组 、pcDNA3.1-NC 组 、pcDNA3.1 CYR61组、pcDNA3.1 CYR61+LiCl组CYR61蛋白相对表达量分别为(0.40±0.06)、(0.39±0.05)、(1.01±0.14)、(0.57±0.07),经方差分析,差异有统计学意义(F=55.093,P=0.000)。进一步两两比较结果:与 Control 组、pcDNA3.1-NC 组比较,pcDNA3.1 CYR61 组CYR61 蛋白相对表达量升高(P<0.05);与pcDNA3.1 CYR61 组比较,pcDNA3.1 CYR61+ LiCl 组CYR61 蛋白相对表达量降低(P<0.05);Control 组与pcDNA3.1-NC 组CYR61 蛋白相对表达量比较,差异无统计学意义(P>0.05)。见图2。
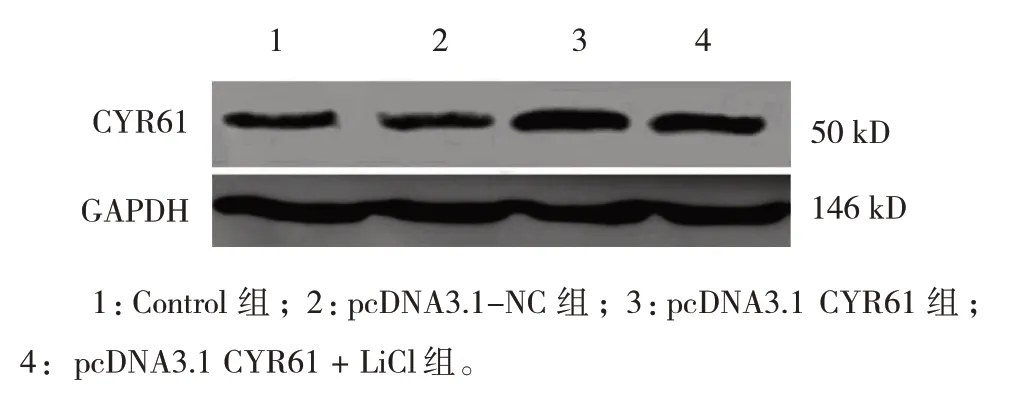
图2 各组细胞CYR61蛋白的表达
2.3 各组细胞增殖抑制率比较
pcDNA3.1-NC组、pcDNA3.1 CYR61组、pcDNA3.1 CYR61+ LiCl 组 24 h、48 h、72 h 增殖抑制率比较,采用重复测量设计的方差分析,结果:①不同时间点增殖抑制率有差异(F=25.416,P=0.000);②3 组增殖抑制率有差异(F=46.962,P=0.000),pcDNA3.1 CYR61 组增殖抑制率较高,增殖抑制效果好;③3 组增殖抑制率变化趋势有差异(F=37.541,P=0.000)。见表1。
表1 各组增殖抑制率比较 (%,)
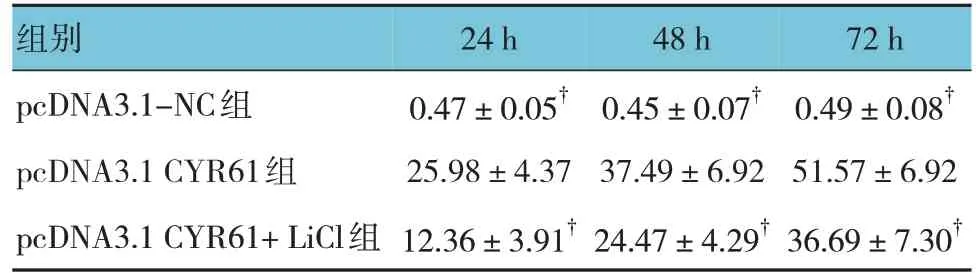
表1 各组增殖抑制率比较 (%,)
注 :† 与pcDNA3.1 CYR61组比较,P <0.05。
组别pcDNA3.1-NC组pcDNA3.1 CYR61组pcDNA3.1 CYR61+LiCl组72 h 0.49±0.08†51.57±6.92 36.69±7.30†24 h 0.47±0.05†25.98±4.37 12.36±3.91†48 h 0.45±0.07†37.49±6.92 24.47±4.29†
2.4 各组细胞周期占比比较
Control 组、pcDNA3.1-NC 组、pcDNA3.1 CYR61组、pcDNA3.1 CYR61 + LiCl 组 G0/G1、S、G2/M 期占比比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:与Control 组、pcDNA3.1-NC 组 比 较 , pcDNA3.1 CYR61 组 G0/G1期占比升高(P<0.05),S、G2/M 期占比降低 (P<0.05); 与 pcDNA3.1 CYR61 组 比 较 , pcDNA3.1 CYR61 + LiCl 组 G0/G1期占比降低 (P<0.05),S、G2/M 期 占 比 升 高 (P<0.05); Control 组 与pcDNA3.1-NC 组 G0/G1、S、G2/M 期占比比较,差异无统计学意义(P>0.05)。见表2。
表2 各组细胞周期占比比较 (%,)
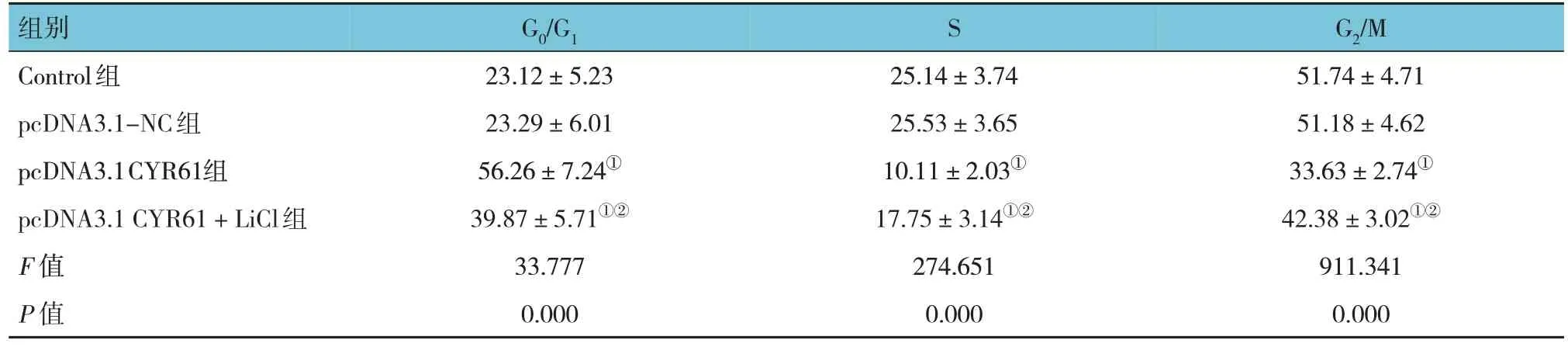
表2 各组细胞周期占比比较 (%,)
注 :①与Control组、pcDNA3.1-NC组比较,P <0.05;②与pcDNA3.1 CYR61组比较,P <0.05。
组别Control组pcDNA3.1-NC组pcDNA3.1CYR61组pcDNA3.1 CYR61+LiCl组F 值P 值G2/M 51.74±4.71 51.18±4.62 33.63±2.74①42.38±3.02①②911.341 0.000 G0/G1 23.12±5.23 23.29±6.01 56.26±7.24①39.87±5.71①②33.777 0.000 S 25.14±3.74 25.53±3.65 10.11±2.03①17.75±3.14①②274.651 0.000
2.5 各组细胞β-catenin、Caspase-3、Cyclin D1蛋白相对表达量比较
Control 组、pcDNA3.1-NC 组、pcDNA3.1 CYR61组、pcDNA3.1 CYR61 + LiCl 组 β-catenin、Caspase-3、Cyclin D1 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:与Control 组、pcDNA3.1-NC 组比较,pcDNA3.1 CYR61 组 β-catenin、Caspase-3、Cyclin D1 蛋白相对表达量降低(P<0.05);与pcDNA3.1 CYR61 组比较,pcDNA3.1 CYR61 + LiCl 组 β -catenin、 Caspase-3、Cyclin D1 蛋白相对表达量升高(P<0.05);Control 组与pcDNA3.1-NC 组β-catenin、Caspase-3、Cyclin D1蛋白相对表达量比较,差异无统计学意义(P>0.05)。见图3 和表 3。
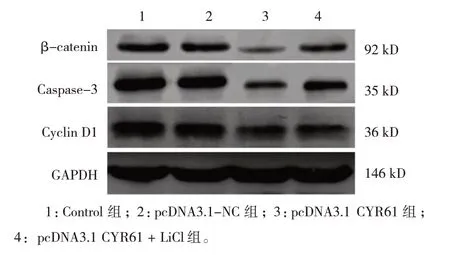
图3 各组细胞β-catenin、Caspase-3、Cyclin D1蛋白的表达
表3 各组细胞β-catenin、Caspase-3、Cyclin D1蛋白相对表达量比较 ()

表3 各组细胞β-catenin、Caspase-3、Cyclin D1蛋白相对表达量比较 ()
注 :①与 Control 组、pcDNA3.1-NC 组比较,P <0.05;②与pcDNA3.1 CYR61组比较,P <0.05。
Cyclin D1 0.96±0.08 0.97±0.09 0.21±0.03①0.32±0.04①②790.105 0.000组别Control组pcDNA3.1-NC组pcDNA3.1 CYR61组pcDNA3.1 CYR61+LiCl组F 值P 值β-catenin 0.27±0.03 0.26±0.04 0.08±0.01①0.15±0.03①②322.667 0.000 Caspase-3 0.98±0.07 0.99±0.08 0.12±0.02①0.51±0.06①②965.142 0.000
3 讨论
EC 是一组起源自子宫内膜的上皮性恶性肿瘤,有研究认为内源性或外源性雌激素异常、糖尿病、肥胖及不良生活习惯均是其发生的危险因素[11]。目前关于EC 发病机制的观点较多,大多认为与基因、信号通路活性异常引发细胞失控性增殖、微卫星多态性增加、p53 突变等有关[12]。因EC 早期症状较为明显,确诊较早,多数患者可采用手术切除治疗,但其创伤较大,且术后面临着较高复发、转移风险。随着基因治疗技术的不断进步,寻找有效的肿瘤标志物并针对性干预为进一步改善EC 预后提供了新的希望[13]。
CYR61是由生长因子诱导的立早基因,同时是关键的细胞基质调控因子,参与组织重塑、切口愈合及炎症反应的发生、发展[14]。此外,CYR61也是肿瘤调控基因,与细胞增殖、侵袭、黏附,以及血管形成密切相关,但在不同肿瘤中的作用存在较大差异,例如在神经胶质瘤、乳腺癌等中发挥促癌作用,但在EC 中起到抑癌作用。有学者在研究CYR61 对EC 的诊断价值时发现[15],其在子宫内膜组织中的表达明显偏低,且在EC 细胞增殖中发挥负调控作用。本研究结果显示,与pcDNA3.1-NC 组比较,pcDNA3.1 CYR61 组增殖抑制率升高,G0/G1期占比升高,S、G2/M 期占比降低,提示上调CYR61 可抑制细胞增殖,并将其阻滞在G0/G1期。
Wnt/β-catenin 信号通路是引发肿瘤的重要通路之一,包含β-catenin、Caspase-3、Cyclin D1 等多个部分,其中β-catenin 是该通路的关键因子,在生物信号自细胞膜转移至胞浆、细胞核的过程中发挥重要作用。当该通路被激活时,酪蛋白酶与糖原合成激酶失活,无法降解β-catenin,使其活化并大量积累于细胞质中,从而激活下游靶基因Caspase-3、Cyclin D1,促进细胞增殖并抑制其凋亡。KASOHA 等[16]研究发现,在EC 中存在雌激素信号传导系统与Wnt/β-catenin 信号通路失调,且两种途径中某些成分之间相互作用,从而表现出疾病特征,提示该通路参与EC 进程。本研究结果中 , pcDNA3.1 CYR61 组 β -catenin、 Caspase-3、Cyclin D1 蛋白相对表达量低于Control 组、pcDNA3.1-NC 组 , pcDNA3.1 CYR61+LiCl 组 上 述 指标高于pcDNA3.1 CYR61 组,且在转染pcDNA3.1 CYR61 的基础上联用Wnt/β-catenin 信号通路的激活剂LiCl 可以减弱细胞增殖的抑制作用、细胞周期的阻滞作用,提示Wnt/β-catenin 信号通路在EC 中被激活,上调CYR61 可能通过抑制该通路,抑制EC 细胞增殖,并阻滞其细胞周期,从而发挥抗癌作用。CYR61基因及Wnt/β-catenin 信号通路可能成为治疗EC 的新靶点。

