LncRNA XIST 在子宫内膜癌组织中的表达及其靶向microRNA-101-3p对癌细胞生物行为学的影响*
邢莹,余姝婷,朱小利
(南通市妇幼保健院 妇产科,江苏 南通 226000)
子宫内膜癌(endometrial carcinoma, EC)是一种发生于子宫内膜上皮的恶性肿瘤,多发于围绝经期与绝经后的女性,致死率仅次于宫颈癌和卵巢癌[1]。长链非编码RNA(lncRNA)属于非编码RNA,其长度>200 个核苷酸,同其他非编码RNA 一样, lncRNA 也不能编码蛋白质[2]。LncRNA 在机体病理、生理过程中扮演着重要角色,有研究[3-4]显示,lncRNA 在肿瘤的发生、发展中也起着重要作用。LncRNA XIST 是染色体Xq13.2 的转录产物,存在于X 染色体中心的无活性区域,与X 染色体的相关基因激活有关[5]。既往研究[6]发现,lncRNA XIST 参与乳腺癌、肝癌、肺癌等多种类型肿瘤的发展。MicroRNA 也属于非编码 RNA 的一种, 其中 microRNA-101-3p(miR-101-3p)属于miR-101 家族成员,在乳腺癌细胞的侵袭、迁移中有重要作用[7]。有研究[8]发现,miR-101-3p 可以靶向调控EZH2 诱导EC 细胞发生自噬。此外,lncRNA XIST 还可以通过调节miR-101-3p 影响乳腺癌和卵巢癌细胞的增殖、迁移[9]。本研究旨在探究lncRNA XIST 在EC 组织中的表达及其靶向miR-101-3p 对癌细胞生物行为学的影响,以期为EC 的治疗靶点提供实验依据,现报道如下。
1 资料与方法
1.1 临床资料
选取 2019 年 7 月—2021 年 7 月南通市妇幼保健院收治的82 例手术切除且经术后病理确诊的子宫内膜癌患者的癌组织与癌旁正常子宫内膜组织标本(与手术切缘的距离>3 cm)。患者术前均未接受过化疗与放疗。本研究经医院医学伦理委员会审批,患者及家属签署知情同意书。
1.2 材料
1.2.1 细胞系 人子宫内膜癌细胞系Ishikawa、HEC-1A、RL-952 与正常人子宫内膜细胞系购自江西南昌综合细胞库。
1.2.2 仪器与试剂 HBS-ScanY 全波长酶标分析仪购自南京德铁实验设备有限公司,BX43 生物学显微镜购自日本奥林巴斯公司,Hifair®ⅢOne Step RT-qPCR SYBR Green Kit(货号:11143ES50)购自上海翌圣生物科技股份有限公司,CCK-8 试剂盒(货号:EM1859)购自武汉菲恩生物科技有限公司,LipofectamineTM3000 转染试剂(货号:L3000015)购自江西赣宣科仪生物有限公司,Renilla-Firefly Luciferase Dual Assay Kit 双荧光素酶试剂盒(货号:HY-K-1013)购自美国MCE 公司,Transwell 小室(货号:3472)购自美国康宁公司。
1.3 方法
1.3.1 子宫内膜癌组织与癌旁组织lncRNA XIST 和miR-101-3p mRNA 相对表达量检测 采用TRIzol法提取子宫内膜癌组织与癌旁组织总RNA。采用一步法试剂盒进行逆转录,并进行qRT-PCR 反应,反应体系:模板RNA+上游引物+下游引物+无菌水+2×Hifair®Ⅲ S G Buffer+ Hifair®U H Ⅲ E nzymes+Hifair®50×High Rox,反应条件:42℃逆转录10 min,95℃预变性5 min,95℃扩增反应10 s,60℃扩增反应30 s,共 4 0 次 循 环 。 L ncRNA XIST 正 向 引 物 : 5'-GTAACATAGACCATGAC-3',反 向 引 物 : 5'-TACCTAGACATTGACAT-3', 引 物 长 度 102 bp;miR-101-3p正向引物:5'-CCGATACATAGGACAA-3',反向引物:5'-TGGACATTTGACCAT-3',引物长度81 bp;以U6作为内参基因,根据 2-ΔΔCt法计算目的基因相对表达量。
1.3.2 细胞系lncRNA XIST 相对表达量检测 常规复苏处理 I shikawa、HEC-1A、RL-952 与正常人子宫内膜细胞后传代培养,采用TRIzol 法提取总RNA。采用一步法试剂盒进行逆转录,并进行qRT-PCR 反应,反应体系:模板RNA+上游引物+下游引物+无菌水+2×Hifair®Ⅲ S G Buffer+ Hifair®U H Ⅲ E nzymes+Hifair®50×High Rox,反应条件:42℃逆转录10 min,95℃预变性5 min,95℃扩增反应10 s,60℃扩增反应30 s,共40 次循环。LncRNA XIST 引物序列正向引物:5'-GTAACATAGACCATGAC-3',反向引物:5'-TACCTAGACATTGACAT-3', 引 物 长 度 1 02 bp,以U6作为内参基因,根据2-ΔΔCt法计算目的基因相对表达量。
1.3.3 细胞培养分组及转染 根据1.3.2 中结果,选取lncRNA XIST mRNA 相对表达量高的人子宫内膜癌细胞系Ishikawa 进行后续实验。待Ishikawa 细胞生长至对数生长期时,接种于6 孔板,接种密度为2×106个/孔。简单随机分为对照组(C 组)、空质粒组(NC 组)、lncRNA XIST 表达抑制组(sh-XIST 组),其中NC 组和sh-XIST 组分别转染空载质粒与plkolncRNA XIST-shRNA,C 组不进行任何处理。转染后细胞放置在二氧化碳培养箱中(37℃、湿度60%、5%CO2)继续培养48 h,于荧光显微镜下观察转染结果,转染率≥80%即视为转染成功。转染率=传染成功细胞总数/细胞总数×100%。
1.3.4 CCK-8 法检测各组Ishikawa 细胞增殖活性 收集1.3.2 中稳定转染的各组细胞接种在96 孔板中,接种密度为1×105个/孔,继续培养,分别在12 h、24 h、48 h 时向各孔滴加 1 0μL CCK-8 溶液,每组设置3 个复孔,放置二氧化碳培养箱中继续培养2 h,采用酶标仪检测各组细胞在450 nm 波长处的光密度(OD)值,根据OD 值绘制细胞活性曲线。
1.3.5 划痕实验检测各组Ishikawa 细胞迁移能力 收集1.3.2 中稳定转染的各组细胞接种于6 孔板中,接种密度为2×105个/孔,继续培养12 h。用10 μL移液枪枪头垂直6 孔板表面做连续直线型划痕,用不含血清的DMEM 培养基洗去因划痕操作而脱落的细胞,每组设置3 个复孔,放回培养箱继续培养24 h。分别记录初始划痕的宽度(T0)和24 h 的划痕宽度(T24),计算划痕愈合率以代表细胞的迁移能力。划痕迁移率=(T0-T24)/T0×100%。
1.3.6 Transwell 小室实验检测各组Ishikawa 细胞侵袭能力 取1.3.2 中稳定转染的各组细胞,弃去培养基换成无血清的DMEM 培养基饥饿培养24 h,再将细胞吹打重悬并计数。取出事先准备好的Transwell小室(已用Matrigel 胶预铺在小室的上室面),在上室中每孔加入200 μL(含有1×105个细胞)的重悬细胞液,培养板中每孔加入600 μL 含10% FBS 的DMEM 培养基,每组设置3 个复孔,在培养箱中培养24 h,用PBS 清洗小室,用棉拭子将上室面未穿膜的细胞除去,用0.1%的结晶紫染色后用PBS 冲洗干净,置于显微镜下观察细胞穿膜情况并计数。
1.3.7 双荧光素酶报告基因验证lncRNA XIST 与miR-101-3p 的靶向性 Target Scan 数据库显示lncRNA XIST 与miR-101-3p 核苷酸存在结合位点,根据 l ncRNA XIST 与 m iR-101-3p-3'-UTR 结合位点的预测结果,用Lipofectamine TM 3000 将野生型miR-101-3p 质 粒 (miR-101-3p-WT)与 突 变 型 miR-101-3p 质粒(miR-101-3p-MT)分别与 l ncRNA XIST-mimics、lncRNA XIST-mimics-NC 共 转 染 于 Ishikawa 细胞,分别为lncRNA XIST-mimics-miR-101-3p-WT 组 、 lncRNA XIST-mimics-miR-101-3p-MT 组 、 lncRNA XIST-mimics-NC-miR-101-3p-WT组 、 lncRNA XIST-mimics-NC-miR-101-3p-MT 组 。 转染后24 h,用PBS 洗涤细胞,并加入250 μL RIPA 裂解液,待充分裂解后采用双荧光素酶检测试剂盒检测荧光强度A 与B,以A/B 来表示荧光素酶的相对活性。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差()表示,多组比较用方差分析,两组比较用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 子宫内膜癌组织和癌旁组织lncRNA XIST 和miR-101-3p mRNA相对表达量的比较
子宫内膜癌组织和癌旁组织lncRNA XIST mRNA 相对表达量分别为(1.87±0.20)和(0.91±0.11),经t检验,差异具有统计学意义(t=2.817,P=0.048),子宫内膜癌组织lncRNA XIST mRNA 相对表达量高于癌旁组织。子宫内膜癌组织和癌旁组织的miR-101-3p mRNA 相对表达量分别为(0.21±0.06)和(0.58±0.19),经t检验,差异有统计学意义(t=3.216,P=0.032),子宫内膜癌组织miR-101-3p mRNA 相对表达量低于癌旁组织。
2.2 不同临床病理特征患者子宫内膜癌组织lncRNA XIST、miR-101-3p mRNA 相对表达量的比较
不同临床病理特征患者子宫内膜癌组织lncRNA XIST、miR-101-3p mRNA 相对表达量的比较见表1、2。不同TNM 分期和淋巴结是否转移患者的lncRNA XIST、miR-101-3p mRNA 相对表达量比较,差异有统计学意义(P<0.05)。
表1 不同临床病理特征患者子宫内膜癌组织lncRNA XIST mRNA相对表达量的比较 ()
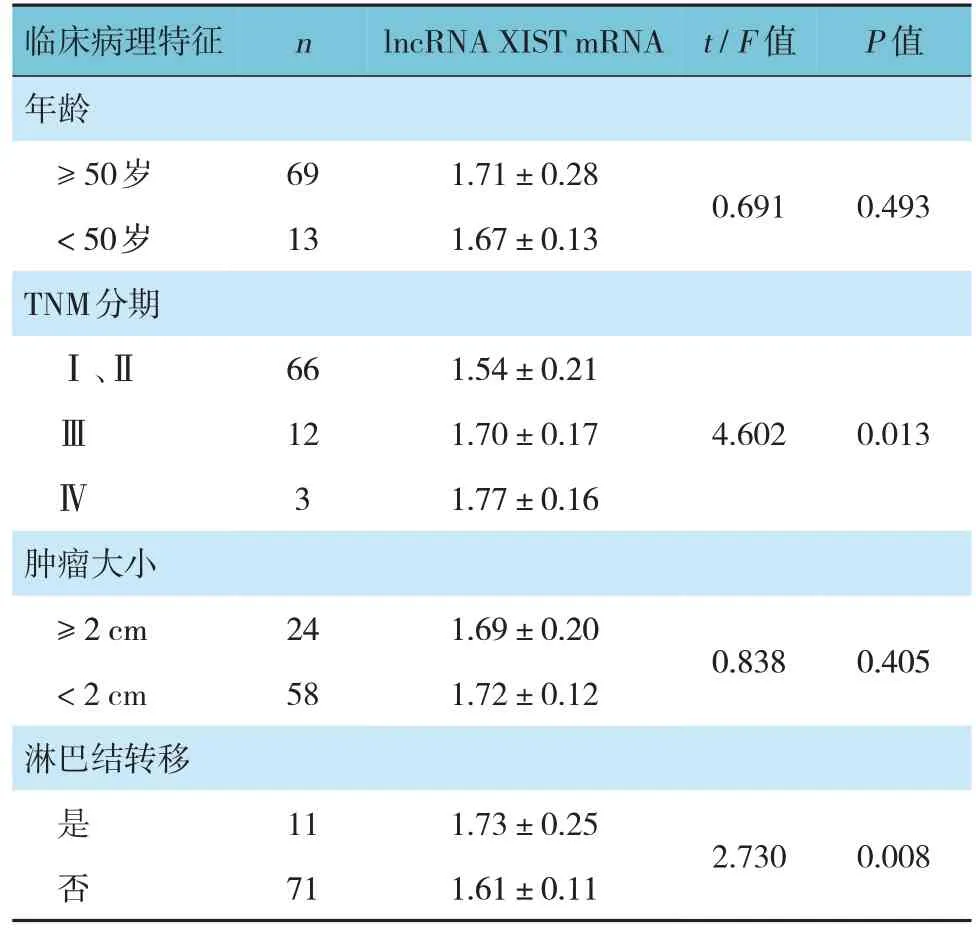
表1 不同临床病理特征患者子宫内膜癌组织lncRNA XIST mRNA相对表达量的比较 ()
n t/F 值lncRNA XIST mRNA P 值69 13 1.71±0.28 1.67±0.130.6910.493images/BZ_33_1284_789_1511_854.png临床病理特征年龄≥50岁<50岁Ⅰ、Ⅱimages/BZ_33_1511_789_1954_854.pngimages/BZ_33_1954_789_2089_854.pngⅢ Ⅳ66 12 3 1.54±0.21 1.70±0.17 1.77±0.16 4.6020.013images/BZ_33_1284_1049_1511_1114.pngimages/BZ_33_1511_1049_1954_1114.png≥2 cm<2 cmimages/BZ_33_1954_1049_2089_1114.png24 58 1.69±0.20 1.72±0.120.8380.405images/BZ_33_1284_1244_1511_1309.pngimages/BZ_33_1511_1244_1954_1309.pngimages/BZ_33_1954_1244_2089_1309.png是 否11 71 1.73±0.25 1.61±0.112.7300.008
2.3 不同子宫内膜癌细胞系中lncRNA XIST mRNA相对表达量的比较
人子宫内膜癌细胞系Ishikawa、HEC-1A、RL-952及正常人子宫内膜细胞系的lncRNA XIST mRNA 相对表达量分别为(2.02±0.11)、(1.21±0.10)、(1.32±0.23)和(0.19±0.04),经方差分析,差异有统计学意义(F=89.091,P=0.000);人子宫内膜癌细胞系Ishikawa 的lncRNA XIST mRNA 相对表达量高于其他各细胞系(P<0.05)。
2.4 NC组与sh-XIST组细胞转染成功
NC 组与sh-XIST 组细胞转染率均≥80%,转染成功。见图1。
图1 两组转染Ishikawa细胞荧光图 (×50)
2.5 各组Ishikawa细胞增殖活性的比较
C 组、NC 组、sh-XIST 组不同时间点 Ishikawa细胞增殖活性比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞增殖活性有差异(F=6.182,P=0.002);②C 组、NC 组、sh-XIST 组的细胞增殖活性有差异(F=5.071,P=0.001),sh-XIST 组与C 组和NC 组比较,细胞增殖活性均较低 (P<0.05);③C 组、NC 组、sh-XIST 组的细胞增殖活性变化趋势有差异(F=3.174,P=0.000)。见表3 和图2。

图2 各组细胞不同时间点的细胞增殖活性
表2 不同临床病理特征患者子宫内膜癌组织miR-101-3p mRNA相对表达量的比较 ()

表2 不同临床病理特征患者子宫内膜癌组织miR-101-3p mRNA相对表达量的比较 ()
images/BZ_33_1284_1663_1511_1798.png≥45岁<45岁Ⅰ、Ⅱimages/BZ_33_1511_1663_1609_1734.png images/BZ_33_1609_1663_2097_1734.png P 值images/BZ_33_1511_1734_1942_1798.pngimages/BZ_33_1942_1734_2097_1798.png45 37 0.50±0.11 0.51±0.141.1740.132images/BZ_33_1284_1928_1511_1993.pngimages/BZ_33_1511_1928_1942_1993.pngimages/BZ_33_1942_1928_2097_1993.pngⅢ Ⅳ66 12 3 0.58±0.15 0.48±0.13 0.41±0.10 3.9880.022images/BZ_33_1284_2188_1511_2253.pngimages/BZ_33_1511_2188_1942_2253.png≥2 cm<2 cmimages/BZ_33_1942_2188_2097_2253.png24 58 0.51±0.19 0.53±0.150.5070.614images/BZ_33_1284_2383_1511_2448.pngimages/BZ_33_1511_2383_1942_2448.pngimages/BZ_33_1942_2383_2097_2448.png是 否11 71 0.43±0.11 0.57±0.143.7840.000
表3 不同时间点各组Ishikawa细胞增殖活性的比较()
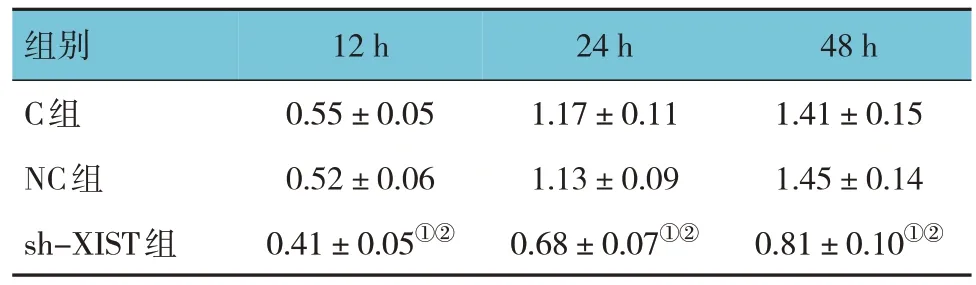
表3 不同时间点各组Ishikawa细胞增殖活性的比较()
注 :①与C组比较,P <0.05;②与NC组比较,P <0.05。
组别C组NC组sh-XIST组12 h 0.55±0.05 0.52±0.06 0.41±0.05①②24 h 1.17±0.11 1.13±0.09 0.68±0.07①②48 h 1.41±0.15 1.45±0.14 0.81±0.10①②
2.6 各组Ishikawa细胞迁移能力的比较
C 组 、 NC 组 、 sh-XIST 组 Ishikawa 细 胞 24 h 的划痕迁移率分别为(58.17±1.15)%、(54.51±1.82)%、(23.11±1.07)%,3 组比较,经方差分析,差异有统计学意义(F=578.366,P=0.000),sh-XIST 组低于 C 组和 NC 组 (P<0.05)。见图 3。

图3 各组shikawa细胞迁移能力 (×20)
2.7 各组Ishikawa细胞侵袭能力的比较
C 组 、NC 组 、sh-XIST 组 的 入 侵 细 胞 分 别 为(637.50±60.10)个 、(602.30±61.50)个 、(187.20±33.10)个,3 组比较,经方差分析,差异有统计学意义 (F=66.488,P=0.000),sh-XIST 组少于 C 组和NC 组 (P<0.05)。见图4。

图4 各组Ishikawa细胞侵袭能力 (×40)
2.8 双荧光素酶活性检测lncRNA XIST 与miR-101-3p的靶向性
Targetscan(http://www.targetscan.org/)网站预测结果显示,lncRNA XIST 与miR-101-3p 基因序列存在结合位点,见图5。双荧光素酶报告基因结果显示 ,lncRNA XIST-mimics-NC-miR-101-3p-WT 组 、lncRNA XIST-mimics-miR-101-3p-WT 组 、lncRNA XIST-mimics-NC-miR-101-3p-MT 组、lncRNA XIST-mimics-miR-101-3p-MT 组的荧光素酶活性分别为(1.17±0.21)、(0.48±0.11)、(1.22±0.13)、(1.15±0.12),各组比较,经方差分析,差异有统计学意义(F=16.919,P=0.001),mimics-NC组miR-101-3p-WT高 于 mimics-miR-101-3p 组 miR-101-3p-WT(P<0.05)。见图6。

图5 lncRNA XIST的靶基因预测
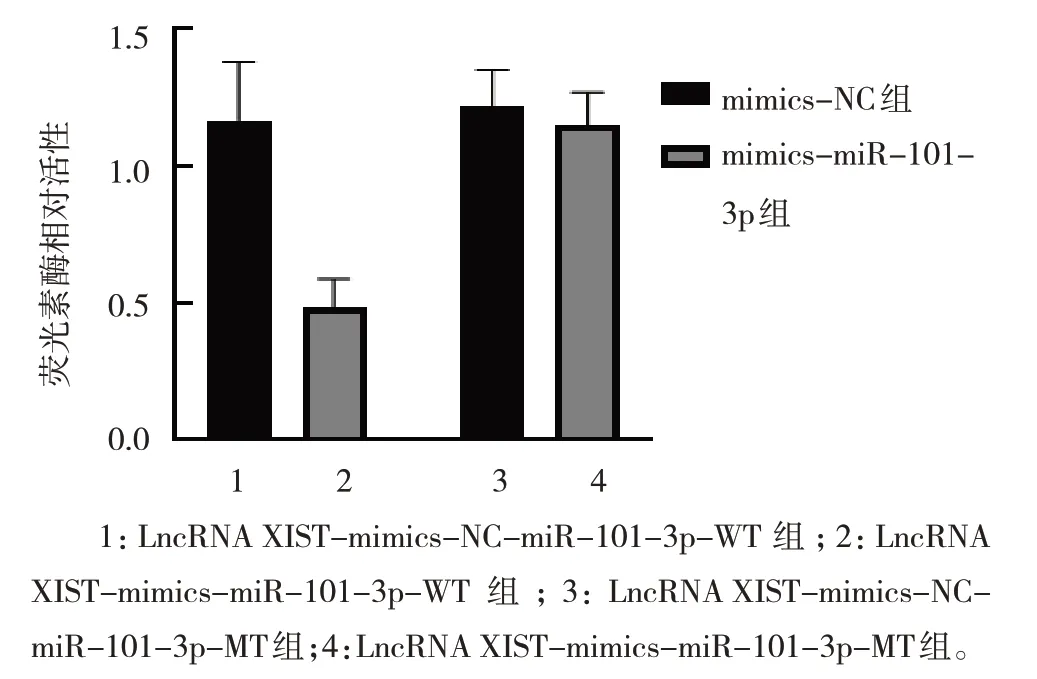
图6 各组荧光素酶相对活性比较
3 讨论
EC 是一种常见的女性生殖系统恶性肿瘤,多发于绝经后女性,但近年来随着人们生活方式的不断改变,EC 的发病群体逐渐年轻化,发病率也逐年上升[10]。由于EC 的高发病率与致死率,导致女性生命健康受到极大威胁。虽然治疗EC 医疗技术在不断提高,但EC 患者的生存率和复发率仍然困扰着患者和医生。因此,探寻EC 的发生机制对EC 的治疗具有至关重要的作用。非编码RNA 分为lncRNA、miRNA、干扰小 RNA 等,其中 lncRNA 长度一般>200 个核苷酸,且被发现与多种恶性肿瘤的发展具有密切关系[11]。lncRNA XIST 是有关X 染色体失活的转录本,可以特异性地与X 染色体结合并参与介导其失活。MicroRNA 的长度一般为22 个核苷酸,在真核细胞的基因表达调控中具有重要作用。miR-101-3p 被发现与多种肿瘤有关,并且可以作为前列腺癌诊断和预后的生物标志物[12]。
本研究结果显示,EC 组织中 lncRNA XIST mRNA 相对表达量高于癌旁组织,miR-101-3p表达量低于癌旁组织,且在不同TNM 分期和是否淋巴结转移患者EC 组织中的表达有差异。TNM 分期越高、发生淋巴结转移的EC 组织中lncRNA XIST 表达 越 高 、 miR-101-3p 越 低 。 说 明 EC 组 织 中lncRNA XIST 的表达被激活,miR-101-3p 的表达被抑制,这两种非编码RNA 与肿瘤的临床病理特征密切相关。既往研究[13]显示,miR-101-3p 在肾细胞癌细胞系中的表达受到抑制,过表达miR-101-3p可以抑制肾细胞癌细胞系的增殖、迁移与侵袭。张钰等[14]的研究显示,lncRNA XIST 在膀胱癌患者血清中表达升高,且其表达量与TNM 分期与淋巴转移相关。杨紫伟等[15]专利中显示,lncRNA XIST 可以作为胃癌诊断的标志物,可以作为治疗胃癌的靶点。以上研究与本研究结果共同说明,lncRNA XIST 与miR-101-3p 与肿瘤的发生有关,可以作为某些癌症的诊断标志物。
本研究通过CCK-8 法、划痕实验、Transwell 小室实验发现sh-XIST 组细胞的细胞增殖活性、迁移能力与侵袭能力均低于C 组和NC 组。提示沉默lncRNA XIST 可以抑制Ishikawa 细胞的恶性生物行为。闵捷等[16]研究显示,lncRNA XIST 在胰腺癌中表达量高于癌旁组织,并且沉默胰腺癌细胞中lncRNA XIST 后胰腺癌细胞的增殖与迁移能力降低。这与本研究结果共同说明,沉默lncRNA XIST 可以抑制癌细胞的恶性生物学行为。此外,本研究中双荧光素酶报告基因显示,lncRNA XIST 可以靶向作 用 于 miR-101-3p, 说 明 在 Ishikawa 细 胞 中lncRNA XIST 可以靶向调节 miR-101-3p。DU 等[17]研究显示,在甲状腺乳头状癌细胞中,lncRNA XIST可以靶向作用于miR-101-3p,对癌细胞的迁移与侵袭进行调控。这与本研究结果共同说明,lncRNA XIST 确可以靶向调节miR-101-3p。
综上所述,lncRNA XIST 和miR-101-3p 在人子宫内膜癌组织中异常高表达,Ishikawa 细胞中的lncRNA XIST 可以靶向调控miR-101-3p 影响细胞生物学行为。但本研究选取的临床标本数量有限,结果可能存在偏倚,因此还需后续扩大样本量进行验证。

