酒醅及窖泥中乳酸菌的筛选及产酸特性研究
毛 豪,王家胜,赵 婷,蔡开云,陈 萍,冯向东,明 聃,陈茂彬
(1.湖北工业大学生物工程与食品学院,湖北省酿造工艺与装备工程技术中心,湖北武汉 430068;2.湖北省稻花香酒业有限公司,湖北宜昌 443000)
乳酸菌是白酒酿造中必不可少的微生物,窖泥中乳酸菌是重要的产酸细菌,谢玉球等[1-2]在窖泥中分离的乳酸菌中发现不同种属和不同生长特征的乳酸菌对白酒的风味贡献是不一样的。有研究表明,乳杆菌属与甲氧基乙酸异戊酯、戊酸乙酯、油酸乙酯、亚油酸乙酯等酯类物质呈正相关。乳酸是乳酸菌的主要代谢产物,被认为是白酒中四大酸之一,占白酒中有机酸的43%左右[3-5],白酒中含有适量的乳酸能够减轻酒体刺鼻的味道,减少涩味、增强余味、增加甜度使酒体协调醇厚[1]。此外有学者认为乳酸能催化新酒老熟[6]。在白酒生产过程中酒醅里的乳酸及乳酸乙酯会在蒸馏时进入酒体,由于乳酸的沸点较高不易挥发,一般情况下酒尾乳酸的含量大于酒身,发酵过程中产生的大部分乳酸不会被带入酒体而是留在废酒糟中[1,7]。
乳酸与乙醇通过酯化作用生成乳酸乙酯,被认为是白酒中的四大酯之一,在清香型白酒中乳酸乙酯是除了乙酸乙酯外的第二大主体香气成分[8-9],此外,乳酸乙酯与其他三大酯的比例对酒质有显著的影响,酒体中适量的乳酸乙酯从香味上能“助香”,防止“爆香”,从口感上能减少苦涩味,增加醇厚感。乳酸菌在白酒发酵中有着重要的地位,研究乳酸和乳酸乙酯对改善和调控白酒的品质和风味有较为积极的作用。
1 材料与方法
1.1 材料、试剂及仪器
样品:馫香型白酒发酵醅、窖泥。
试剂及耗材:酵母浸粉、吐温80、牛肉膏,双旋微生物培养基制品厂;磷酸氢二铵、溴甲酚紫、氯化钠、葡萄糖、醋酸钠、柠檬酸三铵、K2HPO4·7H2O、MgSO4·7H2O、醋酸钠·3H2O、MnSO4·4H2O,国药集团化学试剂有限公司;无水乙醇,阿拉丁试剂(上海)有限公司;草酸铵,天津市致远化学试剂有限公司;结晶紫,天津市大茂化学试剂厂;番红染色液,北京索莱宝科技有限公司。
仪器设备:DHG.9140A 恒温干燥箱,上海精宏实验设备有限公司;ZHJH-C1214B 超净工作台,上海智城分析仪器有限公司;UtiMae3000高效液相色谱仪,赛默飞世尔科技公司;PHX智能生化培养箱,宁波莱福科技有限公司;TGL-16C 台式离心机,上海安亭科学仪器厂。
MRS固体培养基:蛋白胨10.0 g、牛肉膏5.0 g、酵母浸粉4.0 g、葡萄糖20.0 g、吐温·80 1.0 mL、K2HPO4·7H2O 2.0 g、醋酸钠·3H2O 5.0 g、柠檬酸三铵2.0 g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.05 g、琼脂粉15.0 g,加蒸馏水定容至1000.0 mL。
MRS液体培养基:蛋白胨10.0 g、牛肉膏5.0 g、酵母浸粉4.0 g、葡萄糖20.0 g、吐温·80 1.0 mL、K2HPO4·7H2O 2.0 g、醋酸钠·3H2O 5.0 g、柠檬酸三铵2.0 g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.05 g,加蒸馏水定容至1000.0 mL。
1.2 实验方法
1.2.1 乳酸菌的初筛
取各类样品10.0 g,放入含有玻璃珠的90 mL无菌生理盐水中,在30 ℃、180 r/min 下振荡分散30 min,梯度稀释后取100 μL涂布至含有溴甲酚紫的MRS 固体培养基中,35 ℃厌氧培养2 d。对单菌落划线纯化3~5 次后保藏于终浓度为20%的甘油管及MRS斜面中。
1.2.2 乳酸菌的复筛
将初筛得到的8 株产酸菌接种至MRS 液体发酵培养基中,按照2%的接种量35 ℃深层厌氧发酵7 d,采用高效液相色谱法测定乳酸含量,筛选出产乳酸性能最强的菌作为目的菌株。
1.2.3 菌种鉴定
将分离纯化的8 株产酸菌制备菌液后送至北京六合华大基因科技有限公司进行检测鉴定。
1.2.4 目的菌种的发酵特性研究
1.2.4.1 培养时间对L1的生长量及产酸量的变化
将MRS 液体培养基分装于试管中,每支试管30 mL,将乳酸菌接种于MRS 培养基中进行活化,30 ℃下180 r/min培养18 h作为种子液,按2%的接种量接入试管中,30 ℃培养7 d,每隔1 d 取出3 个平行样品,适当稀释后以未接种培养基作为空白于600 nm 波长下用分光光度计测定吸光度,取平均值,以时间为横轴绘制乳酸菌的生长曲线,同时对发酵液中的乳酸含量进行检测。
1.2.4.2 接种量对L1生长量及产酸量的变化
将种子液按1%、1.5%、2%、2.5%、3%的接种量接入MRS 液体培养基试管中,30 ℃静置培养7 d 后,以未接种MRS 培养基为空白对照于波长600 nm 下测定其OD 值,同时对乳酸含量进行检测。
1.2.4.3 葡萄糖浓度对L1生长量及产酸量的变化
种子液按2 %接种量接入到葡萄糖含量分别为0.5 %、1 %、1.5 %、2 %、2.5 %的MRS 液体培养基试管中,30 ℃静置培养7 d 后,以未接种MRS 培养基为空白对照于波长600 nm 下测定其OD 值,同时对乳酸含量进行检测。
1.2.4.4 培养温度对L1生长量及产酸量的变化
按种子液2 %的接种量接入MRS 培养基试管中,分别置于30 ℃、32 ℃、34 ℃、36 ℃、38 ℃静置培养7 d 后,以未接种MRS 培养基为空白对照于波长600 nm 下测定其OD 值,同时对乳酸含量进行检测。
1.2.4.5 初始pH值对L1生长量及产酸量的变化
分别调整初始MRS 培养基的pH 值为3.0、4.0、5.0、6.0、7.0,接入2%的种子液,30 ℃静置培养7 d后,以未接种MRS培养基为空白对照于波长600 nm下测定其OD值,同时对乳酸含量进行检测。
2 结果与分析
2.1 乳酸菌的筛选
2.1.1 乳酸菌的初筛(平板显色反应)
如图1 所示,以8 株菌落为半径,产生了一圈黄色透明圈,在pH 值大于6.8 的培养基中,溴甲酚紫为弱碱式结构,呈现为紫色,8 株菌株生长繁殖时,产生了酸性物质,使得pH 值降到5.2 以下,培养基中的溴甲酚紫为弱酸式结构,呈现为黄色。因此,当菌落周围出现黄色透明圈时,说明菌株产生酸性物质,可以判断这8 株为产酸菌株,将它们保藏至MRS斜面和甘油管中作为初筛菌株。
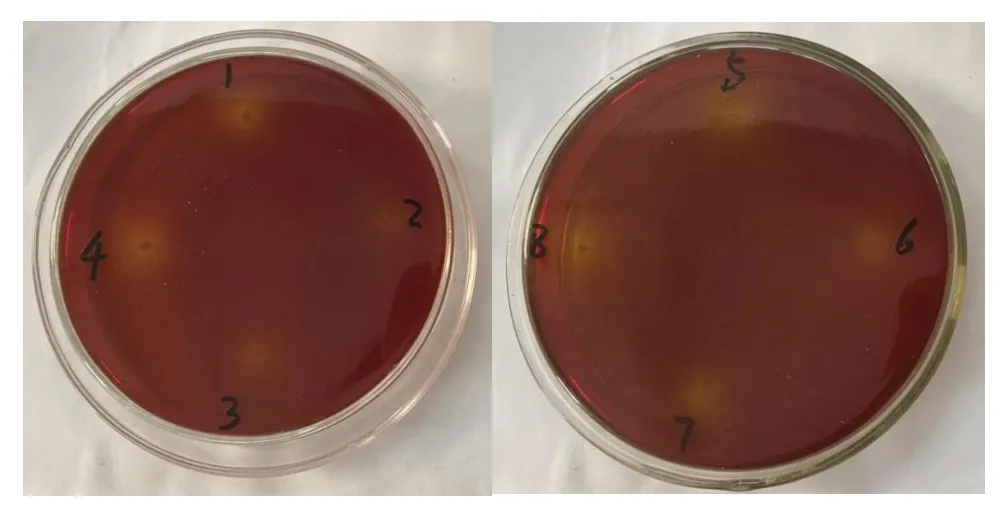
图1 8株产酸菌平板显色反应
2.1.2 乳酸菌的复筛
建立的乳酸标准曲线为y=9.0691x+0.3771,R2=0.9998。发酵7 d 后,将发酵产物膜过滤后进行HPLC检测[10-11],色谱图如图2所示,8株菌株全部产生乳酸,根据标准品可知,乳酸的出峰时间为4.290±0.02。乳酸标准品的标准曲线的线性相关系数在0.999 以上,可用于准确定量,根据线性方程可计算出样品中对应乳酸的含量。菌种发酵7 d 后的pH 值与乳酸含量如图3 所示,菌种L1—L8 的pH 值较空白普遍下降,说明8 株菌株都产生了酸性物质,使发酵液中的pH 值降低,菌株L1 的发酵液pH值最低为4.1,且产乳酸含量最高为4.865 g/L,说明菌株L1 的产乳酸能力与性能比其他菌株强,因此将菌株L1作为目的菌株。

图2 8株乳酸菌产乳酸的HPLC色谱图

图3 发酵液中乳酸含量及pH值
2.2 菌种鉴定
将16S rDNA 序列进行NCBI-BLAST,通过比对L1 菌株与Weissella confusa相似性达100%并且与MT515858.1 菌株亲缘关系最为接近,从BLAST结果中选取相似性较高的10 株菌并利用MEGA 7.0软件构建L1菌株系统发育树(NJ)[12]。

图4 L1菌株发育树
2.3 L1发酵特性的研究
2.3.1 培养时间对L1的生长量及产酸量的变化
由图5A 中L1 随着培养时间OD600的变化趋势可知,在0~1 d 生长速率缓慢,是菌种生长的迟缓阶段,细菌进入新的环境需要适应,生长较为迟缓;在1~2 d 生长速率加快,说明生长达到对数生长阶段,细菌生长速率最快,且此时细菌的大小、生理活性等都比较典型,因此进行菌种鉴定时一般选用对数生长时期的菌种,第2 d时生长量达到峰值;在第2~3 d,菌种量保持相对稳定,菌种数量处于稳定期;在第3~4 d,菌种生长量下降,细菌生长繁殖速度减慢或者停止,死亡数大于生长量,菌种生长进入衰亡期。L1 的整个生长曲线符合微生物生长规律。由图5B 中L1 的乳酸含量随着培养时间的变化趋势可知,在0~2 d,乳酸含量较低,此时乳酸菌生长量较低,导致乳酸产率低;随着时间的延长,乳酸含量升高,这是由于菌体含量高,β-半乳糖苷酶的含量较多,活力较高。有研究表明,在一定条件下,乳酸的生成速率和β-半乳糖苷酶的活力呈现正相关;在第6 d,乳酸含量不再增长,随着发酵时间的延长,乳酸过多使得pH 值降低,抑制了酶的活力,或者由于乳酸含量过高抑制了菌体的生长,菌体衰亡,导致乳酸含量不再增加。
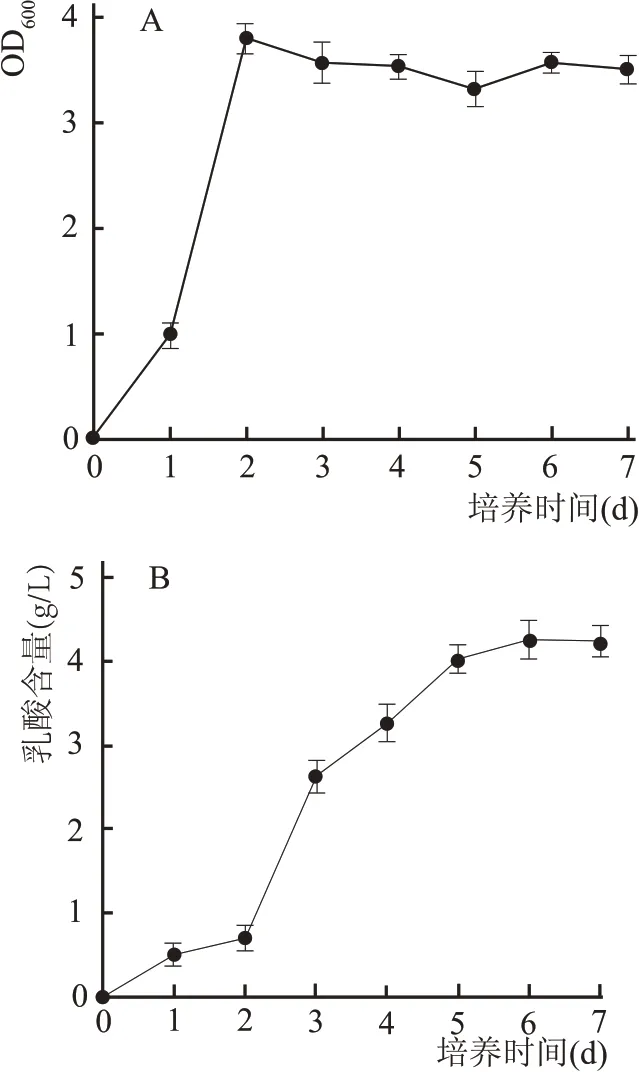
图5 L1随着培养时间生长量及乳酸含量的变化
2.3.2 接种量对L1的生长量及产酸量的变化
接种量的大小决定菌种的生长速度,从而影响菌种代谢产物的含量。接种量过多,导致溶氧不足,代谢产物过多,不利于产物合成。由图6A 中接种量对L1 的生长量影响可知,随着接种量的增加,L1 的生长量随之增加,当接种量≥2 %时,菌体量趋于平稳。由图6B 中接种量对L1 产酸量的影响可知,当接种量为2 %时,乳酸含量达到峰值4.611 g/L,随着接种量的增加,乳酸含量开始下降,这可能是由于在接种量变大时种子液中的有毒代谢物被大量带入发酵体系,代谢产物的毒性抑制了乳酸的生成。结合接种量对菌体的生长及产乳酸的影响,当接种量为2 %时,菌种含量达到峰值的80 %以上,产酸含量达到最高,因此选择2 %作为最佳接种量。
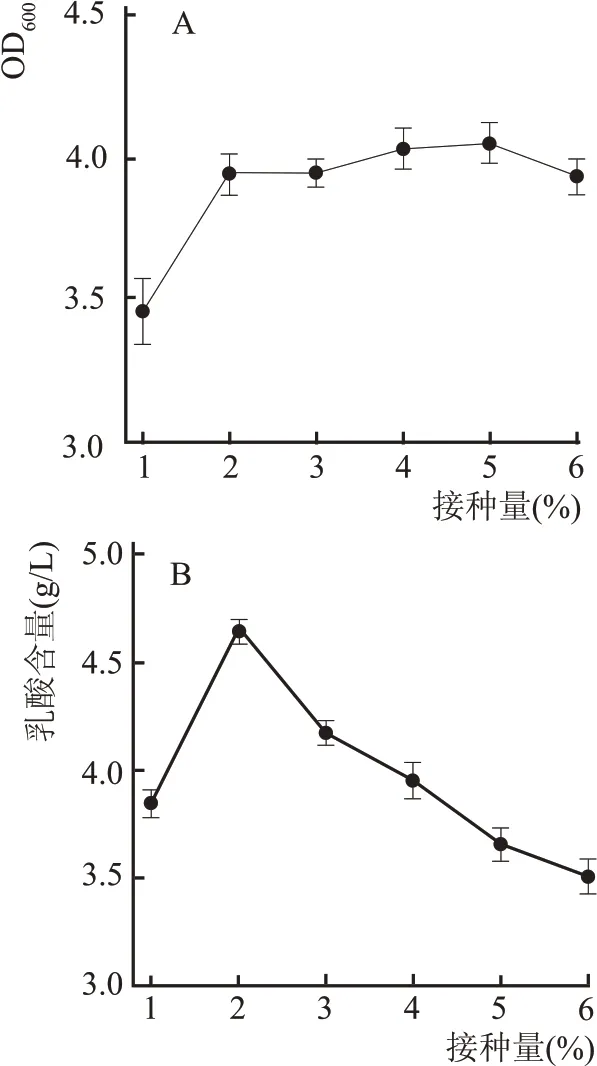
图6 接种量对L1的生长量及产酸影响
2.3.3 葡萄糖添加量对L1 的生长量及产酸量的变化
葡萄糖作为菌种生长的必要物质,也是乳酸菌生产乳酸的重要原料,探究葡萄糖的添加量对发酵特性的影响是必要的。如图7A 中葡萄糖添加量对乳酸菌生长量的变化趋势所示,随着葡萄糖含量的升高,生长量随之升高,当达到1.5 %时,生长量趋于稳定。由图7B 中葡萄糖的添加量对乳酸含量的影响可知,当葡萄糖含量为2.0 %时,乳酸含量最高,为5.15 g/L;葡萄糖添加量继续升高,乳酸含量降低,这可能是由于底物浓度过高产生了底物抑制和高渗应激效应,导致乳酸产量变低。
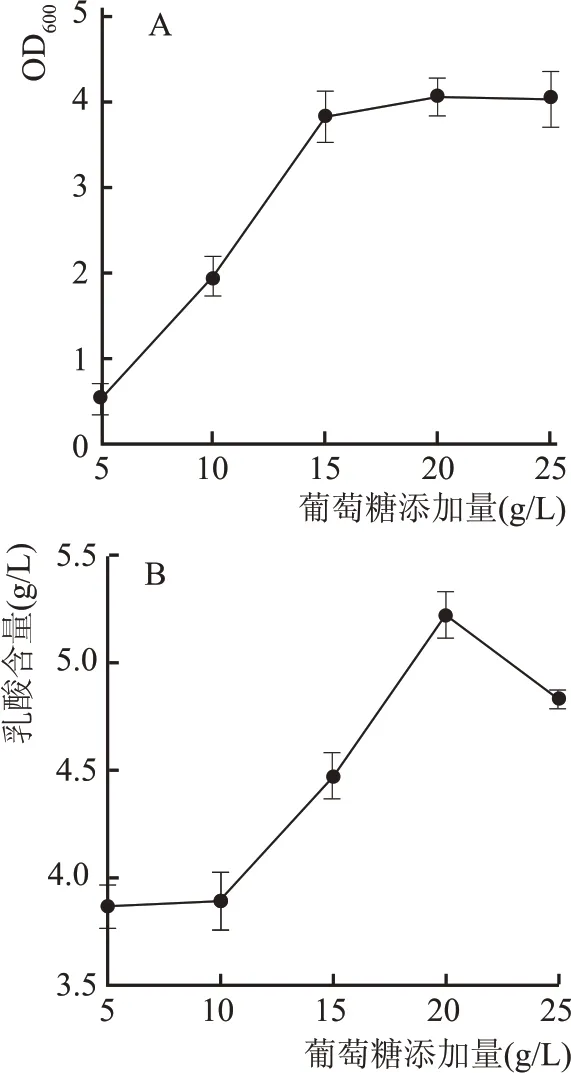
图7 葡萄糖含量对L1的生长量及产酸影响
2.3.4 培养温度对L1的生长量及产酸量的变化
温度对生物体内的酶有着很大的影响,对菌体生长量以及与乳酸合成有关的酶有一定的调控作用。由图8A 培养温度对乳酸菌生长量的变化趋势可知,随着温度的升高,L1 的生长量随之升高,当温度为35 ℃时,OD600达到最大值为4.76,因此最适生长温度为35 ℃,且产酸含量最高为4.56 g/L;超过35 ℃时,随着温度的升高,菌体生长量和产酸量都下降,说明温度过高,减缓了乳酸菌体的生长,导致生长量下降,并且抑制了合成乳酸关键酶的活性,导致乳酸含量下降。

图8 培养温度对L1的生长量及产酸影响
2.3.5 初始pH值对L1的生长量及产酸量的变化
pH 值对细菌的生长有很大的影响,过酸过碱都会抑制菌种量,pH 值可以影响酶的活性、膜表面的表面电荷性质及通透性等从而影响细菌对营养物质的吸收及转运。因此,找到细菌适宜的生长pH值是重要的。如图9A中初始pH值对L1的生长量的变化趋势所示,生存环境由酸到中性,菌体含量持续上升,当中性环境转变为碱性环境时,生长量趋势开始下降,说明L1 在中性环境中的生长量较好。如图9B 中初始pH 值对L1 产乳酸含量的变化趋势所示,随着pH 值的升高,乳酸含量升高,L1在酸性环境中的生长量低;因此产物较低。当pH值为6.0 时,乳酸含量达到最高;当pH 值高于6.0时,乳酸含量随之降低,这是由于生长量最高时,产物复杂,抑制了乳酸的合成,导致乳酸含量较低,生长量较低时,代谢产物种类较少,对酶的活性及菌体的抑制效果较弱,因此pH6.0 时乳酸含量最高,为4.53 g/L,而不是pH7.0 时生长量最大时的乳酸含量最高。

图9 初始pH值对L1的生长量及产酸影响
3 讨论
从样品中分离的8 株产酸菌经过复筛得出L1菌株产乳酸能力最强;对乳酸菌L1 发酵性能进行分析,结果表明,最佳发酵时间为6 d,最佳接种量为2%,最佳葡萄糖添加量为20 g/L,最佳培养温度为33 ℃,最佳初始pH6.0,在此条件下乳酸含量最高为5.341 g/L。
本实验得到的乳酸菌具有与酵母菌进行复配直接共培养生产乳酸乙酯用于酒和食品调香的能力[9]。在酿造体系中乳酸菌是不可缺少的,当酒中出现乳酸乙酯含量不足,整体香味欠协调,酒体欠圆润的问题时,可以在发酵过程或者制曲过程加入适量的乳酸菌强化发酵,提升酒的品质。

