用荧光示踪技术研究鞣制过程氧化海藻酸钠鞣剂的传质行为
付佳,朱敏,王亚楠,2*,石碧,2
(1.四川大学制革清洁技术国家工程实验室,四川成都610065;2.四川大学皮革化学与工程教育部重点实验室,四川 成都610065)
设计开发有
良好鞣制性能的无铬鞣剂,制造无铬生态皮革,从源头消除铬污染,是当前皮革行业的重大需求[1-3]。目前,醛鞣剂如改性戊二醛、噁唑烷、有机膦盐等,由于鞣制性能较优,已在一定范围内替代部分铬鞣剂使用[4]。但上述鞣剂在使用时会释放有毒物质——甲醛[5],因此,有必要继续研发无甲醛的环保型醛鞣剂。
海藻酸钠作为一种天然多糖,经由高碘酸钠氧化可制得氧化海藻酸钠(OSA)[6-8]。前期研究表明,OSA结构中富含的醛基可与皮胶原氨基共价交联,形成席夫碱结构,能够作为皮革鞣剂使用[9]。同时,由于OSA糖单元结构的C6均为羧基,其在高碘酸钠氧化过程中不会产生甲醛[10],是环保型醛鞣剂的理想候选之一。OSA的醛基含量、相对分子质量及分布、聚集状态等结构因素均可能通过改变其在皮革多层级结构中的传质行为,最终影响OSA的鞣制效果[11-12]。但是,OSA的结构与其传质特性及鞣制性能之间的关系,仍有待研究阐释。
建立合适的测试方法是研究化学品在皮革中传质行为的前提。对于金属鞣剂(如铬、铝、锆鞣剂等),可以用X射线能谱仪(EDS)研究其在皮革中的渗透和分布[13-14]。而对于酶制剂、丙烯酸复鞣剂和氨基树脂复鞣剂等有机化学品,也有研究用荧光素对其进行荧光标记和示踪[15-17]。因此,对于OSA这类有机鞣剂,也可以采用这种荧光示踪技术来研究其在皮革中的传质和分布情况。N-甲基靛红酸酐(MIA)是一种具有紫外及荧光特性的小分子标记物。它能够与羟基发生反应,用于多糖、RNA的荧光标记[18-21]。本研究拟用荧光素MIA对OSA(同样富含羟基)进行标记,再用标记产物对牛皮进行鞣制,进而完成其在皮革中传质行为的荧光可视化,以期为OSA鞣剂的分子设计、制备与应用提供理论参考。
1 实验部分
1.1 主要试剂与仪器
MIA,分析纯,上海阿拉丁生化科技股份有限公司;葡聚糖凝胶G25(fine),Sigma-aldrich公司;PEG-20000,分析纯,成都市科隆化学品有限公司;海藻酸钠,氢氧化钠、浓盐酸、氯化钠,碳酸氢钠,正丙醇,乙醇,白凡士林,分析纯,成都科龙化工试剂厂;氧化海藻酸钠,按文献方法,用高碘酸钠氧化法制得[11];浸酸牛皮,购自山东某制革厂。
BSZ-100自动组分收集器、HL-2恒流泵,上海沪西仪器分析厂有限公司;UV-1800BPC紫外可见分光光度计,上海美谱达公司;F-7100荧光光谱仪,日立公司;LGJ-30F真空冷冻干燥机,宁波新艺超声设备有限公司;1260 Infinity II高效液相色谱仪,Agilent公司;TCLP翻转振荡器,科博实验设备研究所;CM1950冷冻切片机、DMi8倒置荧光显微镜,STELLARIS 5激光扫描共聚焦显微镜,Leica公司。
1.2 MIA标记OSA的制备
图1为MIA标记OSA的反应原理,通过OSA的羟基(电负性较高)对MIA苯并噁嗪环4位位置上羰基(据共轭效应与诱导效应判断,该位置的碳正离子电正性强)的攻击,使碳氧单键和碳氮单键断裂而生成产物,且伴随着二氧化碳的损失[20-21]。
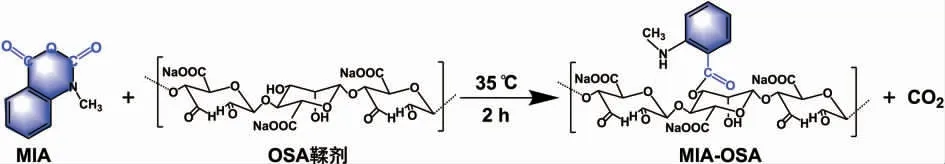
图1 MIA荧光标记OSA鞣剂的反应原理Fig.1 Reaction mechanism of OSA tanning agent labeled by MIA fluorescence
参考涂宗财等人[22]的方法,用MIA对OSA进行标记。用9.5 mL二次水溶解0.4 g OSA,再用0.5 mL DMSO溶解8~20 mg MIA,将这2种溶液混合,在35℃反应2 h,得到MIA-OSA粗品。
用PEG-20000包埋法将MIA-OSA粗品浓缩至3 mL左右。浓缩液通过0.45 μm针头过滤器过滤后进行凝胶色谱分离。色谱分离条件为:柱填料为G25葡聚糖凝胶,流动相为二次水,流速为0.6 mL/min,进样量为0.5 mL。用自动组分收集器对洗脱液进行收集,每组分为3 mL,用紫外可见分光光度计在360 nm(MIA的最大吸收波长)处测定各组分的吸光度。收集到高纯度MIA标记的OSA组分,将其冷冻干燥后获得MIA-OSA,于-80℃避光保存。
1.3 MIA-OSA的性质表征
1.3.1 薄层色谱分析
取市售薄层色谱板(TLC板)在110℃活化0.5 h,置于干燥器备用。将展开剂(V正丙醇∶V水∶V甲醇=3∶1∶0.5)放在层析缸中,盖上缸盖,让缸内蒸汽饱和5~10 min。取MIA-OSA粗品溶液与MIA溶液(对照),分别点0.2 μL于TLC板距边缘7 mm处,将其样点一端朝下放入缸内,浸入深度距底边0.5~1 mm,盖好缸盖,待展距在7~17 cm范围时,取出、放平并标明溶剂前沿位置,干燥后用紫外灯(激发波长为365 nm)照亮展开完成的TLC板并拍照记录。
1.3.2 荧光光谱分析
用荧光光谱仪测定了MIA(50 mg/L)、MIA-OSA(200 mg/L)和OSA(50 mg/L)的荧光发射光谱,激发波长为MIA的最大激发波长360 nm。为了研究MIA-OSA的荧光稳定性,在31天内连续监测其荧光发射光谱。
1.3.3 pH对MIA-OSA荧光强度的影响
取纯化后收集的MIA标记OSA溶液,用氢氧化钠和盐酸溶液调节pH分别为3、4、5、6、7、8和9,并保证样品溶液浓度相同,用荧光光谱仪在相同参数下分别测定溶液的荧光发射光谱。
1.3.4 相对分子质量测定
用尺寸排阻色谱法测定OSA与MIA-OSA的重均相对分子质量(Mw)及多分散系数(PDI)。配制质量浓度为3~5 mg/mL的样品溶液,用0.45 μm水系滤头过滤后,按以下条件进行分析:流动相为0.1 mol/L的NaNO3,流速为0.6 mL/min,进样体积为100 μL,色谱柱为TSK-gel GMPWXL(7.8 mm×300 mm),柱 温 为30℃。用 普 鲁 兰 多 糖 标 样(180~600000 Da)校准[10,23]。使用OmniSEC 4.7软件计算得到Mw和PDI。
1.4 观察与测定鞣制过程中MIA-OSA的传质行为
取多块相邻对称部位的浸酸牛皮(每块1.0 g左右),质量增加200%作为化料用量基准,按照表1进行鞣制实验。在鞣制过程的多个时间节点取样,用冷冻切片机切取厚度为20 μm的纵切面组织切片,然后用荧光显微镜观察,得到显微照片,经Image J软件分析处理得到各鞣制阶段的荧光强度图,以确定MIA-OSA在皮革中的相对含量分布。选择鞣制时间为2 h的组织切片,用激光扫描共聚焦显微镜进行观察,得到一系列高分辨率的荧光及明场图片。

表1 OSA鞣制工艺Tab.1 OSA tanning process
2 结果与讨论
2.1 MIA-OSA的性质
本研究目标是实现OSA鞣剂在皮革中的传质行为可视化。为此需要保证MIA-OSA中不含游离的MIA,以免影响鞣剂在皮革中的荧光示踪[24]。首先用薄层色谱法进行定性分析。由图2可知,MIA-OSA粗品中,除了MIA标记OSA组分留在原点,还出现了游离MIA,说明粗品中还存在未反应的MIA,标记反应并不完全,后续须进行分离纯化处理。

图2 MIA(左)与MIA-OSA粗品(右)的薄层色谱图Fig.2 TLC of MIA(left)and crude MIA-OSA(right)
随后用凝胶色谱法对MIA-OSA进行纯化,除去未反应的MIA。图3为MIA-OSA的洗脱曲线,结果表明MIA-OSA与游离的MIA成功分离,获得了高纯度的MIA-OSA。用荧光光谱法对MIA、OSA和MIA-OSA进行了分析,结果见图4。MIA和MIA-OSA均有明显的发射峰,而OSA无明显荧光,表明MIA成功接枝到OSA上,为MIA-OSA的荧光示踪提供了条件。

图3 MIA-OSA的洗脱曲线Fig.3 Elution curve of MIA-OSA
图4 MIA、OSA和MIA-OSA的荧光发射光谱Fig.4 Fluorescence emission spectra of MIA,OSA and MIA-OSA
进一步考察了存放时间和pH对MIA-OSA荧光强度的影响。如图5(a)所示,存放1个月期间,MIA-OSA的荧光稳定性较好,发射峰位置没有变化,峰值强度在2250~3250区间上下波动。由图5(b)可知,pH对MIA-OSA荧光强度的影响规律为,pH为7和8时的荧光强度较强,pH低于7时,荧光强度随pH降低而减小,故选择pH=7.5作为MIA-OSA鞣制的pH,以便对其在皮革中的传质行为进行观测。

图5 存放时间(a)和pH(b)对MIA-OSA荧光强度的影响Fig.5 Effects of storage time(a)and pH(b)on the fluorescence intensity of MIA-OSA
相对分子质量是影响化学品在皮革中渗透速度和传质程度的重要因素之一[15-16]。因此,研究了MIA标记对OSA相对分子质量的影响,结果见图6。标记前OSA的Mw为7.31×104,PDI为2.25,标记后Mw为6.29×104,PDI为2.19,其相对分子质量及分布相似。MIA-OSA的相对分子质量略低于OSA,这可能是因为柱层析导致了少量高相对分子质量OSA组分的损失。Ding等人用分级醇沉的方法得到了OSA的不同相对分子质量组分,证实高相对分子质量组分具有更好的填充性能,低相对分子质量组分具有更好的交联鞣制性能[25]。与该文献对比可知,本研究制备的MIA-OSA具有合理的相对分子质量,能够起到良好的鞣制作用。

图6 OSA(a)与MIA-OSA(b)的相对分子质量及分布Fig.6 Molecular weight and distribution of OSA(a)and MIA-OSA(b)
2.2 MIA-OSA在皮革中的传质
鞣制过程中MIA-OSA在皮革中的传质行为如图7所示。从皮革纵切面的荧光显微照片(图7a)可以看到,随着时间的推移,MIA-OSA由皮革两面向中间逐渐渗透,到1.5~2 h渗透完全。MIA-OSA在皮革纵切面上的相对含量分布(图7b)同样表明,渗透2 h和4 h时MIA-OSA的相对含量分布均较均匀,且变化不大。进一步用激光扫描共聚焦显微镜观察了鞣制2 h的组织切片,获得了不同放大倍数的高分辨显微照片(图8),能够展示从纤维网络到纤维束层级(Φ 20~200 μm),再到纤维层级(Φ 2~10 μm)的MIA-OSA分布情况。在纤维束层级,MIA-OSA荧光强度较高,且分布均匀。但在纤维层级,荧光十分微弱甚至不再显现。其原因可能是放大倍数增大,视野内存在的荧光物质减少的原因,也可能是能传递至该层级的MIA-OSA很少,有待进一步研究确认。总的来说,结合荧光显微镜和激光扫描共聚焦显微镜观测手段,能够实现MIA-OSA在皮革多层级中渗透与传质的可视化。
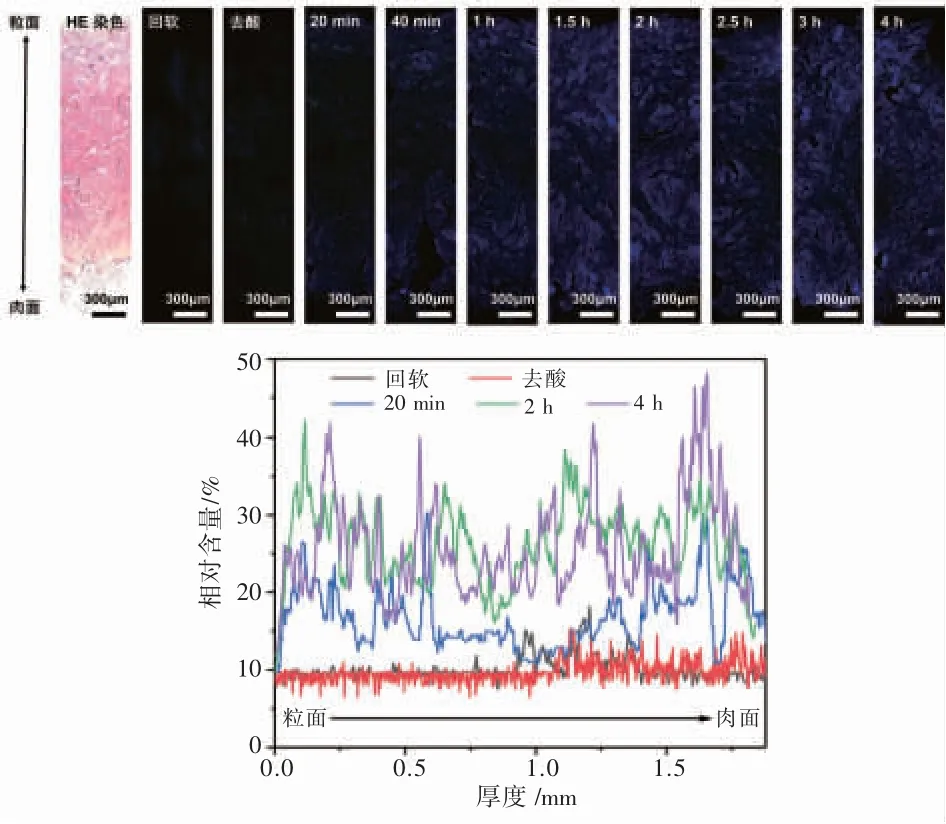
图7 鞣制过程中皮革纵切面的荧光显微镜照片及MIA-OSA的相对含量Fig.7 Fluorescence micrographs of cross-section of leather and relative content of MIA-OSA during tanning

图8 MIA-OSA鞣制2 h后皮革的激光扫描共聚焦显微照片(第一行:荧光图像;第二行:明场图像)Fig.8 Confocal laser scanning micrographs of leather tanned with MIA-OSA for 2 h(Top,fluorescence images;bottom,bright-field images)
3 结论
氧化海藻酸钠鞣剂OSA可被荧光素MIA成功标记,并通过柱层析获得了高纯度的MIA-OSA。该产物在较长时间(1个月)和pH 7~8时具有较高的荧光强度,且相对分子质量及分布与标记前相似。将MIA-OSA用于鞣制,实现了鞣制过程中OSA在皮革多层级结构中的传质行为观测,MIA-OSA在鞣制1.5~2 h后可在皮革纵切面中渗透完全。该荧光示踪技术的建立有望为新型生物质鞣剂的设计与应用提供理论参考。

