肿瘤来源外泌体miR⁃106a对肝母细胞瘤及其免疫微环境的影响
任巧利 李艳超
广州市妇女儿童医疗中心(广州 510006)
肝母细胞瘤(Hepatoblastoma,HB)是最常见的儿童肝脏恶性肿瘤,约占儿童肝脏相关肿瘤的50%[1],虽然手术联合化疗的治疗策略对HB患者的预后有所改进,但是由于其复发、转移等问题,患者预后仍然很差[2-3]。尽管Wnt/⁃catenin和Hippo信号通路被报道和HB发病有关,但是对这种疾病的分子机制认知仍然很少[4],在临床上仍然缺乏有效的靶向药物。因此,寻找在HB中有改变的靶点和信号通路,对于开发新的治疗药物,改善患者预后,具有重要意义。
肿瘤的发生发展与周围间质的改变息息相关,癌细胞可以通过分泌各种细胞因子、外泌体和其他因素对周围肿瘤细胞重新编程,改变周围肿瘤细胞的生存和转移能力[5]。肿瘤来源外泌体作为一种重要的细胞与细胞间物质交换和信息传递的途径,在肿瘤进展中发挥着重要作用[6]。miRNA是外泌体中最主要的RNA种类[6]。研究显示,miR⁃106a与肿瘤关系密切,参与调控多种肿瘤的发生发展及转移过程[7-9]。
肿瘤微环境中浸润有丰富的免疫细胞,其构成的免疫微环境对于肿瘤生长的影响十分显著[10]。越来越多的研究证明,肿瘤本身分泌的细胞因子可以重塑肿瘤免疫微环境[11]。骨髓来源的抑制性细胞(MDSCs)是一种抑制性的免疫细胞,大量研究证实肿瘤中的MDSCs可以通过抑制CD8+T细胞的浸润或功能,发挥其促肿瘤效应[12-14]。然而,目前尚未有研究探索HB细胞来源的miR⁃106a对肿瘤细胞及免疫微环境的影响。
本研究首次揭示了HB细胞及外泌体中高表达miR⁃106a,首次阐述miR⁃106a对于HB自身功能及其免疫微环境的作用,为明确肿瘤恶化的机制及发掘肿瘤治疗的新靶点打开一扇新的窗口。
1 材料与方法
1.1 细胞系和主要试剂人肝母细胞瘤细胞系HepG2、HuH6和人肝正常细胞L⁃02均购自美国ATCC菌种保藏库。PCR引物由上海生工设计并合成。miR⁃106a mimics及miR⁃106a inhibitors由上海吉马基因生物设计并合成。双萤光素酶报告基因检测试剂盒(碧云天)、Mir⁃X miRNA First⁃Strand Synthesis Kit(Takara)(Takara)、LipofectamineTM3000转染试剂盒(Invitrogen)购自优宁维。Western blot抗体CD63(Abcam)、CD9(Abcam)、Hsp70(Abcam)、PTEN(CST)、p⁃AKT(CST)、AKT(CST)、GAPDH(BOSTER),羊抗兔及羊抗鼠二抗购自广州君达生物。增强型化学发光试剂盒购自广州一科生物。
1.2 细胞培养及转染HepG2、HuH6和L⁃02均培养在DMEM完全培养基中,使用LipofectamineTM3000(InvitrogenTM)转染法转染miR⁃106a mimics或miR⁃106a inhibitors。
1.3 外泌体的提取分离和鉴定HepG2、HuH6和L⁃02细胞系使用无外泌体培养基培养24 h后,收集细胞培养液。依次离心300g(10 min)、3 000g(10 min)、10 000g(30 min)、10 000~20 000g(70 min 2次),分别去除死细胞、细胞碎片等,提取外泌体。
超速离心分离得到的外泌体使用醋酸双氧铀(磷钨酸)处理后,80 kV进行电镜检测成像。使用激光粒度分析仪,设定测试样品的光学参数,采用二次水测定样品背景。背景测定后,加入分散好的样品,控制其浓度在测试范围内,收集数据并对数据。
在外泌体中加入50 μL细胞裂解液,提取外泌体总蛋白,BCA法测定蛋白浓度,Western blot检测CD63、Hsp70和CD9的表达。
1.4 荧光定量PCR(RT⁃qPCR)提取外泌体或细胞的总RNA,按照Mir⁃X miRNA First⁃Strand Syn⁃thesis Kit(Takara)试剂盒说明书进行逆转录合成cDNA。PCR引物序列:miR⁃106a,GAAAAGCTG⁃GGTTGAGAGGA;U6⁃F:CTCGCTTCGGCAGCACA,U6⁃R:AACGCTTCACGAATTTGCGT。检查溶解曲线,采用2-ΔΔCt法计算miR⁃106a的相对表达量。
1.5 Northern blotTrizol法提取肝母细胞瘤细胞系总RNA,将变性后的RNA样品用15%TBE⁃尿素凝胶分离RNA,电泳条件:100 V,120 min;再以30 V,120 min条件将RNA转移至正电荷尼龙膜上。膜上的RNA用紫外线(UV)光交联,用地高辛标记的探针对miR106a或U6snRNA进行37℃孵育过夜。次日用地高辛孵育尼龙膜1 h,以Digwashingbuffer洗膜4次15 min。再37℃孵育CSPD发光液20 min,于全自动化学发光成像分析系统显影。
1.6 双荧光素酶报告基因实验根据miRDB、miR Tar Base、miR Walk和Target Scan在线miRNA靶基预测工具预测的PTEN结合核苷酸序列,设计含有PTEN结合位点的基因片段(WT⁃PTEN)和突变的PTEN核苷酸序列(MUT⁃PTEN),将其克隆至荧光载体psi CHECK2,构建荧光素酶报告基因。将其与miR⁃NC,miR⁃106a共转染至HepG2细胞。最后按照双荧光素酶报告实验试剂盒要求,检测荧光活性并计算结果。
1.7 CCK8实验取对数生长期细胞种板后,按照CCK8试剂盒说明书检测细胞的增殖能力。
1.8 Western blot实验提取细胞总蛋白,BCA法测定蛋白浓度,进行SDS⁃PAGE电泳分离,转膜后封闭,孵育一抗过夜。次日孵育二抗曝光。
1.9 Transwell迁移实验使用Transwell小室,上层种细胞,下层分别加入不同条件培养基,迁移8 h后收取细胞样品。
1.10 划痕实验把细胞均匀接种至六孔板中,用10 μL枪头纵向划3条大小均一的直线划痕,PBS清洗后用10×物镜拍照;加入相对应的药物,每隔24 h更换无血清培养基后拍照,用软件计算划痕愈合情况。
1.11 人肝母细胞瘤裸鼠皮下移植瘤模型的建立将10只5周龄BALB/c⁃nu/nu雌性裸鼠,随机分为PBS与miR⁃106a两组。皮下接种HepG2细胞,在肿瘤结节形成一周时,对照组瘤内注射PBS(2 d/次),实验组注射外泌体miR⁃106a(10 μg/只,2 d/次),连续注射3次,隔天测量皮下肿瘤体积。21 d后,取小鼠肿瘤,测量并拍照。
1.12 Elisa用10%FBS DMEM培养目的细胞72 h,收集上清,离心去除细胞碎片。根据Elisa试剂盒(R&D Systems)说明书指示,定量检测VEGF的表达量。
1.13 肿瘤组织单细胞悬液制备从小鼠的皮下肿瘤组织中制备单细胞悬液。分离皮下肿瘤后30 min内采集组织标本并剪碎,用50 μL DNaseI(10 mg/mL,1∶100)和50 μL胶原酶Ⅱ(200 mg/mL,1∶100)在37℃下孵育20 min,组织研磨后用PBS重悬并用70 μm细胞滤网过滤,获得组织滤液。将组织滤液500g离心10 min,PBS重悬获得单细胞悬液。
1.14 流式细胞术单细胞悬液用50 μL Stain buffer(BD)重悬,加入CD45(BD)、Gr⁃1(BD)、CD11b(BD)抗体染色20 min,用1 mL Stain buffer中止染色,500g离心5 min后用1%多聚甲醛固定,在流式细胞分析仪(BD FACS LSR Fortessa TM)分析数据。
1.15 统计学方法数据处理使用SPSS 23.0进行统计学分析,使用Graph Pad Prism 9.0进行绘图。两组间数据的比较采用双尾独立样本t检验。本文实验结果所有数值均以三次独立实验数据的均数±标准差表示。P<0.05表示差异有统计学意义。
2 结果
2.1 miR⁃106a在肝母细胞瘤中高表达qRT⁃PCR结果显示,与正常肝细胞系(L⁃02)相比,HB细胞系(HepG2、Huh6)中miR106a表达明显升高(P<0.001,图1A)。Northern blot结果与qRT⁃PCR一致(图1B)。
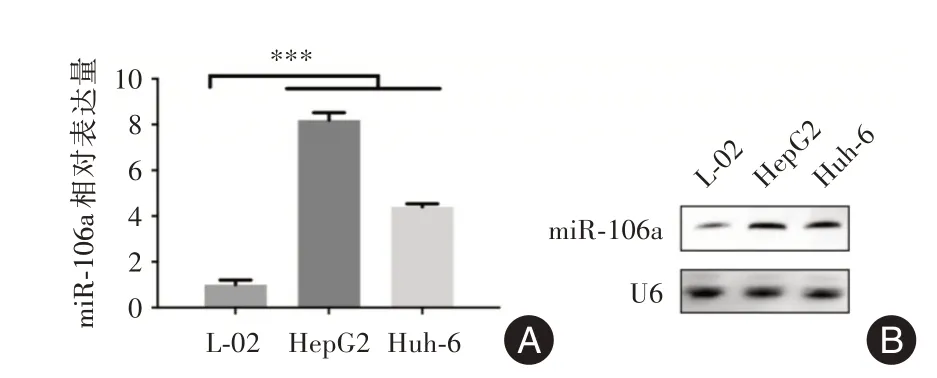
图1 miR⁃106a在肝母细胞系中的表达Fig.1 Expression of miR⁃106a in HB cell lines
2.2 HB细胞系来源外泌体中miR⁃106a的表达情况电镜下观察HepG2培养上清中提取外泌体的形态为椭圆形,茶托状,具有完整的双层脂质膜包被(图2A)。粒径分析表明外泌体的直径在30~150 nm之间(图2B)。Western blot检测表明,外泌体标志蛋白CD63、Hsp70和CD9阳性表达(图2C)。随后,qRT⁃PCR检测了HepG2、HuH6与L⁃02外泌体的miR⁃106a表达,结果显示,HepG2、HuH6细胞外泌体的miR⁃106a表达显著上调(P<0.001,图2D)。
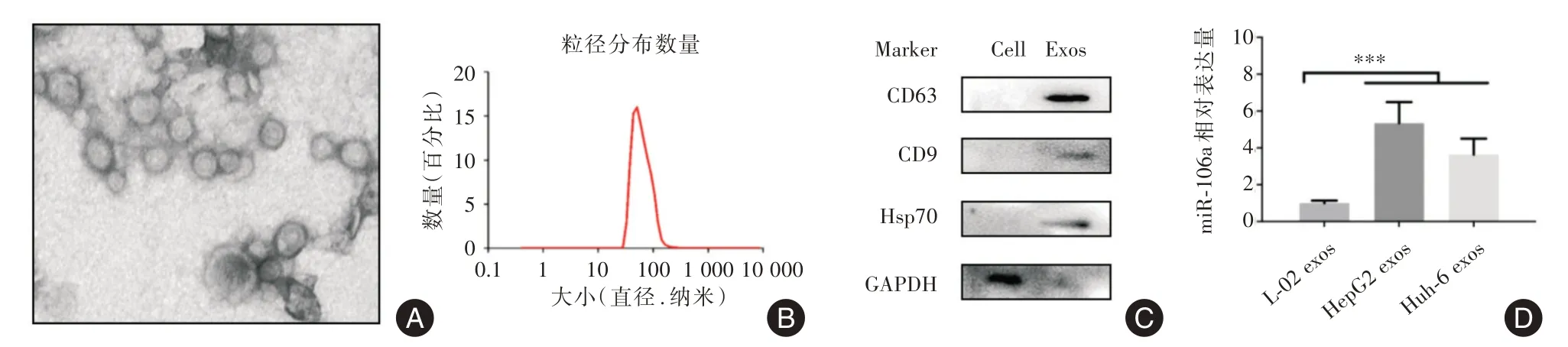
图2 外泌体的分离和鉴定Fig.2 Isolation and identification of exosomes
2.3 外泌体miR⁃106a促进肝母细胞瘤细胞的增殖和迁移在HepG2细胞中分别转染HepG2⁃Exos、miR⁃106a mimics、miR⁃106a inhibitors和HepG2⁃Exos+miR⁃106a inhibitors。CCK8与Transwell实验表明,与对照组相比,HepG2⁃Exos、miR⁃106a mim⁃ics组细胞增殖与迁移能力显著增强,而miR⁃106a inhibitors组细胞增殖与迁移能力明显减弱。此外,共转染HepG2⁃Exos和miR⁃106a inhibitors能够逆转miR⁃106a inhibitors对HepG2细胞增殖和迁移的抑制效果(P<0.01,图3A⁃B)。
同时,细胞划痕实验和Transwell实验结果趋势一致,共同表明了HB细胞系来源外泌体miR⁃106a能够提高HB细胞的迁移能力(图3C)。
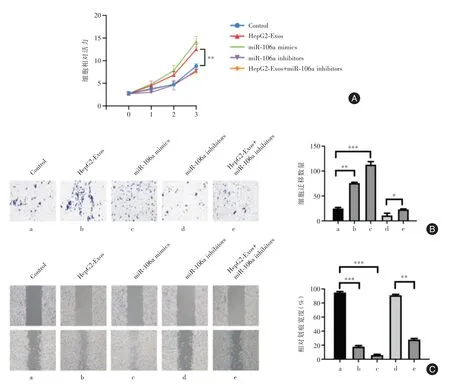
图3 外泌体miR⁃106a对肝母细胞瘤细胞增殖和迁移的影响Fig.3 Effects of exosome miR⁃106a on proliferation and migration of hepatoblastoma cells
2.4 外泌体miR⁃106a靶向PTEN激活AKT信号通路,上调VEGF的分泌生信分析预测miR⁃106a能靶向PTEN mRNA的3'UTR区(图4A)。双荧光素酶报告基因验证实验结果显示,miR⁃106a可显著抑制野生型PTEN(WT⁃PTEN)组的荧光素酶活性(P<0.001),而对突变型PTEN(MT⁃PTEN)组无影响(图4B⁃C)。Western blot结果显示,与NC⁃Exos对照组相比,转染miR⁃106a组PTEN蛋白表达明显下调,而转染miR⁃106a inhibitors组PTEN蛋白表达明显上调(图4D)。
Western blot检测PTEN、磷酸化AKT(p⁃AKT)和AKT的表达。结果表明,与NC⁃Exos对照组相比,miR⁃106a mimics或miR⁃106a⁃exos处理的HepG2细胞中,PTEN水平显著降低,p⁃AKT水平升高(图4D)。Elisa结果表明,与Control组相比,miR⁃106a mimics或miR⁃106a⁃exos处理的HepG2细胞VEGF的分泌水平显著升高(P<0.001),抑制miR⁃106a后,VEGF的分泌显著下降(P<0.01,图4E)。以上结果提示,HB细胞系来源的外泌体miR⁃106a通过调控PTEN⁃AKT信号通路促进HepG2细胞分泌VEGF。

图4 miR⁃106a靶基因的预测和鉴定Fig.4 Prediction and identification of miR⁃106a target gene
2.5 外泌体miR⁃106促进MDSC的募集,促进肿瘤生长为了在体内证实miR⁃106a对于肝母细胞瘤生长的作用。本研究通过裸鼠皮下成瘤实验发现,miR⁃106a组肿瘤负荷显著高于对照组(P<0.001,图5A⁃B)。Western blot结果显示,与对照组相比,miR⁃106a组PTEN水平显著降低,p⁃AKT水平显著升高(图5C)。同时,RT⁃qPCR结果显示miR⁃106a组显著上调了VEGF的表达(P<0.001,图5D)。流式细胞术结果显示,外泌体miR⁃106a组MDSC显著增多(P<0.001,图5E⁃F)。综上,miR⁃106a可以促进p⁃AKT的活化,并上调VEGF的表达,募集MDSC进入肿瘤,促进肿瘤生长。
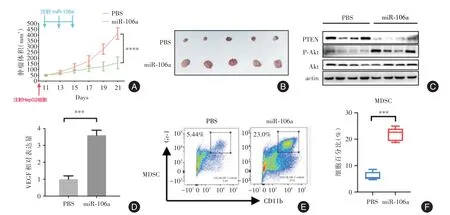
图5 miR⁃106a重塑免疫微环境并促进肿瘤生长Fig.5 miR⁃106a reshapes the immune microenvironment and promotes tumor growth
3 讨论
肝母细胞瘤是一种起源于肝母细胞的儿童恶性肿瘤,过去的几十年中,肝母细胞瘤的发生率以每年2.7%的速率增长[15]。尽管外科手术和化疗方案的联合提高了一部分患者的生存率,但是仍有25%的患者发生转移[16]。因此,急需探索新的有效的HB治疗靶点。
微小RNA(miRNA)是小的非编码RNA,其通过抑制靶mRNA翻译起作用[17]。最近有研究表明,高水平的miRNA和外泌体miRNA已经表现出对多种肿瘤类型的免疫调节、化疗耐药和转移[18-19]。然而,在HB肿瘤中,肿瘤来源的外泌体miRNA与转移之间的相关性还不清楚。miR⁃106a已被证实参与多种肿瘤的发生发展,影响肿瘤细胞的增殖和迁移[20-22]。该研究通过qRT⁃PCR和Northern blot证明miR⁃106a在HB细胞及其外泌体中高表达,并发现HB细胞来源外泌体miR⁃106a促进了HB细胞的增殖和迁移。此外,本研究通过生物信息学分析预测了miR⁃106a和PTEN3'⁃UTR的靶向组合,并进一步通过双荧光素酶报告基因检测证实PTEN是miR⁃106a的直接靶点。PTEN是一个具有双重特性磷酸酶活性的肿瘤抑制基因[23],在多种肿瘤中都发现PTEN的突变与缺失[24-26]。本研究发现,HB中PTEN的缺失导致了AKT信号通路的过度活化,AKT信号通路的活化会通过影响细胞周期促进细胞的增殖[27]。本研究中,PTEN的缺失上调了VEGF的表达,VEGF的上调被证实会促进肿瘤细胞的转移[28]。以上结果提示,在HB中,外泌体miR⁃106a通过下调PTEN,活化AKT信号通路,促进VEGF的分泌,增强肿瘤细胞的增殖与转移能力。鉴于此,肿瘤来源外泌体中的miR⁃106a可能会成为肝母细胞瘤的新的治疗靶点。
作为功能强大的抑癌基因,PTEN也参与了肿瘤微环境的形成。研究表明[29],多种免疫信号传递通路,例如IL⁃2、IL⁃6、IL⁃10等也受到PTEN的调控。HAND等报道[30],PTEN的缺失会抑制CD8+T细胞的发育和存活,同时抑制白介素⁃7(IL⁃7)和白介素⁃15(IL⁃15)受体表达。PENG等[31]发现,PTEN缺失会显著降低肿瘤中CD8+T细胞的数量和活性,也促进了肿瘤对T细胞诱导的凋亡的抵抗。然而,目前尚未有研究报道miR⁃106a通过PTEN影响HB免疫微环境的机制。本研究证实,miR⁃106a通过抑制PTEN,活化p⁃AKT,活化的AKT信号通路可以通过HIF⁃1α促进VEGF及其他血管生成因子的表达和分泌[32],本研究证实p⁃AKT的活化促进了VEGF的分泌(图4E、图5D)。VEGF在血管生成中的作用已经被充分证实[33]。此外,VEGF还可以通过募集抑制性免疫细胞,如未成熟树突细胞、MDSCs和调节性T细胞[34]来形成抑制性免疫微环境。该研究证实,miR⁃106a抑制了PTEN表达,活化p⁃AKT,上调VEGF的表达,从而增加MDSCs的募集。MDSCs作为一种未成熟的髓源性免疫抑制细胞,可以通过上调iNOS和Arg⁃1的活性消耗体内环境中的L⁃精氨酸,使T细胞的生成受阻[35],或通过产生活性氧(reactive oxygen species,ROS)来抑制T细胞免疫应答反应[36],促进舌鳞状细胞癌进展[37]。
研究显示,miR⁃106a通过上调VEGF募集MDSCs进入肿瘤,肿瘤中富集的MDSCs可能会通过产生ROS或消耗L⁃精氨酸抑制T细胞对肿瘤的杀伤的功能,进而增加肿瘤负荷。
综上,本研究首次证实了HB细胞及其外泌体中高表达miR⁃106a,外泌体中的miR⁃106a通过影响周围肿瘤细胞PTEN/AKT/VEGF信号通路促进肿瘤的增殖和转移;此外,miR⁃106a通过PTEN⁃AKT信号通路上调VEGF的表达,募集MDSCs进入肿瘤,形成抑制性免疫微环境,促进肿瘤生长。因此,HB来源的miR⁃106a可以作为一种新的致癌因子,为肝母细胞瘤的诊断和治疗提供了新的见解。然而,在本文中尚未证实miR⁃106a在HB细胞及其外泌体中高表达的机制,有待下一步的探索。
——外泌体与老年慢性疾病相关性的研究进展

