毛蕊异黄酮对H2O2诱导的氧化损伤的星形胶质细胞增殖和凋亡的影响
许洋 吴成林 郭德华 张国福
1江西中医药大学研究生院(南昌 330004);2江西中医药大学附属医院创伤骨伤科(南昌 330006)
脊髓损伤(spinal cord injury,SCI)是指由于外伤或病理因素引起脊髓结构与功能损害的神经系统疾病[1],通常导致感觉和运动功能障碍,严重者甚至瘫痪,其致残率高,对患者的身心健康造成巨大伤害,并给家庭及社会带来严重经济负担。尽管传统的手术及药物治疗能一定程度上改善病情,但仍无法完全恢复脊髓功能,面对如此困境,寻求新的恢复脊髓功能的治疗手段仍是当代医疗的重大课题。
SCI分为原发性SCI和继发性SCI,其中细胞凋亡、氧化损伤和炎症反应等是导致继发性SCI的主要因素,其损伤程度远超原发性损伤[2-3]。研究发现,星形胶质细胞是中枢神经系统最丰富的神经胶质细胞之一,与脊髓神经功能恢复的关系密切[4-5]。毛蕊异黄酮(Calycosin)是一种异黄酮植物雌激素,是从中药黄芪中提取的有效活性成分之一[6],具有抗氧化、抗炎症以及抗肿瘤等作用[7],并且毛蕊异黄酮可以通过促进NF⁃κB通路介导的抗氧化途径对脑损伤发挥神经保护作用[8]。据报道[9-10],PI3K/Akt信号通路在SCI后脊髓功能恢复中起重要作用,并参与炎症反应、神经胶质瘢痕形成、细胞增殖和凋亡。而目前毛蕊异黄酮对星形胶质细胞的影响及作用机制尚未明确,有待进一步研究。笔者猜想毛蕊异黄酮可以通过PI3K/Akt信号通路对星形胶质细胞产生影响,故本研究将基于该通路探讨毛蕊异黄酮苷对氧化损伤的星形胶质细胞增殖和凋亡的影响,并进一步阐明其可能作用机制,进而为治疗脊髓损伤提供新的思路。
1 材料与方法
1.1 动物SPF级新生24 h雌性SD乳鼠10只,购自湖南斯莱克景达实验动物有限公司,饲养于江西中医药大学实验动物科技中心,饲养于洁净环境中。实验过程中对动物的处理严格依照国家对医学实验动物的相关要求进行。
1.2 细胞及培养将SD乳鼠,用75%的酒精泡3 min左右,将其俯卧于无菌操作台中,剪开其背部皮肤,钝性分离背部肌肉,分离脊柱剖开椎管取脊髓,体视镜下去除包膜,剪碎组织,在0.25%胰蛋白酶中37℃中消化10~15 min左右后用完全培养基终止消化。用吸管轻柔吹散,过滤网,1 000 r/min离心5 min收集细胞,接种培养至培养瓶中,置于37℃,5%CO2培养箱中培养40 min后轻摇培养瓶,去除贴壁的成纤维收集未贴壁的细胞上液,1 000 r/min离心5 min收集细胞加入完全培养基培养。
1.3 主要试剂与仪器毛蕊异黄酮(上海基屹生物科技有限公司);PBS、CCK⁃8法细胞增殖检测试剂盒(江苏凯基生物技术股份有限公司);Rabbit Anti IL⁃6(北京博奥森生物技术有限公司);辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);Rabbit Anti p⁃AKT、Rabbit Anti gp130(安诺伦生物科技有限公司);超高灵敏度化学发光成像系统(伯乐生命医学产品上海有限公司);全自动样品快速研磨仪(上海净信实业发展有限公司);旋涡混合器(常州越新仪器制造有限公司);全自动酶标(北京六一生物科技);流式细胞仪(艾森生物杭州有限公司)。
1.4 毛蕊异黄酮浓度的筛选用不同浓度的毛蕊异黄酮(5、10、20 μmol/L)预处理星形胶质细胞12 h,然后用100 μmol/L的H2O2处理24 h造成氧化损伤。用CCK8检测各组细胞增殖情况筛选合适的毛蕊异黄酮处理浓度。
1.5 实验分组及给药将实验分为对照组、H2O2(100 μmol/L)模型组、H2O2(100 μmol/L)+毛蕊异黄酮(20 μmol/L)干预组,按照实验分组先用毛蕊异黄酮预处理24 h后进行造模处理24 h,之后加抑制剂处理24 h后进行CCK8检测。
1.6 CCK8检测将造模后的细胞换成新鲜培养基,每孔100 μL,每孔加入10 μL的CCK8试剂,置于培养箱中孵育2 h,酶标仪在450 nm波长处检测每孔的吸光值。
1.7 免疫荧光检测在培养板中将已爬好细胞的培养皿用PBS浸洗3次,每次3 min;用4%的多聚甲醛固定15 min,PBS浸洗培养皿3次,每次3 min;0.5%Triton X⁃100(PBS配制)室温通透20 min。PBS浸洗培养皿3次,每次5 min,移液枪吸干PBS,在培养皿内滴加5% BSA,37℃封闭30 min。移液枪吸掉封闭液,不洗,培养皿内滴加足够量的稀释好的一抗Brdu(1∶200),37℃孵育3 h。PBS浸洗培养皿3次,每次3 min,移液枪吸干培养皿内多余液体后滴加稀释好的荧光二抗Cy3(1∶200),37℃孵育45 min,PBS浸洗培养皿3次,每次3 min;注意:从加荧光二抗起,后面所有操作步骤都尽量在较暗处进行。滴加DAPI避光孵育5 min,对标本进行染核,用PBS冲洗多余的DAPI;用50%甘油封闭培养皿,然后在荧光显微镜下观察采集图像。
1.8 流式细胞检测细胞凋亡情况收集1×106~3×106个细胞,加1 mL PBS 1 500 r/min离心3 min,洗两遍,用双蒸水将5×Binding Buffer稀释为1×Binding Buffer,取300 μL预冷的1×Binding Buffer重悬细胞。每管各加入3 μL Annexin V⁃FITC和5 μL PI⁃PE。轻微混匀后,室温避光孵育10 min。再向每管中加入200 μL预冷的1×Binding Buffer。混匀后上流式细胞仪检测细胞凋亡。
1.9 Western blot法检测相关蛋白表达取各组样本获取总蛋白,根据BCA试剂盒测定蛋白浓度。蛋白变性,上样,进行十二烷基苯磺酸钠凝胶电泳1~2 h,后湿法转膜30~50 min。一抗溶液孵育,4℃过夜;二抗溶液中室温孵育1~2 h。用ECL液显色,Image J软件观察条带灰度值并计算蛋白表达。
1.10 统计学方法采用SPSS 26.0软件进行统计学分析。所有实验均重复3次以上,计量资料用()表示,两组间比较采用独立样本t检验,多组之间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 毛蕊异黄酮浓度的筛选H2O2显著降低了细胞的增殖活力,在不同浓度毛蕊异黄酮干预下,各组星形胶质细胞的增殖活力均增强,毛蕊异黄酮浓度在20 μmol/L时,星形胶质细胞的增殖活力显著增强(P<0.05),故选择20 μmol/L继续后续实验。见图1。
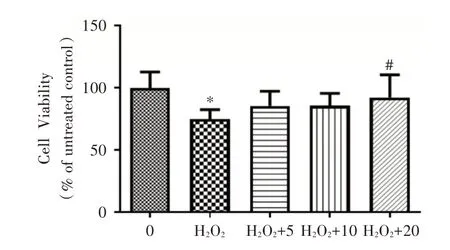
图1 不同浓度的毛蕊异黄酮对星形胶质细胞增殖的影响Fig.1 Effects of different concentrations of Calycosin on astrocytes proliferation
2.2 毛蕊异黄酮对氧化损伤的星形胶质细胞增殖的影响和对照组相比,在H2O2诱导星形胶质细胞氧化损伤24h后,星形胶质细胞的增殖活力明显下降(P<0.05),而毛蕊异黄酮能显著增强星形胶质细胞的增殖活力(P<0.05)。见图2。
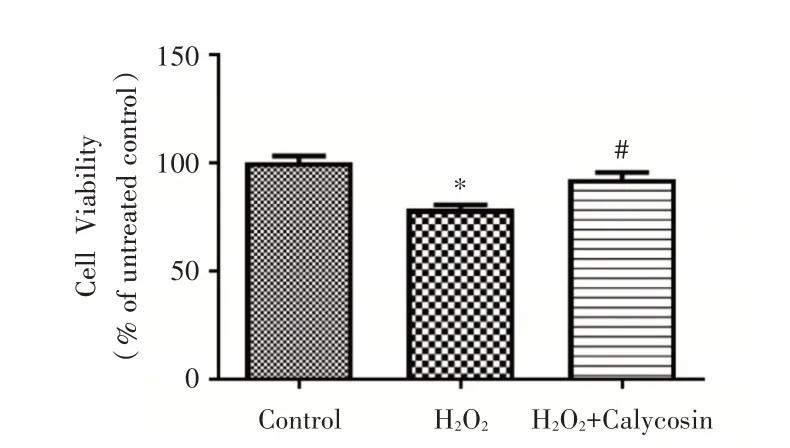
图2 毛蕊异黄酮对星形胶质细胞增殖的影响Fig.2 Effect of Calycosin on proliferation of astrocytes
Brdu免疫荧光结果显示,与对照组相比,H2O2抑制了星形胶质细胞的增殖(P<0.05),而毛蕊异黄酮能明显增强星形胶质细胞增殖。见图3。

图3 Brdu免疫荧光检测结果Fig.3 BrdU immunofluorescence test results
2.3 毛蕊异黄酮对氧化损伤的星形胶质细胞凋亡的影响与对照组相比,H2O2组星形胶质细胞凋亡率显著上升,与H2O2组相比,毛蕊异黄酮组的星形胶质细胞凋亡率显著降低(P<0.05),明显抑制了星形胶质细胞凋亡。见图4。
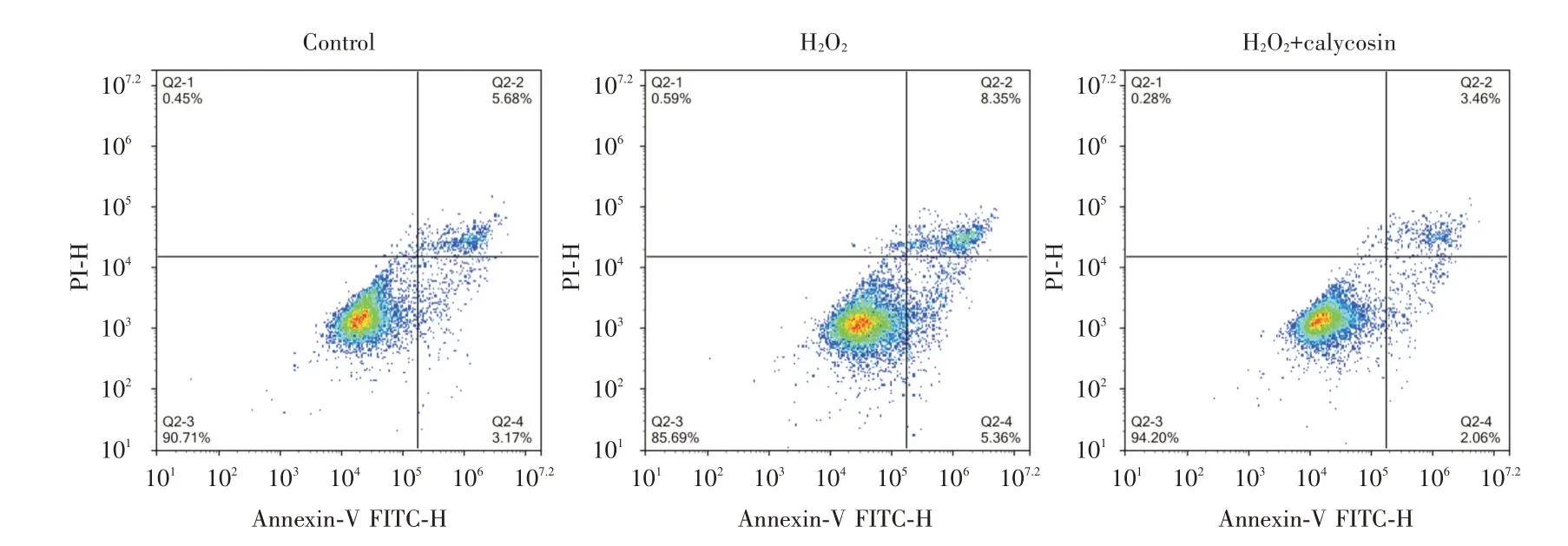
图4 流式细胞术星形胶质细胞的凋亡率Fig.4 Apoptosis rate of astrocytes by flow cytometry
2.4 毛蕊异黄酮对PI3K/Akt信号通路相关蛋白的影响与对照组相比,H2O2组的GP130、IL⁃6、p⁃AKT的蛋白表达水平显著增加(P<0.05),与H2O2组相比,毛蕊异黄酮能显著抑制GP130、IL⁃6、p⁃AKT蛋白表达(P<0.05)。见表1及图5。
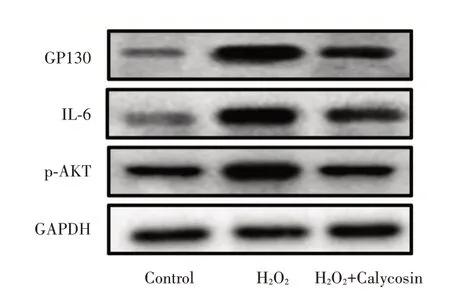
图5 毛蕊异黄酮对星形胶质细胞的p⁃AKT、GP130、IL⁃6蛋白表达水平的影响Fig.5 Effects of Calycosin on the expression levels of p⁃Akt,gp130 and IL⁃6 proteins in astrocytes
表1 各组GP130、IL⁃6、p⁃AKT蛋白表达Tab.1 Expression of GP130,IL⁃6,p⁃AKT protein in each group ±s
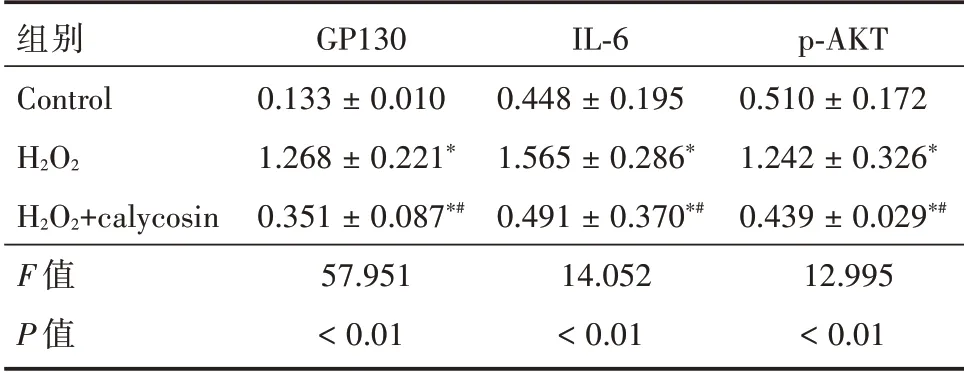
表1 各组GP130、IL⁃6、p⁃AKT蛋白表达Tab.1 Expression of GP130,IL⁃6,p⁃AKT protein in each group ±s
注:*P<0.05,与Control组相比;#P<0.05,与H2O2组相比
组别Control H2O2 H2O2+calycosin F值P值GP130 0.133±0.010 1.268±0.221*0.351±0.087*#57.951<0.01 IL⁃6 0.448±0.195 1.565±0.286*0.491±0.370*#14.052<0.01 p⁃AKT 0.510±0.172 1.242±0.326*0.439±0.029*#12.995<0.01
3 讨论
在脊髓损伤发生后,会产生一系列复杂的病理学反应,对脊髓造成进一步的继发性损伤。尽管SCI的病因和发病机制仍有待充分了解,但多项研究证实神经星形胶质细胞在SCI的病理生理学中具有重要作用[11-13],减轻星形胶质细胞的氧化损伤是干预脊髓功能恢复的有效策略[14]。毛蕊异黄酮作为中药黄芪中提取的有效活性成分之一,其抗氧化、抗炎和对神经的保护作用显著。但目前仍缺乏毛蕊异黄酮对星形胶质细胞的作用及影响的研究,需要进行更多的研究佐证。因此,本实验通过毛蕊异黄酮对氧化损伤的星形胶质细胞的干预,分析其对星形胶质细胞增殖和凋亡的影响,并探究其可能机制,为脊髓功能恢复寻求新的治疗手段。
氧化应激是由过氧化氢(H2O2)等活性氧(ROS)的积累引起的[15],与SCI、脑缺血和神经退行性疾病等多种神经系统疾病的病因有关[16-17],前期研究发现,氧化应激会诱导星形胶质细胞凋亡,且实验中常用H2O2诱导星形胶质细胞氧化损伤建立模型[18-20]。本实验研究先通过不同浓度毛蕊异黄酮对星形胶质细胞干预,再使用H2O2诱导星形胶质细胞造成氧化损伤,结果发现H2O2降低了细胞的增殖活力,20 μmol/L的毛蕊异黄酮浓度显著增强了细胞的增殖活力(P<0.05),故选用该浓度进行后续研究。流式细胞术结果显示H2O2使星形胶质细胞凋亡率升高,而毛蕊异黄酮显著抑制了星形胶质细胞凋亡,初步证明毛蕊异黄酮对氧化损伤的星形胶质细胞具有保护作用,可以增强其增殖活力并抑制凋亡。
在星形胶质细胞凋亡和增殖的机制研究中,PI3K/Akt信号通路一直是该研究的热点。日本路边青可以通过BDNF/PI3K/Akt/CREB途径促进星形胶质细胞增殖,并抑制凋亡[21];而Annexin⁃A1却通过PI3K/AKT信号通路抑制了神经胶质细胞和胶质瘤细胞的增殖和迁移[22],这表明PI3K/AKT信号通路在星形胶质细胞凋亡和增殖机制中起重要作用。另一方面,研究证实毛蕊异黄酮可以通过PI3K/AKT信号通路对细胞炎症、凋亡与增殖产生作用[23-24]。在ZEGEYE等[25]的报道中证实IL⁃6可以激活PI3K/AKT信号通路,IL⁃6的主要β受体是GP130,其在星形胶质细胞中也有表达,并且PI3K/AKT信号通路正是位于IL⁃6细胞因子共用信号传导亚单位GP130下游的信号通路[26]。当细胞损伤后,PI3K/Akt信号通路会被异常激活,其表达迅速升高,可磷酸化磷脂酰肌醇,生成磷酸化PI3K(p⁃PI3K),在p⁃PI3K的作用下又可引起AKT磷酸化,形成磷酸化AKT(p⁃AKT)。因此,磷酸化AKT(p⁃AKT)可作为衡量PI3K活性的指标。本研究结果显示:氧化损伤的星形胶质细胞GP130、IL⁃6、p⁃AKT等蛋白表达显著高于正常星形胶质细胞(P<0.05);而毛蕊异黄酮能显著下调H2O2诱导氧化损伤后GP130、IL⁃6、p⁃AKT蛋白的表达(P<0.05)。以上结果表明毛蕊异黄酮能有效抑制炎症反应,促进H2O2诱导的氧化损伤的星形胶质细胞增殖并抑制其凋亡,其作用机制与抑制PI3K/Akt信号通路磷酸化有关。
综上所述,毛蕊异黄酮可以通过抑制PI3K/Akt信号通路磷酸化促进氧化损伤的星形胶质细胞的增殖,并抑制其凋亡。本研究丰富了中药(毛蕊异黄酮)对星形胶质细胞作用的研究,有一定参考意义。但在细胞凋亡与增殖过程中可能涉及到多条信号通路的参与,本实验中仅设计PI3K/Akt一条信号通路的研究,存在一定局限性,未来应对其他相关信号通路进行研究,不断完善星形胶质细胞具体机制的研究,为治疗脊髓损伤提供新的临床研究依据。

