基质细胞衍生因子⁃1α/趋化因子CXC受体4诱导内皮祖细胞血管新生促进脑卒中的神经康复机制
郭丹 张娟 王洪涛 刘行高 郭远瑾
1华中科技大学协和东西湖医院(武汉市东西湖区人民医院)康复医学科(武汉 430040);2华中科技大学同济医学院附属协和医院神经内科(武汉 430022)
缺血性脑卒中作为世界上主要的致死性疾病之一,其发病率、死亡率、致残率和复发率都很高[1]。最近研究发现,尽管大鼠缺血模型急性期存在短暂的血管生成,但严重的内皮细胞和基底膜损伤可能是恢复期血管生成的主要有害影响,提示神经血管小生境修复是缺血诱导的卒中的一种策略[2]。内皮祖细胞(endothelial progenitor cells,EPCs)是从骨髓中动员出来的不成熟的内皮细胞,其在维持内皮完整性和内环境稳定方面发挥着重要作用,有利于损伤血管的再内皮化以及缺血组织的血运重建[3]。研究表明,EPCs通过旁分泌或细胞效应在大脑中促进血管生成和神经修复[4]。最近一项蛋白组学研究在长期脑低灌注小鼠模型EPCs分泌组中鉴定了38种蛋白质参与神经血管小生境修复,其中基质细胞衍生因子⁃1α(stromal cell⁃derived factor⁃1α,SDF⁃1α)具有强信号[信号强度=(159±56.7)][5]。SDF⁃1α是中枢神经系统中的一个关键调节因子,其通过与受体(CXCRs,如CXCR4或CXCR7)结合在血管生成、炎症和病理性疼痛中发挥关键作用[6]。研究证明,SDF⁃1α参与协调神经祖细胞的迁移、增殖和分化[7]。因此,本研究假设缺血性脑卒中后EPCs在受损区域积聚并通过SDF⁃1α/CXCR4或CXCR7轴介导神经血管生成,并采用体外共培养系统和体内缺血缺氧诱导的卒中大鼠模型验证上述假设。
1 材料与方法
1.1 EPCs制备从本院提供的脐血中分离人EPCs。具体操作为:取新鲜脐血与0.01 mol/L磷酸盐缓冲盐水(PBS)混合。将混合物小心均匀地倒入淋巴细胞分离培养液(美国Corning公司)上。在1 800×g下离心30 min,仔细提取血浆和分离溶液之间的界面(白色层),并在PBS中以600×g离心10 min。将颗粒重新悬浮并倾倒在分离培养液上,在1 200×g下离心30 min。提取中间相并用EGM2内皮细胞培养液(瑞士LONZA公司)重新悬浮颗粒,将细胞置于25 cm2培养瓶中。
1.2 hBMECs处理人脑微血管内皮细胞(HB⁃MECs)购自美国Sciencell公司,并在EGM2内皮细胞培养液中培养。为探讨氧糖剥夺(oxygen⁃glu⁃cose deprivation,OGD)对HBMECs的影响,将细胞分为对照组、OGD 3 h组、OGD 6 h组和OGD 9 h组。当HBMECs在培养皿中60%~70%融合时,用无糖DMEM代替EGM2内皮细胞培养液,在含5%O2和95%N2的培养箱中缺氧0、3、6、9 h。
1.3 缺氧HBMECs条件培养液制备收集HBMECs暴露于OGD 6 h组的培养液,使用带有10 kDa分子量截留膜的AmiconUltra⁃15离心过滤器(美国Millipore公司)将培养液离心(4 000×g,15 min)浓缩20倍,然后将培养液通过0.22 mm过滤器(Milli⁃pore),并在-80℃下储存。
1.4 检测EPCs对HBMECs的影响
1.4.1 细胞凋亡检测将HBMECs分为三组:正常对照组,OGD⁃HBMECs组(HBMECs暴露于OGD 6 h)和EPCs+OGD⁃HBMECs组(HBMECs暴露于OGD 6 h,然后与EPCs共培养24 h)。用流式细胞术检测HBMECs凋亡。消化细胞并在1 000×g下离心5 min。用300 mL结合缓冲液重新悬浮颗粒,然后用5 μL膜联蛋白V⁃PE和5 μL 7⁃AAD(美国BD pharmingen公司)孵育15 min。通过FACS⁃Can⁃to⁃II流式细胞术(美国Becton⁃Dickinson公司)和FlowJo软件分析细胞凋亡。
1.4.2 血管生成实验将EPCs接种到Transwell室中,然后将其插入24孔板中。HBMECs暴露于OGD 6 h后,将反应室移至OGD⁃HBMECs生长的平板上。将OGD⁃HBMECs和EPCs在37℃和5%CO2的环境中共培养24 h,然后将HBMECs消化并接种到Matrigel包被的24孔板Transwell小室(美国Corning公司)中。用显微镜(日本Olympus公司)观察血管的形成。
1.5 酶联免疫吸附试验(ELISA)将内皮细胞分为正常对照组(Ctrl⁃HBMECs)、OGD 6 h组(OGD⁃HBMECs)、OGD⁃HBMECs与EPCs共培养组(OGD⁃HBMECs+EPCs),和正常内皮细胞与EPCs共培养组(Ctrl⁃HBMECs+EPCs)。收集培养液并通过ELI⁃SA试剂盒(美国R&D Systems公司)测量SDF⁃1α的浓度。
为了进一步研究OGD⁃HBMECs是否影响EPCs分泌SDF⁃1α,用SDF⁃1α shRNA慢病毒(sh⁃SDF⁃1α)或对照(sh⁃NC)(美国Santa Cruz公司)感染EPCs 48 h,然后与OGD⁃HBMECs共培养24 h,收集培养液,检测SDF⁃1α水平。
为了进一步研究CXCR4和CXCR7是否参与OGD⁃HBMECs凋亡,使用Lipofectamine 3000(美国Invitrogen公司)将OGD⁃HBMECs转染CXCR4或CXCR7小干扰RNA(siRNA)(美国Santa Cruz Bio⁃technology公司)6 h。与EPCs再孵育24 h后,收集细胞进行凋亡分析。
1.6 Western blot细胞用RIPA裂解缓冲液裂解,并通过BCA法测定蛋白质浓度。用8%~10%十二烷基硫酸聚丙烯酰胺凝胶电泳分离蛋白裂解液,并转移到硝化纤维素滤膜上。将膜与5%脱脂奶粉缓冲液孵育1 h,然后与小鼠抗CXCR4(1∶200,美国Santa Cruz公司)和小鼠抗CXCR7(1∶1 000,美国Abcam公司)一级抗体在4℃孵育过夜。在室温下将膜与山羊抗兔或山羊抗鼠二级抗体(1∶5 000,美国LI⁃COR公司)在摇床中孵育2 h。最后,采用ECL底物试剂盒(美国Abcam公司)检测信号,并用Image J软件进行定量分析。
1.7 大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型建立及治疗成年雄性Sprague⁃Dawley大鼠(年龄10~12周,体质量250~300 g,购自北京维通利华实验动物技术有限公司[合格证编号:SCXK(京)2016⁃0006])用于本实验。参照文献方法建立MCAO模型[8],具体操作为:大鼠通过腹腔注射戊巴比妥(100 mg/kg)诱导麻醉。采用颈部正中切口,钝性分离右侧颈总动脉、颈外动脉和颈内动脉。从左侧颈外动脉向大脑中动脉插入硅胶包裹的尼龙栓线,插入深度约为20 mm。通过使用Moor LAB激光多普勒流量计(英国Moor Instruments公司)检测表面脑血流,证实了手术的成功。缝合线插入后2 h,再次麻醉大鼠,取出缝合线进行再灌注。在整个造模过程中,有8只大鼠死亡,38只大鼠成功建立MCAO模型,并随机分为:MCAO模型组(n=9)、MCAO+EPCs组(n=10)、MCAO+缺氧内皮细胞条件培养液预处理EPCs(HBMECs⁃pEPCs)组(n=10)、MCAO+HBMECs⁃pEPCs+AMD3100(CXCR4拮抗剂)组(n=9)。假手术组除不插入尼龙栓线外,其余步骤同MCAO组。在MCAO后2 h,一次性向MCAO+EPCs组经尾静脉注射EPCs(3.0×106细胞/300 μL PBS),MCAO+HBMECs⁃pEPCs组和MCAO+HB⁃MECs⁃pEPCs+AMD3100组经尾静脉注射HBMECs⁃pEPCs(3.0×106细胞/300 μL PBS)。模型组和假手术组在注射等体积的PBS。此外,MCAO+HB⁃MECs⁃pEPCs+AMD3100组每天腹腔注射AMD 3100(5 μg/kg体质量,10 μg/mL,美国Selleck公司)1次,共2周。
1.8 Morris水迷宫试验治疗后第六周进行Morris水迷宫试验(每组n=8)。实验装置由一个圆形水箱(直径100 cm,高35 cm)组成,水箱中的水深度为15.5 cm,温度为(23±1)℃,通过添加黑色无毒碳墨水使其不透明。在水面以下1 cm处设置一个逃逸平台(直径4.5 cm,高度14.5 cm)被淹没,并放置在一个象限的中点。每只大鼠每天接受4次训练,连续4 d。在第5天,通过移除平台并让每只大鼠自由游泳60 s来执行空间搜索测试。分别测量大鼠在目标象限(隐藏平台训练期间平台所在的位置)和三个非目标象限(右象限、左象限和对侧象限)游泳的时间。对于空间搜索试验,还测量和计算了每只大鼠穿过平台部位的次数。
1.9 免疫荧光染色治疗后第7周,依次用PBS和4%冷多聚甲醛心内灌注大鼠(每组4只)。取大脑组织在4%多聚甲醛中固定6 h,然后在4℃的30%蔗糖缓冲液中孵育48 h,然后进行冷冻切片。连续的冠状切片以5 μm的间隔从Bregma前后轴-2.0 mm到-7.0 mm切割,以收集整个受损皮层。用10%山羊血清和/或0.3%Triton X⁃100在0.01 mol/L PBS中在37℃下封闭脑切片40 min,然后与Claudin⁃5(1∶1 000,兔IgG,美国Sigma公司),CD133(1∶100,兔IgG,美国Abcam公司),CD31(1∶100,兔IgG,美国Abcam公司),和vWF(1∶200,小鼠IgG,美国Abcam公司)一级抗体孵育4 h。将切片与山羊抗小鼠IgG(H+L)Alexa⁃Fluor®488或555结合物(美国Invitrogen公司)二级抗体孵育1 h。最后,将切片与DAPI孵育10 min后在显微镜下观察结果。
1.10 统计学方法所有数据均表示为均值±标准差。使用SPSS 21.0软件进行统计分析。组间差异采用单因素方差分析(ANOVA)和SNK方差齐性检验或Dunnett后验平方差检验进行评价,P<0.05差异有统计学意义。
2 结果
2.1 EPCs对HBMECs生物活性的影响与OGD 3 h相比,OGD 6 h或9 h的HBMECs凋亡率显著升高(P<0.05),但OGD 6 h和9 h之间没有显著差异(图1A)。因此,选择OGD 6 h进行以下实验。与OGD组相比,EPCs处理导致HBMECs凋亡率显著降低(P<0.05、图1B)和血管环数显著增加(P<0.05、图1C)。
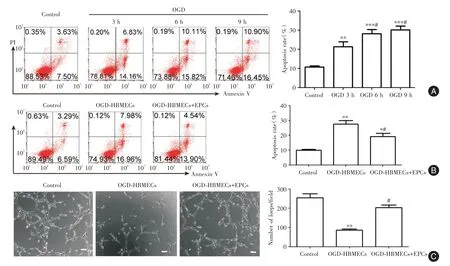
图1 EPCs对HBMECs生物活性的影响Fig.1 The effect of EPCs on the biological activity of HBMECs
2.2 EPCs衍生的SDF⁃1α通过CXCR4而不是CXCR7减轻HBMECs凋亡与OGD⁃HBMECs组相比,OGD⁃HBMECs+EPCs培养液中的SDF⁃1α显著增加(P<0.05,图2A)。OGD⁃HBMECs触发了EPCs中SDF⁃1α的产生和分泌,SDF⁃1α沉默EPCs致上清液中的SDF⁃1α急剧减少(P<0.05,图2B)。CXCR7的表达不受EPCs处理的影响;然而,CXCR4的表达在OGD⁃HBMECs+EPCs处理的细胞中显著增加(P<0.05,图2C)。与对照siRNA相比,CXCR4敲除显著增加HBMECs凋亡(P<0.05,图2D)。
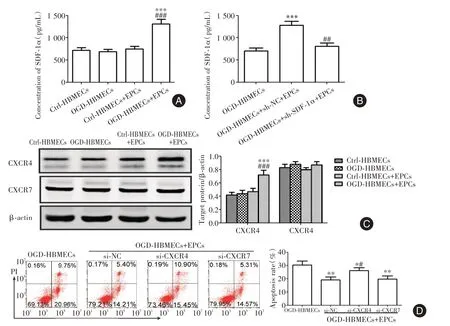
图2 EPCs衍生的SDF⁃1α通过CXCR4而不是CXCR7减轻HBMECs凋亡Fig.2 EPCs⁃derived SDF⁃1α attenuates HBMECs apoptosis through CXCR4 but not CXCR7
2.3 MCAO对大鼠大脑皮层中EPCs和SDF⁃1α表达变化影响MCAO模型大鼠在建模后第4天时大脑皮层中的EPCs数量以及Claudin5阳性血管的平均光密度显著高于假手术组(P<0.05),但在第10天时降低到正常水平(P<0.05,图3A⁃B)。此外,MCAO还导致建模后第4天时大脑皮层中SDF⁃1α蛋白水平增加(P<0.05),但在第10天时降低到正常水平(P<0.05,图3C)。
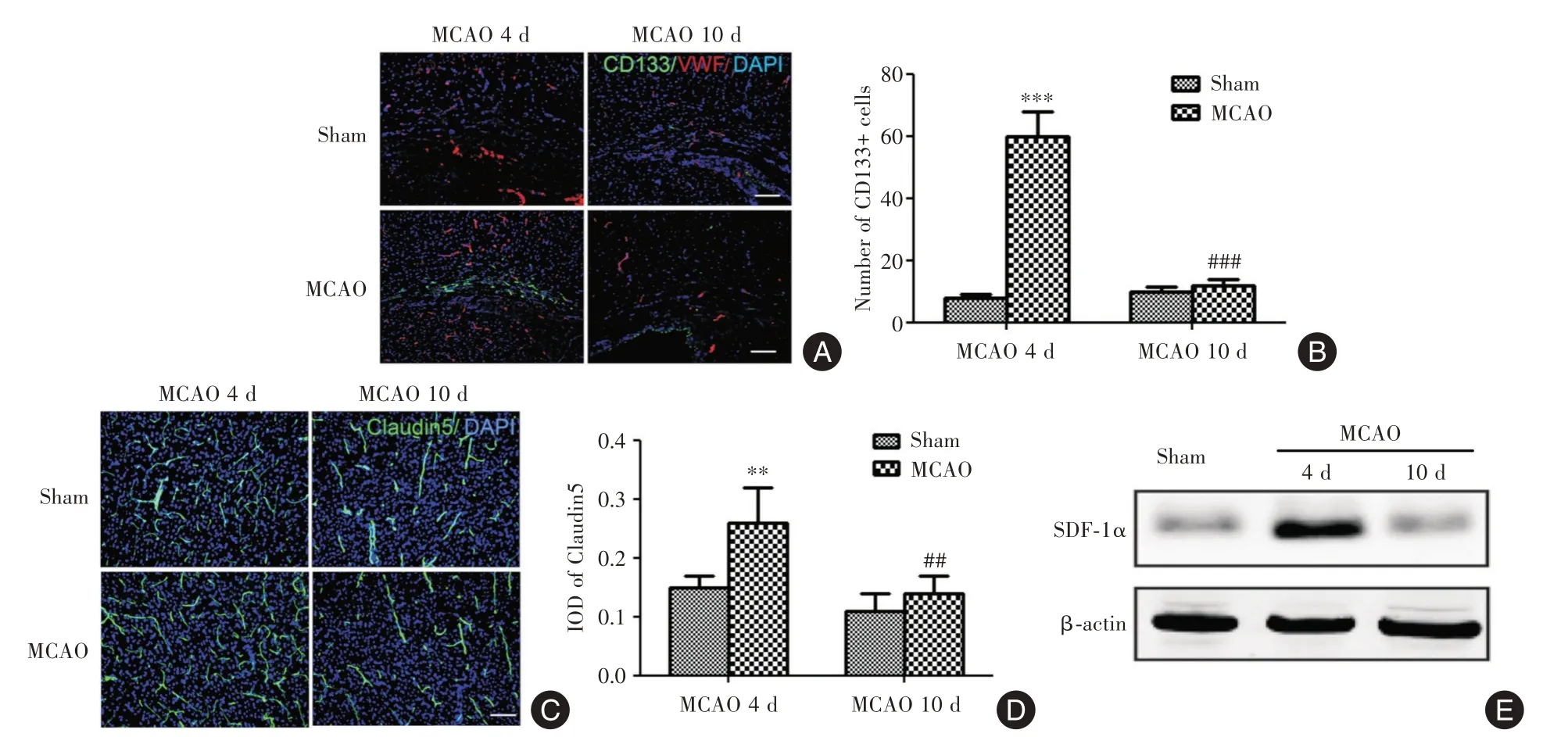
图3 MCAO对大鼠大脑皮层中EPCs和SDF⁃1α表达变化影响Fig.3 The effect of MCAO on the expression of EPCs and SDF⁃1α in rat cerebral cortex
2.4 HBMECs⁃pEPCs促进MCAO大鼠神经血管小生境修复和改善认知功能与MCAO+EPCs组大鼠相比,HBMECs⁃pEPCs组大鼠大脑皮层中形成的血管密度增强(P<0.05),但AMD3100治疗显著降低了HBMECs⁃pEPCs治疗形成的血管密度(P<0.05,图4A中CD31阳性)。采用Morris水迷宫试验测量认知功能。与MCAO+EPCs组相比,MCAO+HBMECs⁃pEPCs组大鼠在目标象限的游泳时间和交叉次数显著增加(P<0.05),但AMD3100治疗显著减弱了HBMECs⁃pEPCs这一作用(P<0.05,图4B、C)。
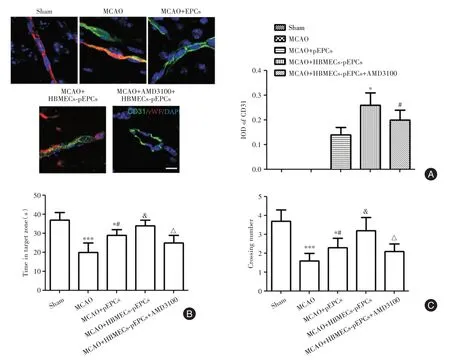
图4 HBMECs⁃pEPCs促进MCAO大鼠神经血管小生境修复和改善认知功能Fig.4 HBMECs⁃pEPCs promoted neurovascular niche repair and improve cognitive function in MCAO rats
3 讨论
目前认为,血管生成可以通过恢复血液供应保护细胞免受各种环境压力,包括缺氧和营养不良,并且在受损组织中发现多种促血管生成因子上调,如VEGFA和ANGPT2[9-12]。此外,还发现血管生成可恢复缺氧或缺血条件下HBMECs功能障碍引起的血管渗漏[13-14]。因此,缺氧应激时促进血管生成被认为是治疗卒中的一种有效的神经元保护措施。本研究证明OGD⁃HBMECs损伤诱导EPCs中SDF⁃1α的增加,并且EPCs通过SDF⁃1α/CXCR4轴在体外增强HBMECs的功能和减少HBMECs的凋亡。体内研究的发现进一步支持HBMECs⁃pEPCs促进MCAO大鼠神经血管小生境修复。
先前的研究表明,EPCs的系统输送可保护大脑免受缺血性损伤,促进神经血管修复,并改善长期神经行为结果[5]。在EPCs介导的神经保护过程中,趋化因子SDF⁃1α发挥了关键作用[15-17]。SDF⁃1α通过将循环中的EPCs归巢到活跃的血管生成部位来介导血管发育[18]。研究表明,SDF⁃1α可在血清饥饿条件下减弱内皮祖细胞的凋亡,并可防止细胞的衰老,增强受损动脉的再内皮化[19]。本研究发现,EPCs可抑制OGD⁃HBMECs的凋亡,增强其功能。已有研究表明,EPCs通过分泌BDNF和bFGF促进缺血性脑卒中小鼠血管生成,增加髓鞘厚度。LI等[20]报道,将SDF⁃1α过度表达的EPCs移植到卒中小鼠体内,可增加血管密度,表明神经血管修复部分依赖于EPCs替代或分泌细胞因子。本研究检测到由OGD⁃HBMECs的条件培养液刺激引起EPCs中SDF⁃1α的明显增加,并且当OGD⁃HBMECs和EPC共培养时,CXCR4上调,而CXCR7没有改变。此外,来自RNAi的数据表明CXCR4在HBMECs中负责SDF⁃1α依赖性抗凋亡,而不是CXCR7。研究发现,CXCR4受体在HBMECs的增殖和迁移过程中起重要作用,CXCR7可能在成熟过程中起作用。因此,EPCs通过SDF⁃1α/CXCR4轴介导神经血管生成,维持神经血管小生境稳态。
在成人缺血模型中,体循环中的EPCs被激活并迁移到损伤区域,通过细胞替换整合到新血管中[21-22]。体循环EPCs减少会增加脑损伤和认知障碍的风险。本研究在大鼠MCAO模型大脑皮层中发现EPCs的积聚。EPCs衍生出几种营养因子,已知SDF⁃1α、VEGF、血管生成素或MMPs可能负责维持正常和受损大脑中的神经血管小生境微环境稳态[23]。其中,SDF⁃1α在小鼠脑长期低灌注模型中显示出改善血管损伤的能力[5]。在缺血性患者中,SDF⁃1α的表达以及血液中EPCs细胞的数量密切相关[24]。亚急性给予SDF⁃1α可促进缺血半暗带血管生成,显著改善缺血大鼠的神经功能恢复[25]。本研究发现SDF⁃1α在MCAO大鼠中增加,并且证实它在病理条件下由累积的EPCs释放,可能有助于神经血管重塑。
总之,这些数据表明EPCs衍生的SDF⁃1α在内皮祖细胞的发育中发挥了重要作用,提高了EPCs治疗缺血性卒中的效果。HBMECs⁃pEPCs能有效地促进血管生成,其作用机制至少部分由SDF⁃1α/CXCR4轴介导。此外,HBMECs⁃pEPCs治疗MCAO大鼠的认知功能结果比EPCs治疗更明显。然而,EPCs是否通过其他通路对卒中神经血管重塑和认知功能恢复的影响值得进一步研究。

