黑曲霉果胶酯酶在毕赤酵母中异源表达、性质分析及脱酯工艺优化
孙莹,吴丹,郑璞,陈鹏程
(江南大学 生物工程学院,江苏 无锡,214122)
果胶又称聚甲氧基半乳糖醛酸,以原果胶、果胶酸和果胶的形式存在于植物中,具有良好的胶凝性、乳化性和增稠性。这3种果胶类物质的区别与甲酯的含量有关[1]。果胶分子主链上的半乳糖醛酸残基在C-6位可被酯化为甲酯,甲酯化半乳糖醛酸与总半乳糖醛酸摩尔数之比称为酯化度(degree of esterification,DE)[2]。食品化学法典规定:DE>50%的果胶称为高酯果胶(high methoxyl pectin,HMP),反之称为低酯果胶(low methoxyl pectin,LMP)。LMP可以通过将HMP进行脱酯得到,脱酯法有化学法和酶法。化学法具有成本高、工艺控制繁琐、污染环境等缺点。与化学法相比,酶法脱酯制备的LMP具有质量高,得率高和绿色环保等优点[3]。HMP和LMP在工业中最重要的应用是凝胶作用,二者的凝胶机理不同[4]。HMP在含糖量高于55%和pH在2.0~3.5的条件下才可形成凝胶,通常用于高糖含量食品的生产,不利于糖尿病患者等特殊人群的使用,应用受到限制[5]。LMP则不受体系pH和可溶性固形物含量影响,在较低糖含量甚至无糖条件下,只要Ca2+等二价金属阳离子存在即可形成凝胶,主要用于低糖食品的生产,符合现代人们降油降糖、健康饮食的需求,因而具有广阔的市场前景[6]。
果胶酯酶(pectinesterase,PE,EC 3.1.1.11),属于羧酸酯水解酶系,是果胶酶三大组分之一[7]。PE能够从果胶分子的还原性末端或者邻近的游离羧基开始,定向攻击甲氧基,进行去甲基化反应,生成果胶酸,从而将HMP转化为LMP,属于皂化酶[8]。PE广泛存在于植物和微生物中,在植物中,主要存在于根、茎、叶和果实等中,在微生物中,PE主要存在于真菌(如曲霉菌)和细菌(如假单胞菌)[9],此外,在一些植物致病菌(如导致植物软腐病的欧氏杆菌)中也发现了PE[10]。PE被广泛应用于食品加工,改善果胶在水中的溶解度,提高果蔬汁的出汁率,提高果汁果酒的澄清度等,还用于化妆品、制药、造纸等行业。此外,PE也是一些植物病原体侵染植物的关键酶[11]。
20世纪60年代起,国内开始进行PE的来源、生物学特性、酶学性质及工业应用等方面的研究。尽管对PE已有了一定的研究,但目前国内外仍未实现酶法制备LMP的工业化生产,主要原因是国内目前研究的PE存在表达量低、酶活力低、热稳定性差等缺点[12],限制了酶法制备LMP的工业化生产。目前尚未有专门用于脱酯的商品PE,市售的果胶酶大多是PE、聚半乳糖醛酸酶和果胶酸裂解酶的混合物,国内的PE市场受到Sigma等国外大型公司的限制,昂贵的价格也限制了我国酶法脱酯的工业发展[13],因此对PE进行重组表达以提高其表达量及改善其酶学性质具有重要的意义。
本研究根据毕赤酵母(Pichiapastoris)X33的密码子偏好性,对黑曲霉(Aspergillusniger)来源的PE基因进行密码子优化,并实现其在P.pastorisX33中的异源表达,分离纯化获得纯PE,研究了其酶学特性,并对该酶的脱酯工艺条件进行优化,以期为促进酶法制备LMP的工业化应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
菌株EscherichiacoliJM109、PichiapastorisX33、质粒pPICZαA均由本实验室保存。
1.1.2 主要试剂和仪器
主要试剂:HMP,上海麦克林生化科技有限公司;博莱霉素(ZeocinTM),北京索莱宝科技有限公司;PrimeSTAR®Max DNA Polymerase、Premix TaqTM,大连宝生物工程有限公司;一步克隆试剂盒、T4 DNA连接酶、核酸分子质量Marker,诺维赞有限公司;质粒小提中量试剂盒、PCR产物纯化试剂盒、胶回收试剂盒,上海捷瑞生物工程有限公司;其他试剂均为国产分析纯或化学纯。
主要仪器:PCR仪、蛋白电泳系统,美国伯乐生命医学产品有限公司;电转仪,德国艾本德股份公司;核酸电泳仪,北京六一生物科技有限公司;凝胶成像系统,上海天能科技有限公司;酶标仪,美国伯腾仪器有限公司;碱式滴定管,扬州市葵花玻璃厂。蛋白纯化系统,美国通用电气医疗集团。
1.1.3 培养基
LB(Luria-Bertani)、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)、酵母浸出粉胨甲醇(yeast extract peptone methanol,YPM)、BSM培养基均参照Invitrogen公司操作手册推荐的方法进行配制。
1.2 实验方法
1.2.1 表达载体pPICZαA-pe的构建
根据P.pastorisX33的密码子偏好性,对黑曲霉PE基因(Genbank:XP_025519631.1)进行密码子优化,由天霖生物科技(上海)有限公司合成,并克隆至pUC57质粒中得到pUC57-pe重组质粒,以该重组质粒为模板,通过PCR反应得到优化后的果胶酯酶基因pe。同样地,以质粒pPICZαA为模板进行PCR扩增,通过胶回收获得载体片段。使用一步克隆试剂盒将pe基因与pPICZαA进行连接,连接产物转化感受态细胞E.coliJM109,涂布LB平板(含0.1 g/L ZeocinTM),37 ℃过夜培养后挑取单克隆进行菌落PCR反应,挑取阳性转化子接种至LB液体培养基振荡培养12~16 h后提取质粒进行酶切验证,将酶切结果正确的质粒送天霖生物公司进行测序,测序无误的质粒命名为pPICZαA-pe。
1.2.2 重组菌株X33的构建与摇瓶发酵
本研究采用P.pastorisX33作为表达宿主,使用SacⅠ将重组质粒pPICZαA-pe进行线性化,用PCR产物纯化试剂盒回收纯化片段,随后电击转化至P.pastorisX33感受态细胞中,涂布YPD平板(含0.1 g/L ZeocinTM),30 ℃培养至出现单菌落即为重组菌株X33。挑取重组菌单菌落接种至YPD液体培养基中,30 ℃,220 r/min培养24 h 后于4 ℃,5 000 r/min离心10 min,去除上清液得到菌体。转接至YPM培养基中进行PE的诱导表达,30 ℃,220 r/min培养72 h,每隔12 h添加终体积分数为1%的甲醇。诱导结束后,发酵液经4 ℃,7 000 r/min离心5 min后取上清液即得到PE粗酶液,对粗酶液的酶活力和蛋白浓度进行测定,通过筛选,选择酶活力最高的1株重组菌株用于3 L罐高密度发酵。
1.2.3 酶活力的测定
参考GONZALEZ等[14]的方法并做出改进,采用碱滴定法。将30 mL 1 g/L的果胶溶液(pH 5.0 0.1 mol/L柠檬酸-0.2 mol/L Na2HPO4缓冲液)在37 ℃水浴摇床预热10 min,加入1 mL待测PE液,置于37 ℃水浴摇床反应10 min,煮沸10 min灭活,用0.01 mol/L NaOH溶液滴定pH至9.0。以煮沸灭活的酶液作对照。酶活力定义为:在37 ℃、pH 5.0条件下,每分钟作用果胶产生1 μmol羧基所需的酶量定义为1个酶活力单位。
1.2.4 酶学性质分析
将摇瓶发酵得到的PE粗酶液经阴离子交换柱分离纯化后获得的纯PE进行酶学性质分析。
最适反应条件分析:用0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液分别配制pH 2.0~8.0的底物溶液,在37 ℃下测定PE在不同pH体系中的酶活力,以最高酶活力为100%,比较各pH条件下的相对酶活力,确定最适反应pH。在最适反应pH条件下,测定30~85 ℃的酶活力,以最高酶活力为100%,确定最适反应温度。
稳定性分析:将纯PE置于不同pH(2.0~8.0)的0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液中,4 ℃静置2 h,用pH 5.0的上述缓冲液调节pH至5.0后在最适条件下测定残余酶活力,以未处理的PE的酶活力为100%,分析酶的pH稳定性。将纯PE分别在35、45、55、65、75 ℃下保温100 min,每20 min取样,立即置于冰浴中冷却,在最适条件下测定残余酶活力,以未经处理的PE的酶活力为100%,分析酶的温度稳定性。
动力学参数分析:在最适反应条件下测定PE在不同浓度HMP溶液下的酶活力,采用Lineweaver-Burk双倒数法,以底物浓度的倒数为横坐标、酶活力的倒数为纵坐标,绘制酶动力学参数曲线。根据与坐标轴的交点,其中横轴截距为-1/Km,纵轴截距为1/Vmax,计算出PE的米氏常数Km和最大反应速率Vmax。
1.2.5 重组菌株X33的3 L罐高密度发酵
挑取经筛选得到的1株重组菌单菌落接种至100 mL YPD液体培养基中,30 ℃,220 r/min培养至OD600值为10~12后,以10%接种量接种至含900 mL BSM培养基的3 L发酵罐中进行高密度发酵。生长期的发酵参数为:温度30 ℃、转速220 r/min、溶氧(dissolved oxygen,DO)20%,使用浓氨水调节pH至5.5,培养至DO反弹(一般DO>60%),进入补料分批培养阶段,开始使用含有12 mL/L PTM1的500 g/L的甘油进行流加,待OD600达到100时,停止甘油的流加,进行饥饿培养,待DO再次反弹时,开始使用含有12 mL/L PTM1的甲醇进行诱导表达阶段,诱导产PE,同时,设置诱导温度为28 ℃,使用甲醇检测流加控制器控制甲醇体积分数在0.5%,甲醇诱导开始后,每隔12 h取样测定酶活力,诱导96 h后OD600达到500以上时终止发酵。
1.2.6 果胶酯化度的测定
称取0.1 g果胶,移入100 mL锥形瓶中,加入0.4 mL乙醇润湿,加入20 mL ddH2O,封口转动使其完全溶解(时间不宜过久),滴3滴5 g/L的酚酞指示剂,用0.1 mol/L NaOH溶液滴定至微红色,记录空白和样品所耗NaOH的体积(V0、V1),即为原始滴定度。继续加入20 mL 0.5 mol/L NaOH溶液,封口后强烈振摇20 min,加入20 mL 0.5 mol/L HCl溶液,充分振摇至红色消失,然后加入3滴酚酞指示剂,用0.1 mol/L NaOH溶液滴定至微红色,记录所耗NaOH体积(V2),按公式(1)计算酯化度[15]。
(1)
1.2.7 PE的脱酯工艺条件优化
以脱酯率为指标,采用控制变量法,进行单因素试验,反应体系为50 mL,分别考察果胶浓度、加酶量、反应温度、初始pH及脱酯时间对酶法脱酯反应的影响。
选择10、20、30 g/L三个果胶质量浓度(pH 5.0),每个果胶浓度分别选择7个加酶量:32.7、65.4、98.1、196.2、392.4、784.8、981 U/g,65 ℃下水浴振荡反应3 h,反应结束后,测所得LMP的酯化度。
采用已经优化的果胶浓度和加酶量,分别配制pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5的果胶溶液,65 ℃下水浴振荡反应3 h,反应结束后,测所得LMP的酯化度。
采用已经优化的果胶浓度、加酶量和初始pH,分别在50、55、60、65、70、75、80 ℃下水浴振荡反应3 h,反应结束后,测所得LMP的酯化度。
采用已经优化的果胶浓度、加酶量、初始pH和温度,分别水浴振荡10、20、30、40、50、60、70、80、90、100、120 min,反应结束后,测所得LMP的酯化度。
2 结果与分析
2.1 重组PE的异源表达
以pUC57-pe质粒为模板,通过PCR扩增得到果胶酯酶基因pe,电泳结果如图1-a所示,在936 bp出现明显的DNA条带,与预期一致。以质粒pPICZαA为模板进行PCR扩增,得到载体片段,电泳结果如图1-b所示,条带大小与预期一致(3 546 bp)。利用Hind Ⅲ和BamH Ⅰ对重组质粒pPICZαA-pe进行酶切验证,结果如图1-c所示,重组质粒被酶切后出现了与预期大小一致的2个DNA片段,分别为1 700和2 800 bp。构建好的质粒经测序验证正确无误后,命名为pPICZαA-pe。

M-DNA marker;a1-pe的PCR产物;b1-质粒pPICZαA的PCR产物;c1-被Hind Ⅲ和BamH Ⅰ酶切后的质粒pPICZαA-pea-pe的PCR扩增产物电泳图;b-质粒pPICZαA的PCR扩增产物电泳图;c-重组质粒pPICZαA-pe的酶切验证电泳图图1 PCR 扩增和重组质粒酶切验证电泳图Fig.1 Identification of PCR amplification production and recombinant plasmid with agarose gel electrophoresis
使用SacI线性化pPICZαA-pe质粒后经电转化法转化至P.pastorisX33感受态细胞,涂布YPD抗性平板,30 ℃培养至出现单菌落。随机挑取9个单菌落进行摇瓶诱导表达后,离心收集发酵液上清液,进行十二烷基硫酸钠-聚丙烯酰氨凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析(图2),并测定酶活力(结果见表1)。选定摇瓶酶活力最高的7号菌株,作为3 L发酵罐高密度发酵的菌株。
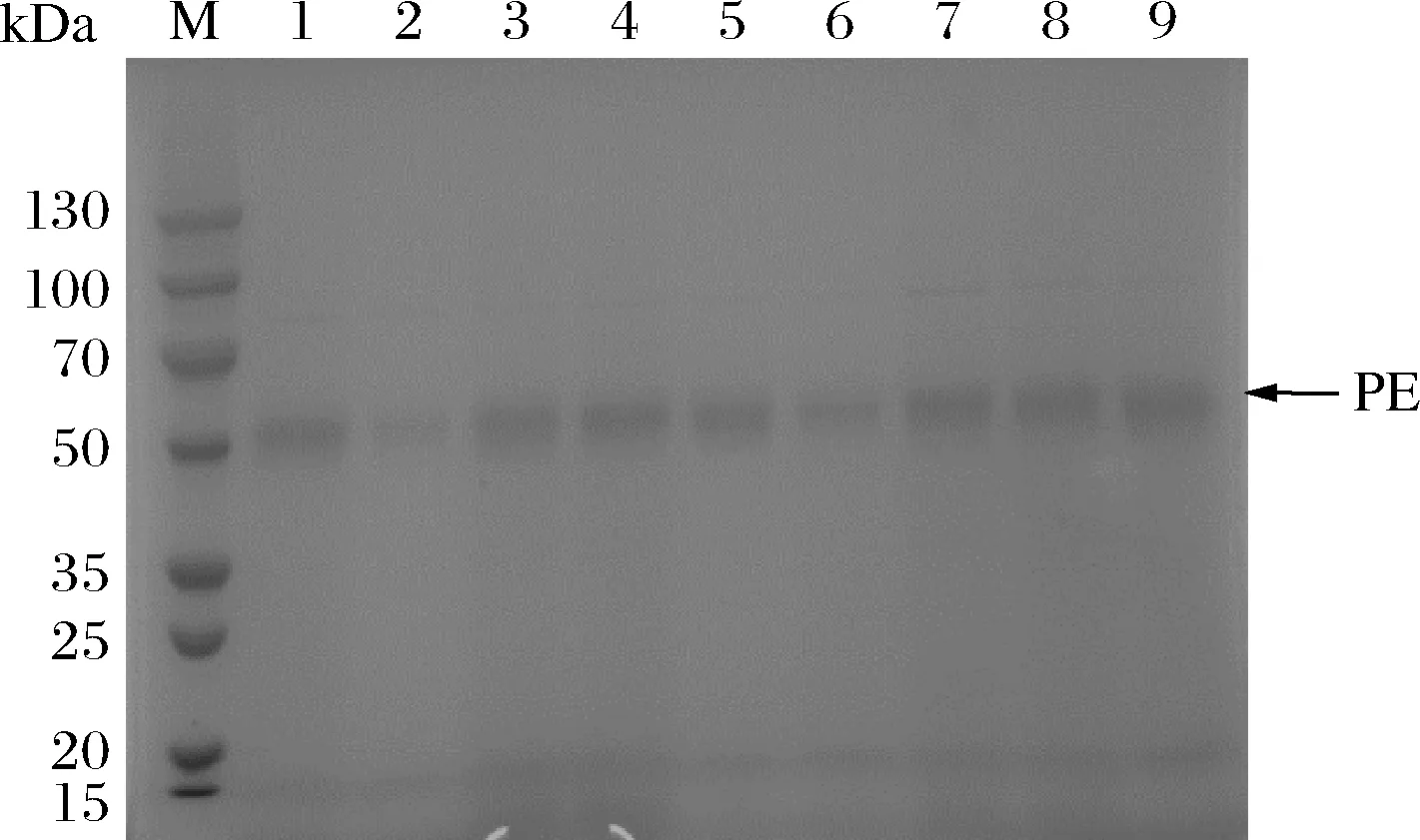
1~9-1~9号重组菌株的发酵液上清液图2 不同菌株的发酵液上清液SDS-PAGE图Fig.2 SDS-PAGE of supernatants from different strains

表1 重组PE摇瓶水平酶活力Table 1 Recombinant PE activities in shake flask
2.2 PE的3 L发酵罐高密度发酵
挑取7号重组菌株的单菌落接种至100 mL YPD液体培养基中,培养至OD600达到10~12。按照10%接种量,接种至装有900 mL BSM培养基的3 L发酵罐中,进行高密度发酵,由于发酵过程除了初始的甘油培养阶段,还有后续的甘油流加阶段以及甲醇的诱导表达阶段,一开始装入太多培养基,后期会导致发酵液太满而溢出发酵罐,无法继续进行高密度发酵;其次,发酵过程全程自动流加氨水以保障酵母生长的最适pH,培养基太多会限制转速从而影响溶氧,进而影响酵母的生长和酶的表达。甲醇诱导开始后,每隔12 h取样,离心保留上清液,诱导96 h后停止发酵。对经不同诱导的发酵液上清液进行SDS-PAGE分析(图3-a),并测定酶活力和OD600值(图3-b)。在发酵过程中,诱导96 h后,OD600达到435,84~96 h的OD600基本不变,重组PE的酶活力随诱导时间的增加而提高,最终达到85.12 U/mL,相比于摇瓶表达最高酶活力(12.16 U/mL)提高了6倍。
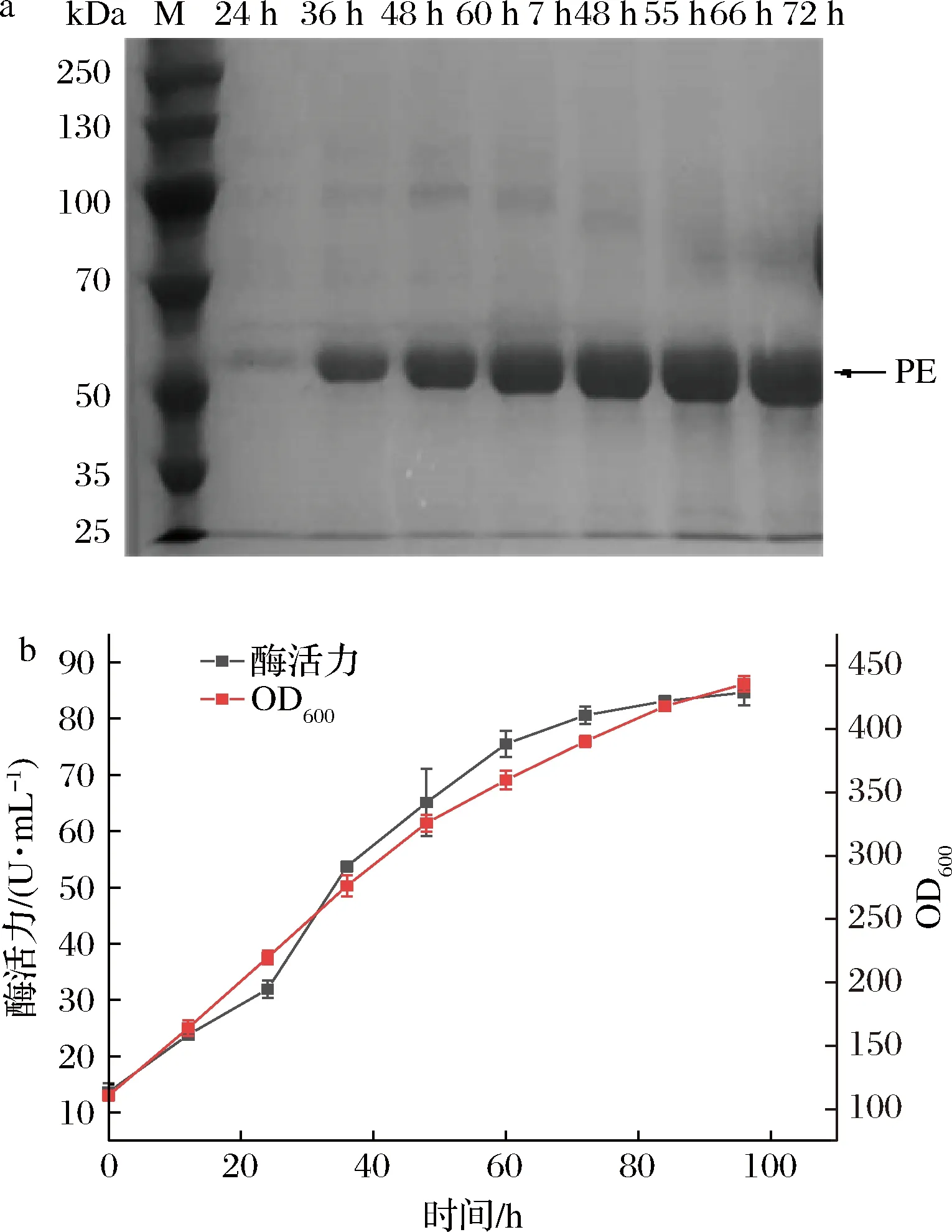
a-不同时间发酵液上清液SDS-PAGE图;b-发酵过程中酶活力和OD600曲线图图3 重组毕赤酵母3 L发酵罐发酵指标图Fig.3 Recombinant P.pastoris fermentation process in 3 L bioreactor
2.3 重组PE的酶学性质研究
2.3.1 最适pH及pH稳定性
重组PE的最适反应pH如图4-a所示。重组PE在pH 5.0时的酶活力最高,在pH 4.5~5.5,仍有90%以上的酶活力;当pH从5.5升高至8.0时,酶活力迅速降低,pH 8.0时,仅有8.3%,说明该酶是一种偏酸性酶。pH稳定性如图4-b所示。重组PE即使在pH 3.5~6.5的酸性条件下孵育2 h后,仍具有60%以上的酶活力,但在pH 8.0孵育2 h后,其酶活力下降较多,仅有25%,说明该PE在碱性条件下的稳定性较差。
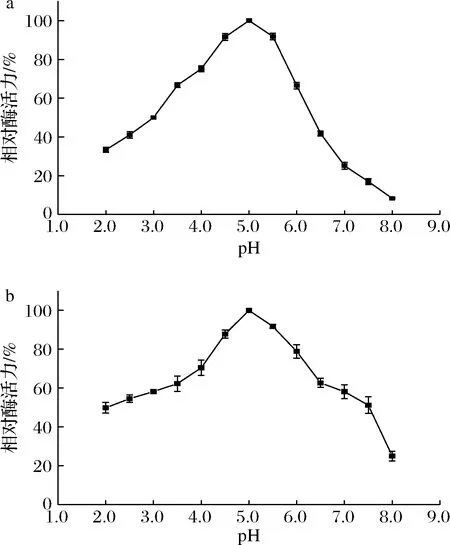
a-最适pH;b-pH稳定性图4 pH对重组PE活性和稳定性的影响Fig.4 Effect of pH on activity and stability of recombinant PE
2.3.2 最适温度及温度稳定性
重组PE的最适反应温度如图5-a所示。重组PE的最适反应温度为55 ℃,在45~65 ℃时PE的相对酶活力保持在75%以上,55 ℃时具有最高酶活力,高于65 ℃时,酶活力迅速降低,温度达到85 ℃时,PE失活。温度稳定性如图5-b所示,重组PE在35~55 ℃相对比较稳定,35 ℃下处理100 min,仍保持60%的酶活力;55 ℃下处理60 min,保持50%的酶活力,65 ℃下处理20 min,酶活力降低至25%,处理60 min,酶活力降低至8%;75 ℃下处理40 min即失去酶活力。说明该PE在低温(35 ℃)下具有较好的稳定性。
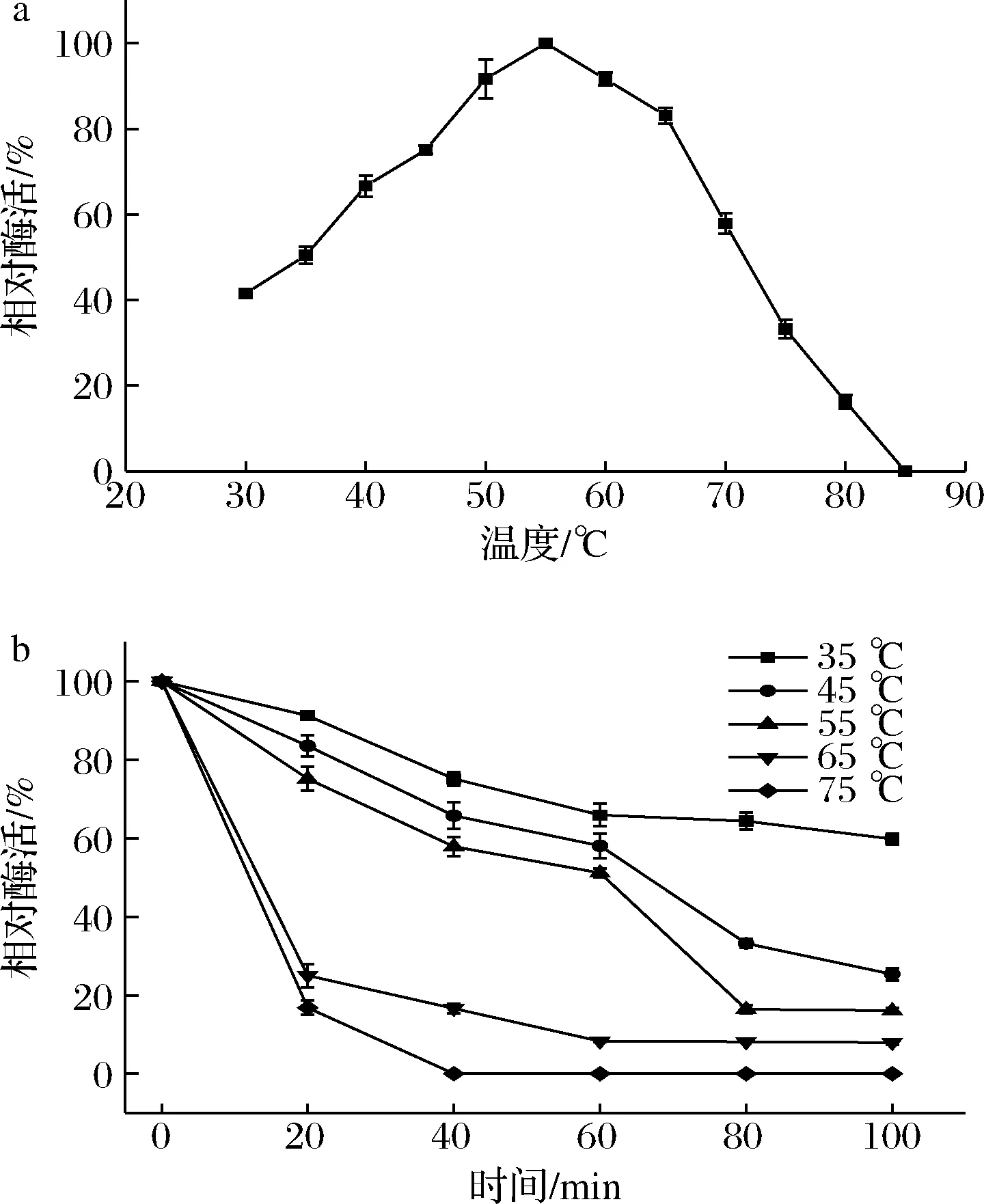
a-最适温度;b-温度稳定性图5 温度对重组PE活性和稳定性的影响Fig.5 Effect of temperature on the activity and stability of recombinant PE
2.3.3 PE动力学参数测定
用0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液分别配制质量浓度为2、4、6、8、10、12 g/L的HMP溶液,以其为底物,对纯化后的PE液适当稀释后,与不同浓度的底物在最适条件下进行酶解反应,测定PE的活力。采用Lineweaver-Burk双倒数法作图,得到曲线方程y=1.523 8x+0.110 6,R2=0.998 6。根据曲线方程可计算出该PE的米氏常数Km为13.8 mmol/L,最大反应速率Vmax为9.04 μmol/(L·min)。
2.4 PE的脱酯工艺优化
2.4.1 果胶浓度和酶量对脱酯的影响
选择10、20、30 g/L三个果胶质量浓度(pH 5.0),每个果胶浓度选择32.7、65.4、98.1、196.2、392.4、784.8、981 U/g,7个加酶量水平,65 ℃下脱酯3 h,由图6可知,果胶质量浓度为10 g/L时,果胶的酯化度随加酶量的增加而降低,加酶量为981 U/g时,酯化度最低,为20.4%。果胶质量浓度为20 g/L时,加酶量在32.7~392.4 U/g时,果胶酯化度随加酶量的增加而降低,加酶量为392.4 U/g时,酯化度最低,为22.2%,此后,随加酶量的增加酯化度反而提高。果胶质量浓度为30 g/L,加酶量为65.4 U/g时,酯化度最低,为23.5%,此后,随加酶量的增加,酯化度升高。在较高果胶浓度下,随着加酶量的增加,酯化度反而增加的原因可能是脱酯果胶的反馈抑制,随着加酶量增加,脱酯果胶浓度增加,反而抑制了PE的活性。综上考虑成本及工艺,选择30 g/L果胶、加酶量65.4 U/g,进行下一步的工艺条件优化。
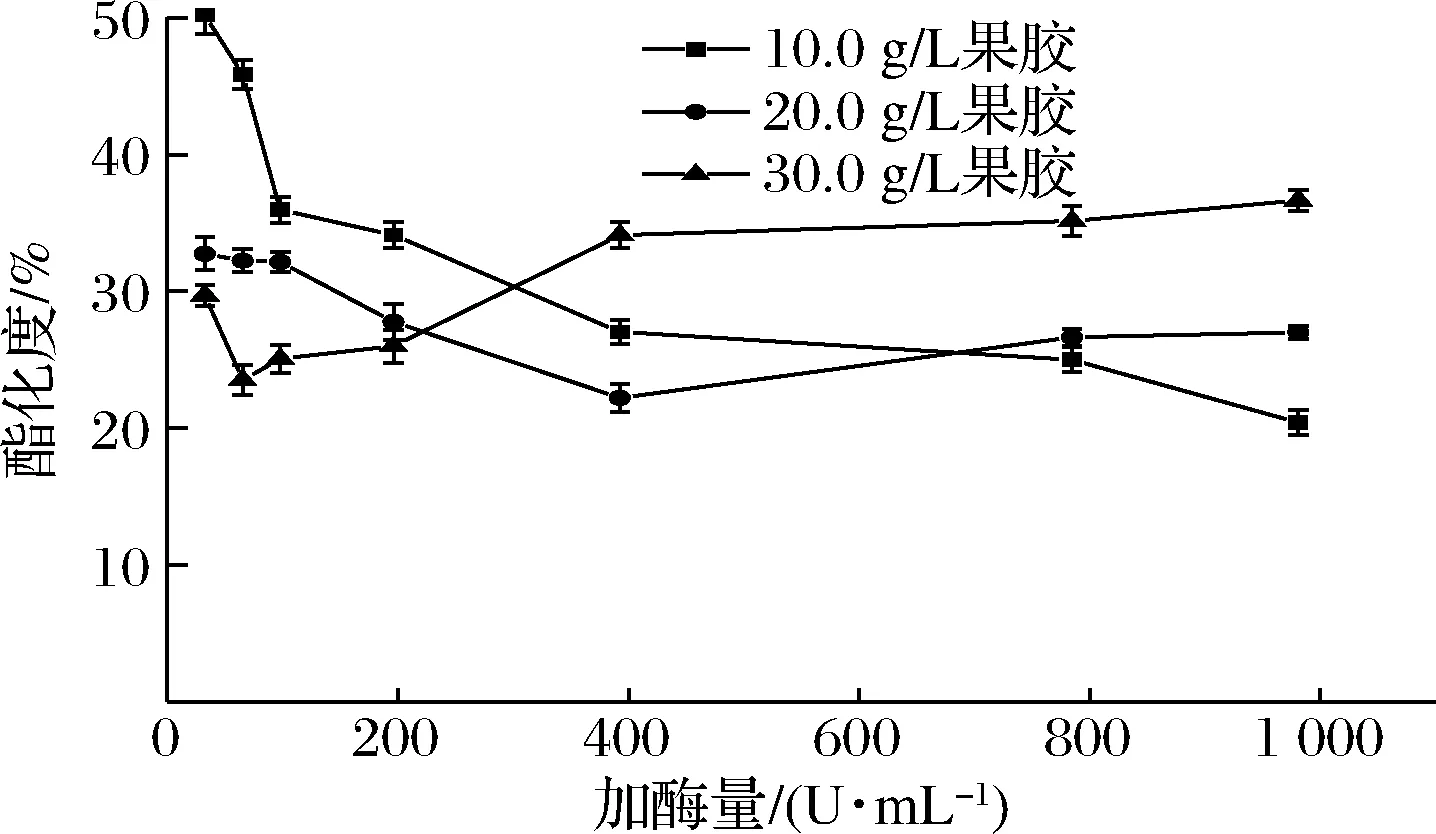
图6 果胶浓度和加酶量对脱酯的影响Fig.6 Effect of pectin concentration and enzyme amount on de-esterification
2.4.2 初始pH对脱酯的影响
在30 g/L果胶和加酶量为65.4 U/g条件下,选择pH分别为3.5、4.0、4.5、5.0、5.5、6.0、6.5,65 ℃下脱酯3 h,结果如图7所示。酶法脱酯的最适pH为5.5。在pH 3.5~5.5范围内,随着pH的增加,果胶的酯化度降低,pH 5.5时,酯化度最低,为20.8%,此后,随着pH的增加,酯化度升高。在pH 4.5~6.0,脱酯效果较好,酯化度在23%左右,这可能与该PE的偏酸性等电点(pI 4.16)有关。在pH 3.5~6.5,酯化度最高,为24.6%,最低为20.8%,酯化度相差较小,表明初始pH对酶法脱酯的影响较小。综上,选择pH 5.5进行下一步的工艺条件优化。
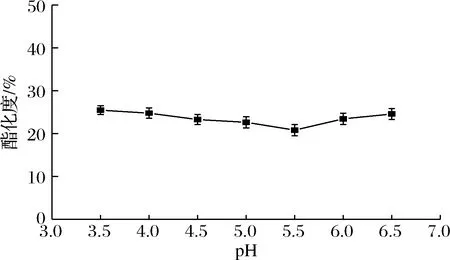
图7 初始pH对脱酯的影响Fig.7 Effect of initial pH on de-esterification
2.4.3 反应温度对脱酯的影响
在30 g/L果胶、加酶量为65.4 U/g、pH 5.5条件下,分别选择45、50、55、60、65、70、75 ℃脱酯3 h,结果如图8所示。酶法脱酯的最适温度为50 ℃。在45~75 ℃,果胶的酯化度呈现V型变化,在50 ℃时脱酯效果最好,此时酯化度为18.2%。此后随着温度的升高酯化度增加。原因是随着温度的升高,PE活力降低,脱酯率随之下降,酯化度增加。脱酯温度对脱酯效果影响较大。综上,选择反应温度50 ℃进行下一步的工艺条件优化。
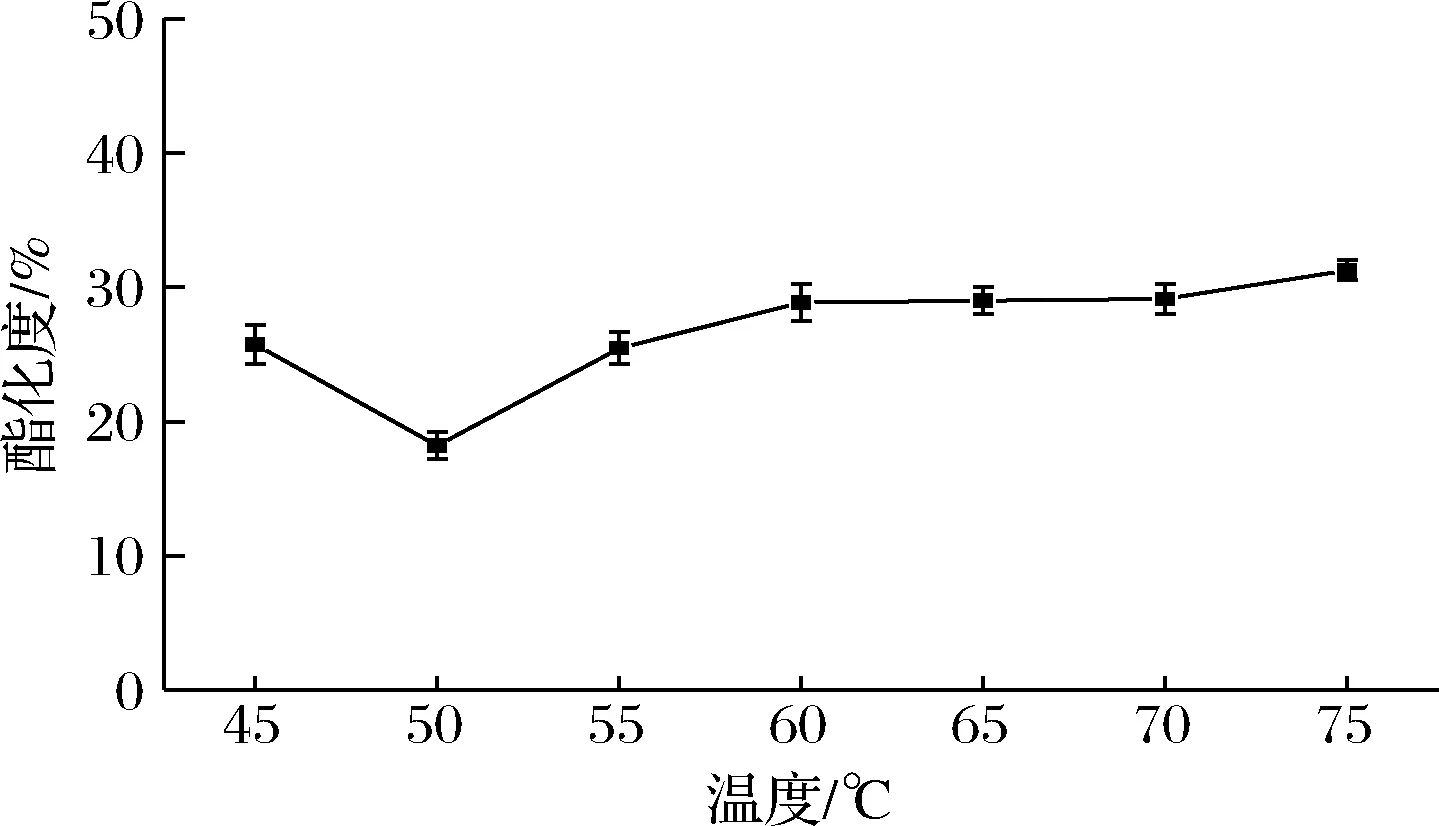
图8 反应温度对脱酯的影响Fig.8 Effect of reaction temperature on de-esterification
2.4.4 反应时间对脱酯的影响
在30 g/L果胶、加酶量为65.4 U/g、pH 5.5、50 ℃条件下,分别于10、20、30、40、50、60、70、80、90、100、110、120 min进行脱酯。由图9可知,酶法脱酯的最适反应时间为60 min。在10~120 min,果胶的酯化度呈现V型变化,在60 min时酯化度最低,为13.6%,PE脱脂效果最好。故选择60 min为最佳反应时间。在10~60 min,酯化度随时间的增加而降低。60 min后,随时间的增加酯化度反而提高。该结果与姚小丽[16]的研究一致,在最适脱酯时间的基础上延长反应时间,酯化度反而增加。猜想脱酯反应可能是可逆反应,时间的延长反而加速了逆反应的进行,但酶法脱酯过程是否是可逆过程还需进一步研究。
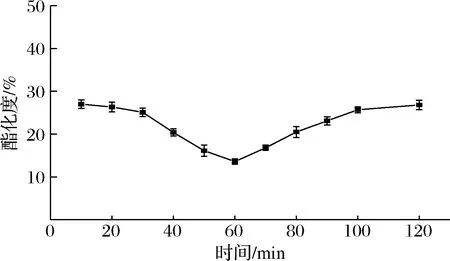
图9 反应时间对脱酯的影响Fig.9 Effect of reaction time on de-esterification
3 讨论与结论
本研究将来源于黑曲霉的果胶酯酶基因pe在P.pastorisX33成功实现高水平分泌表达,通过高密度发酵得到的粗酶液的酶活力达到85.12 U/mL,是目前报道的PE异源表达最高酶活力水平,较好解决了一直以来PE活力较低的问题。同时重组PE广泛的pH稳定性和较好的温度稳定性表明了其在工业应用方面的良好潜力。本研究所获得的PE在优化的最佳脱酯工艺条件下进行脱脂得到酯化度为13.6%的LMP,是目前所有酶法脱酯制备LMP相关报道中脱酯率最高、酯化度最低的实验结果,在酶法制备LMP的工业应用方面具有较好的应用意义。
——一道江苏高考题的奥秘解读和拓展

