细菌素CAMT2抗菌纳米纤维膜制备及其特性研究
李啟彬,张雪梅,刘颖*,房志家,徐春厚
1(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,广东省海洋生物制品工程实验室,水产品深加工广东普通高等学校重点实验室,广东湛江,524088) 2(广东海洋大学 滨海农业学院,广东 湛江,524088)
化学防腐剂的使用越来越受到消费者的排斥,由此刺激了对天然安全的生物防腐剂的研究与开发[1],其中,细菌素是微生物核糖体合成的抗菌多肽,由于在消化过程中可被蛋白酶水解,在体内不会产生不利的影响[2],因此作为天然安全的生物防腐剂替代化学防腐剂受到关注。目前,乳酸链球菌产生的细菌素(Nisin)已被60多个国家认为天然安全的食品防腐剂,并被大规模商业化生产与应用[3],但该细菌素仅对革兰氏阳性细菌有抑制作用[4]。随着研究的不断深入,发现枯草芽孢杆菌、苏云金芽孢杆菌、解淀粉芽孢杆菌、地衣芽孢杆菌等杆菌属产生的细菌素或细菌素类物质不仅具有较强的抗菌活性,而且对革兰氏阳性菌与革兰氏阴性菌均有抗菌活性,具有较宽的抗菌谱[1, 5]。
然而,细菌素直接添加到食品中可能会受到食品中脂肪等复杂成分的影响,从而影响细菌素的活性,进而不能达到预期的抗菌防腐效果[6-8]。为了克服以上问题,国内外学者采用微胶囊[9]、纳米脂质体[7, 10-11]、静电纺丝[12-13]等包埋技术,对活性物质进行保护,提高其使用稳定性。其中,静电纺丝技术将带有电荷的纺丝液在高压电场的作用下克服表面张力,产生带电的微小射流,进而被拉伸成丝状纤维,同时将活性物质包埋于纤维中,最后固化成膜[14]。利用该技术制得的纳米纤维膜由于具有比表面积大、孔隙率高、功能特性强、缓释效果好以及负载量高等优点,在活性物质包埋等方面受到青睐[15]。
本研究对象细菌素 CAMT2 是由分离自南海海域宝石石斑鱼的解淀粉芽孢杆菌(Bacillusamyloliquefaciens)ZJHD3-06代谢产生的一种新型细菌素,能抑制主要的食品腐败和食源性致病菌如李斯特菌(Listeriamonocytogenes)、金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)和副溶血性弧菌(Vibrioparahaemolyticus)[1]。可耐受高温达100 ℃并不失活,在pH为2~10具有较强的抗性。其中李斯特菌又被称为“冰箱杀手”,因其能在高盐、低温等逆境中生长,是常见于低温冰鲜食品中的致病菌,人感染后死亡概率在30%以上,历年有关低温下食品被李斯特菌污染致病的安全事件常有报道[16-17]。CAMT2对单增李斯特菌(L.monocytogenes)有明显的抗菌活性[1, 18],利用静电纺丝技术将其包埋于纳米纤维膜中,作为食品的活性包装材料,用于食品(尤其是低温冷冻食品)的保鲜。通过纳米纤维的缓释作用,CAMT2能较长时间地发挥抑菌功能,保护食品安全,具有良好的应用前景。
1 材料与方法
1.1 材料试剂与仪器
1.1.1 实验菌株
解淀粉芽孢杆菌(Bacillusamyloliquefaciens)ZJHD3-06,广东海洋大学CAMT团队分离自南海宝石石斑鱼肠道,NCBI登录号:KF585041;单增李斯特菌(L.monocytogenes, LM)ATCC 19111,购自广东省微生物研究所。
1.1.2 实验试剂
聚乙烯醇(polyvinyl alcohol,PVA,重均分子质量75 000~80 000 Da),上海源叶生物技术有限公司;细菌素CAMT2,实验室制备;葡聚糖凝胶SephadexG-50,美国GE医疗集团;甲醇(色谱纯),上海国药化学试剂有限公司;PBS,碧云天生物技术有限公司;改良TGE培养基(葡萄糖7.15 g/L、FeSO40.11 mg/L、维生素C 0.69 g/L、胰蛋白胨10.0 g/L、酵母膏10.0 g/L、陈海水),自行配制;TSA-YE培养基,北京索莱宝生物技术有限公司。
1.1.3 实验仪器
SS253静电纺丝设备,北京永康乐业科技发展有限公司;Sorvall LYNX高速落地离心机、Varioskan Flash全自动酶标仪,美国赛默飞世尔科技公司;AKTA purifier 100制备型蛋白质纯化系统,美国GE医疗集团;Agilent 1200半制备高效液相色谱,美国安捷伦科技;FlexSEM4800扫描电子显微镜,日本日立高新技术公司;SGW-1傅立叶红外光谱仪,上海上天精密仪器有限公司;磁力搅拌器、PHSJ-3F数字pH计,上海精密科学仪器有限公司;FDU-1110冷冻干燥机,EYELA东京理化器械株式会社;DW-86L80超低温冰箱,杭州绿博仪器有限公司;再生醋酸纤维素透析袋(1 kDa),北京索莱宝生物技术公司。
1.2 实验方法
1.2.1 细菌素CAMT2的制备
按AN等[1]的方法制备细菌素CAMT2,将活化后的108CFU/mL ZJHD3-06种子液按3%接种量接种到改良TGE培养基中,30 ℃、180 r/min下培养72 h。发酵液于4 ℃、8 000 r/min条件下离心10 min,收集上清液。在磁力搅拌器上,往上清液中缓慢加入硫酸铵粉末,使溶液的饱和度达60%。在4 ℃、12 000 r/min的条件下离心30 min,收集沉淀物,透析脱盐后冻干。冻干后产物采用SephadexG-50葡聚糖层析进行纯化,以pH 7.0 PBS缓冲液为流动相洗脱,220 nm为检测波长,收集活性组分。活性组分透析脱盐后用HPLC进一步纯化,使用C18柱,以体积分数为60%的甲醇-水溶液为流动相洗脱,在220 nm处进行监测,收集活性组分,旋蒸除去甲醇,冷冻干燥制备得CAMT2粉末,备用。
1.2.2 细菌素CAMT2抑菌活性测定
CAMT2冻干粉用PBS溶解,使溶液浓度分别为40、60、80 mg/mL,采用滤纸片法[19]测定不同浓度水平的CAMT2对LM的抑菌活性。用生理盐水稀释活化后的LM菌液,调整菌液浓度OD600=0.3±0.01,吸取100 μL均匀涂布到准备好的TSA-YE培养基上。灭菌后的直径为3 mm滤纸圆片充分浸泡CAMT2溶液,贴在涂布有LM的TSA-YE培养基上,37 ℃培养12 h,观察记录抑菌圈大小。
1.2.3 CAMT2—PVA纳米纤维膜的制备
1.2.3.1 纺丝液的制备
基于范笑笑等[20]的方法略加改进,称取0.8 g PVA浸泡在10 mL去离子水中15 min,待PVA软化后,加热搅拌至PVA完全溶解。然后加入CAMT2,搅拌均匀,使其质量浓度达40、60、80 mg/mL。最后超声10 min脱气备用。
1.2.3.2 静电纺丝制备纳米纤维膜
将制备好的CAMT2—PVA纺丝液吸入干燥的5 mL注射器中,排出空气,固定在静电纺丝设备的微量注射泵上。将注射器前端金属针头与高压直流电源正极连接,以固定在接收器上的铝箔作为接收屏。在正高压+28 kV,负高压-2.7 kV,接收距离15 cm,流速0.06 mL/min的条件下,进行静电纺丝,制备载细菌素的CAMT2—PVA纳米纤维膜,置于烘箱中30 ℃干燥3 d去除残留溶剂[21]。
1.2.4 CAMT2—PVA纳米纤维膜抑菌活性的测定
用打孔器将纳米纤维膜制成直径为3 mm的圆片,贴在1.2.2制备好涂布有LM的TSA-YE培养基上,37 ℃培养12 h,观察记录抑菌圈直径。以直径同为3 mm的不负载细菌素的PVA圆片为空白对照,各平行3组。
1.2.5 CAMT2—PVA纳米纤维膜缓释效应评价
将纳米纤维膜制成直径为3 mm的圆片,分别放入3支离心管中,加入3 mL PBS。室温无菌环境下每12 h吸取200 μL缓冲液,使用酶标仪测吸光值,检测至吸光值稳定,实验设3个平行组,每次吸取后回补等量的PBS。
1.2.6 CAMT2-PVA纳米纤维膜形貌观察
将抑菌效果最优的纳米纤维膜裁剪成5 mm×5 mm方块,表面喷铂金处理,所有样品喷金10 min。用扫描电子显微镜(3.0 kV,5.0× 10.0×)观察其形貌。
1.2.7 CAMT2—PVA纳米纤维膜的结构检测
将纳米纤维膜摊平,放置于傅立叶红外光谱仪(Fourier transform infrared,FT-IR)接受片上,波数4 000~400 cm-1,扫描速率1 200 cm-1/min。使用origin 9.65对谱图拟合波峰图,进行峰值识别,分析纳米纤维膜的化学结构[22]。
1.2.8 CAMT2—PVA纳米纤维膜对3种水产基质中LM的控制效果
1.2.8.1 三种水产基质平板制备
凡纳滨对虾去头尾、去壳;新鲜罗非鱼去头尾、鱼皮鱼骨;新鲜花蛤去壳,分别取肉,将每种基质的肉分别与NaCl质量浓度为9 g/L的生理盐水以3∶7(g∶mL)的料液比混合,反复均质至乳液状,煮沸2 min后过滤,收集滤液于锥形瓶中,加2%琼脂粉,121 ℃、20 min高温灭菌,冷却至55 ℃左右,按照1∶100的体积比接种OD600=0.3的LM菌悬液,然后倒平板制得对应水产基质LM指示平板[23]。
1.2.8.2 纳米纤维膜对水产基质中LM抑制效果
称取1.2.4中抑菌活性最好的CAMT2—PVA纳米纤维膜4.0 g,置于灭菌后的锥形瓶中,加入50 mL无菌PBS,4 ℃冰箱存放。每12 h吸取200 μL PBS,采用牛津杯法[24]加入到制备好的含LM的水产品基质培养基中,4 ℃下培养,记录抑菌圈大小,测试7 d,每种基质3个平行,每次吸取后回补等量的PBS[25]。
1.3 数据处理与分析
实验所得数据使用IBM SPSS 22软件进行显著性分析以及使用Origin 9.65软件进行绘图。
2 结果与分析
2.1 细菌素CAMT2电纺前后抑菌活性
静电纺丝后的纳米纤维膜在TSA-YE平板上对LM的抑菌活性如图1所示,3种浓度的纳米纤维膜均有抗菌活性,与纺丝前抑制活性比较见表1,CAMT2质量浓度为40与60 mg/mL电纺前抑菌圈直径分别为16.42与21.36 mm,而电纺后比电纺前抑菌圈显著减小,分别减小了6.44与4.90 mm。但当CAMT2质量浓度为80 mg/mL时,电纺前后抑菌圈直径差异不显著,电纺后抑菌圈直径仅减小了0.40 mm,与电纺前比,抑菌活性得到了有效保留。电纺后抑菌圈的小幅缩小推测是电纺过程中较高的电压使部分的细菌素失活或是细菌素被包埋于纳米纤维中不能快速释放所致[21]。
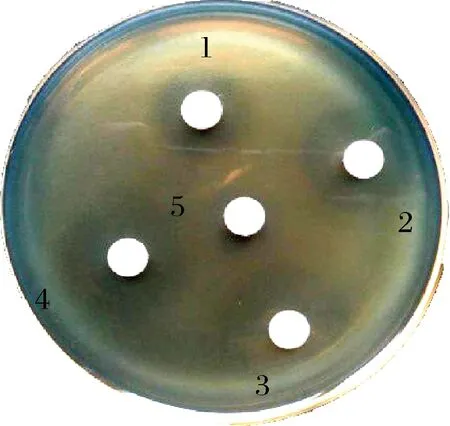
图1 不同细菌素浓度的CAMT2—PVA纳米纤维膜抑菌活性Fig.1 Antibacterial activity of CAMT2—PVA nanofiber membranes with different bacteriocin concentrations注:1-40 mg/mL CAMT2—PVA纳米纤维膜;2-60 mg/mL CAMT2—PVA纳米纤维膜;3-80 mg/mL CAMT2—PVA纳米纤维膜;4-吸附有80 mg/mL CAMT2细菌素溶液的滤纸片;5-PVA空白对照

表1 不同浓度细菌素CAMT2电纺前后抑菌活性Table 1 Antibacterial activity of different concentrations of bacteriocin CAMT2 before and after electrospinning
2.2 CAMT2—PVA纳米纤维膜缓释效应
将纳米纤维膜浸泡 PBS对PBS中CAMT2的释放量进行缓释监测,由图2可知,在0~0.5 d 为PBS渗透进入纳米纤维膜高分子体系内部的扩散阶段,活性物质CAMT2尚未被释放出体系外,OD值没有发生变化。随着PBS不断涌入,纳米纤维膜结构逐渐松弛,CAMT2开始从纳米体系中释放,并进入突释阶段,在第0.5~2天表现出OD值急速增大。当PBS大量涌入体系内,导致纳米纤维结构出现不均匀现象,甚至崩裂,同时CAMT2接触到PBS,最终导致负载的CAMT2以较高的释放速率从纳米纤维膜中释放出来[25],但在第2天后,CAMT2释放速率放缓,逐渐进入恒速释放过程,第4天后释放量趋于稳定。
2.3 CAMT2—PVA纳米纤维膜形貌表征
CAMT2质量浓度为80 mg/mL的纳米纤维膜的电镜图见图3,CAMT2—PVA纤维直径相近,为(720±110) nm,纤维表面光滑,无明显串珠,方向随机,形成质地紧密的多层网状结构,此结构有利于活性物质的有效释放及与食品基质中致病菌的接触[15]。
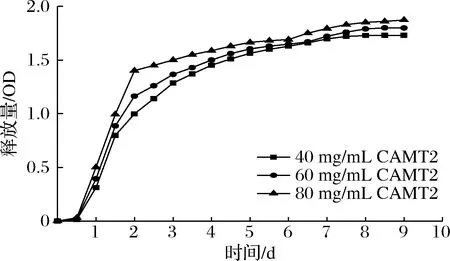
图2 细菌素纳米纤维膜缓释结果Fig.2 Results of sustained release of bacteriocin nanofiber membrane

a-5 000×;b-10 000×图3 CAMT2—PVA纳米纤维膜扫描电镜结果Fig.3 SEM results of CAMT2—PVA nanofiber membrane
2.4 CAMT2—PVA纳米纤维膜FT-IR分析
FT-IR可以对电纺纤维膜的组成和结构进行有效分析(图4)。
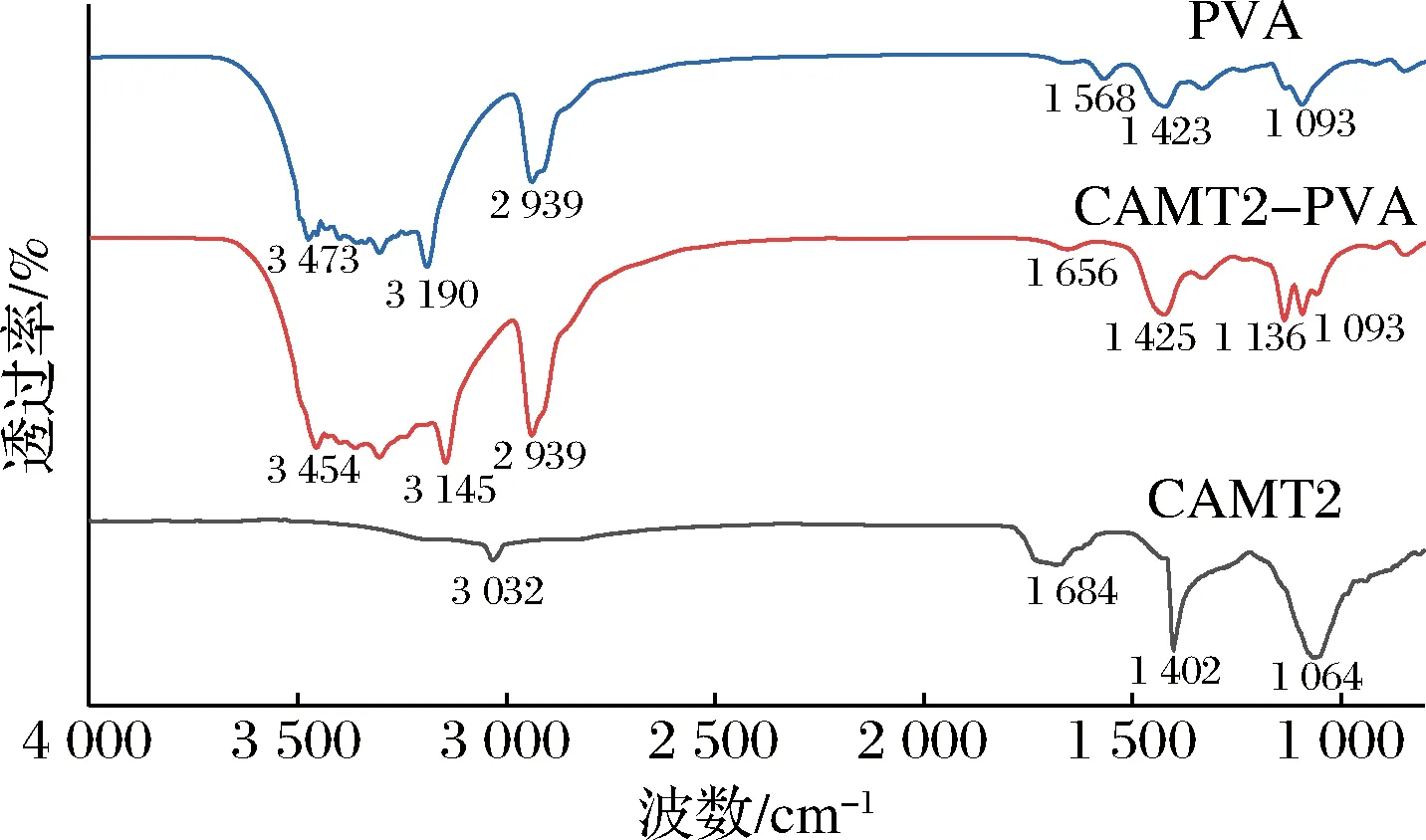
图4 纳米纤维膜红外光谱Fig.4 FT-IR of nanofiber membrane
由图4可知,负载细菌素的CAMT2—PVA纳米纤维膜与PVA在3 700~3 200 cm-1存在较宽的强吸收峰,归因于PVA中O—H的伸缩振动[20],在2 939 cm-1处的吸收峰为亚甲基(—CH2)中C—H的伸缩振动峰[26],这两处的吸收峰说明了CAMT2—PVA纳米纤维膜存在PVA基质。细菌素CAMT2于3 032 cm-1处的吸收峰归因于C—H键,位于1 684 cm-1的吸收峰可归因于蛋白质β螺旋N…H氢键[27],位于1 402 cm-1的吸收峰归因于蛋白质—CH2—键的摇摆振动,位于1 064 cm-1左右的特征吸收峰归因于羧基(COOH)的C—O键[28]。CAMT2—PVA对比PVA无新的显著吸收峰,但CAMT2—PVA位于1 425、1 136与1 093 cm-1处的吸收峰透过率显著增强,是PVA与细菌素CAMT2各自吸收峰叠加形成的,说明静电纺丝过程中PVA对细菌素CAMT2进行了有效的物理包埋[29]。
2.5 CAMT2—PVA纳米纤维膜对水产基质中LM的控制效应
CAMT2质量浓度为80 mg/mL的纳米纤维膜在4 ℃贮藏条件下对3种水产基质中LM均有较好的抑制效果(图5),在0~1 d细菌素CAMT2的释放量较低,未达到最小抑菌浓度,无明显抑菌圈,未表现出抑菌活性。在第1~1.5天后,CAMT2—PVA纤维膜释放出的CAMT2浓度开始增加,并陆续出现了抑菌圈。第1.5天后CAMT2—PVA纳米纤维膜中CAMT2的释放量迅速增加,对LM的抑菌圈直径显著增大,但第2天后抑菌圈直径增加缓慢,第6~9天抑菌圈直径基本保持稳定,这与纳米纤维膜的突释和缓释阶段相对应。由图5可知,在罗非鱼及对虾基质中抑菌圈大小接近,并均大于在花蛤基质中的抑菌圈大小;所以CAMT2—PVA纳米纤维膜在罗非鱼、对虾基质中对LM抑制效果接近,且抑菌效果略优于对花蛤基质的效果。
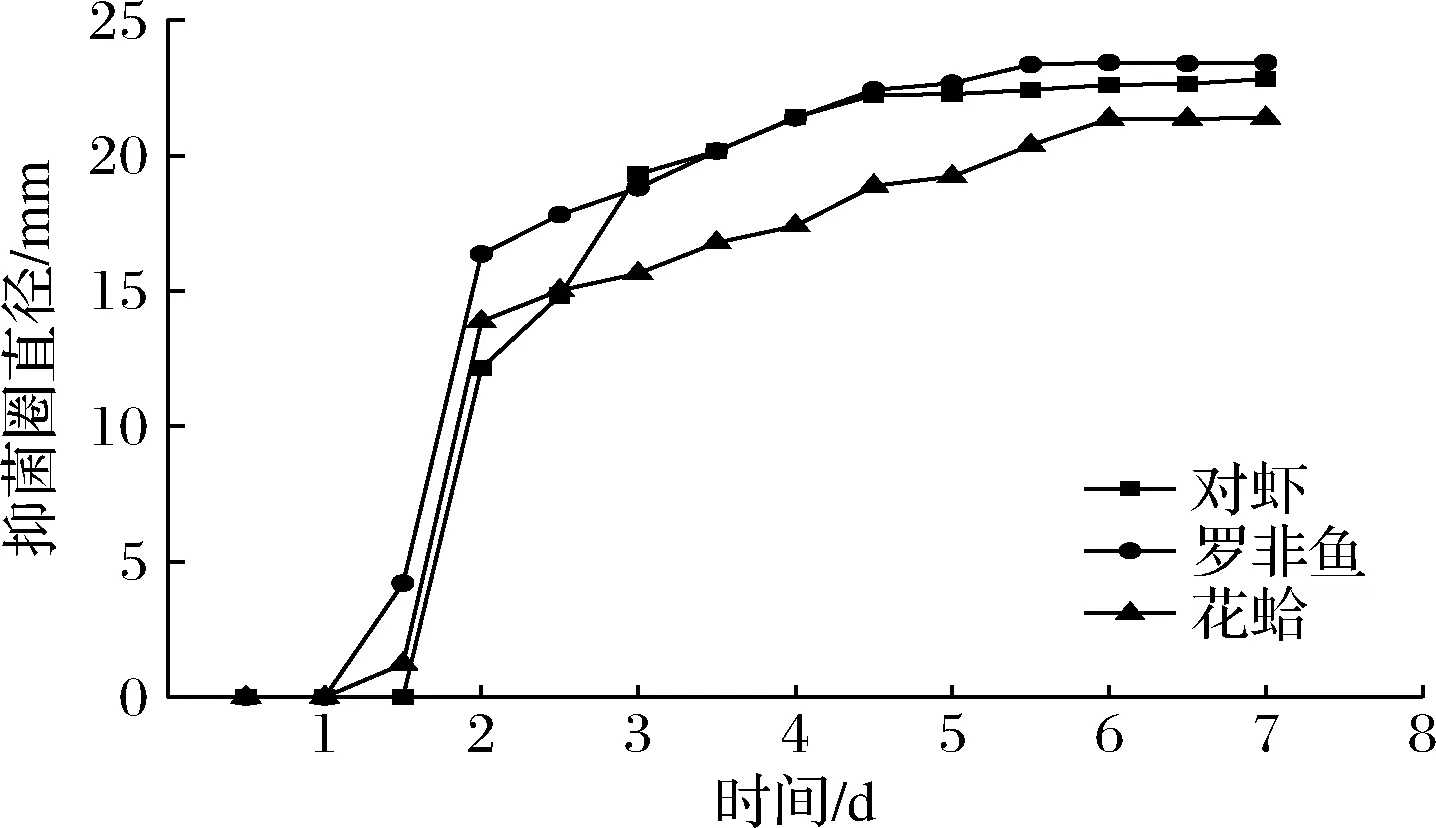
图5 4 ℃下细菌素纳米纤维膜在水产基质中对LM抑菌活性Fig.5 Antibacterial activity of bacteriocin nanofiber membranes on LM in aquatic substrates at 4 ℃
3 结论
本研究以PVA与细菌素CAMT2配制纺丝液,通过静电纺丝制备CAMT2—PVA纳米纤维膜。CAMT2浓度为80 mg/mL制备的CAMT2—PVA纳米纤维膜电纺后抑菌圈直径对比电纺前的无显著差异,抑菌活性保留效果良好。CAMT2—PVA纤维膜在第0.5~2天为突释期,细菌素的释放量随时间推移显著增加,第2天后进入缓释期,细菌素释放量缓慢上升,第7天后稳定。CAMT2—PVA纳米纤维膜直径均匀,分布致密,具有多层网状结构。说明静电纺丝过程中PVA对CAMT2进行了有效的物理包埋。在4 ℃下,CAMT2—PVA纳米纤维膜在3种典型的水产基质中具有明显的抑菌效果。
本研究制备了CAMT2—PVA抗菌纳米纤维膜,对纤维膜的抑菌能力、缓释性能和实际应用等进行了评价,但要实际应用于食品包装材料中仍需要进行力学、疏水性等评价。目前对静电纺丝包埋细菌素用于食品包装材料的研究报道仍然较少,所以本研究制备的CAMT2—PVA纳米纤维膜具有较大应用开发前景,希望能够对因细菌污染食品致病的安全问题有所帮助。

