Grx2基因敲除小鼠晶状体混浊模型的建立及Grx2在白内障发病机制中的作用
郭勇 郭辰峻 张婕 宁小娜 陈曦 严宏
1西安市人民医院(西安市第四医院) 陕西省眼科医院,西安 710004;2空军军医大学唐都医院眼科,西安 710038;3重庆医科大学附属第二医院眼科,重庆 400010
老化、辐射、遗传、中毒、外伤、免疫、局部代谢和营养障碍等各种内外源因素均可导致白内障。白内障的致病因素众多,发病机制尚不清楚。氧化应激和自由基损伤是各种因素导致白内障发生的共同途径[1]。近年的研究证实,健康晶状体上皮细胞(lens epithelial cells,LECs)内存在多重抗氧化防线,致病因素产生的自由基会被晶状体内第一道防线,即抗氧化物和抗氧化酶清理,当抗氧化酶被消耗,第二道防线,即抗氧化酶修复系统将被激活。第二道防线主要包括硫醇转移酶/谷氧还蛋白(thioltransferase/glutaredoxin,TTase/Grxs)和硫氧还蛋白/硫氧还蛋白还原酶(thioredoxin/thioredoxin reductase,Trxs/TrxsR)动态系统,其通过控制硫醇/二硫化物的含量,修复晶状体氧化/抗氧化动态平衡[2]。TTase/Grxs存在2种亚型,包括分布在细胞质中的谷氧还蛋白1(glutaredoxin 1,Grx1)和分布在线粒体及细胞核中的Grx2。Grx1和Grx2是同工酶,均可发生脱硫醇反应,修复抗氧化酶和抗氧化物,维持抗氧化动态平衡[3-4]。Grx2是清除自由基、修复LECs、保护LECs活性和防治白内障形成的重要物质[5]。然而,目前仍缺乏Grx2抑制晶状体混浊在组织及动物层面的证据。本研究通过成簇规律间隔短回文重复序列/CRISPR相关基因位点9系统(clustered regularly interspaced short palindromic repeats/CRISPR-associated 9,CRISPR/Cas9)建立Grx2基因敲除(knockout,KO)和基因敲入(knockin,KI)小鼠模型,观察小鼠晶状体混浊的发生和发展情况,探讨Grx2在白内障发病机制中的作用,以期为白内障的药物防治研究提供新思路。
1 材料与方法
1.1 材料
1.1.1实验动物 将10只清洁级黑色C57BL/6J品系雄鼠(重庆医科大学附属第二医院动物中心提供)平均分为2个组,分别进行Grx2KO和KI。饲养于清洁级层流动物房内,光照时间为6:00—18:00,室温20 ℃。采用无菌饮用水、饲料和敷料饲养。实验动物及饲养环境达到国家标准《实验动物环境及设施》(GB14925)。实验动物的使用和喂养遵循国家科学技术委员会颁布的《实验动物管理条例》,本研究方案经重庆医科大学附属第二医院伦理委员会审批[批文号:2020年科伦审第(125)号]。
1.1.2主要试剂及仪器 REDExtract-N-Amp Tissue PCR试剂盒(美国Sigma公司);BCA蛋白浓度测定试剂盒(美国Pierce公司);小鼠Grx2抗体(ab167207)、小鼠谷胱甘肽(glutathione,GSH)单克隆抗体(ab19534)(美国Abcam公司);兔二硫化谷胱甘肽(glutathione disulfide,GSSG)多克隆抗体(AB5010,美国Sigma-Aldrich公司);β-actin(GB11001),HRP标记的山羊抗小鼠(G1214)、山羊抗兔二抗(G1213)(武汉赛维尔生物科技有限公司);兔B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)多克隆抗体(26593-1-AP)、兔Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)多克隆抗体(50599-2-Ig)(武汉三鹰生物技术有限公司);DCFH-DA(上海碧云天生物技术有限公司);活性氧簇(reactive oxygen species,ROS)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海酶联生物科技有限公司);8-羟基脱氧鸟苷(8-hydroxy-desoxyguanosine,8-OHdG)ELISA试剂盒(武汉伊莱瑞特生物技术有限公司)。PCR仪(美国Bio-Rad公司);裂隙灯显微镜(SL130型,德国Carl Zeiss公司);光学显微镜(CKX53型,日本Olympus公司);荧光分光光度仪(美国Epoch公司);ECL蛋白质印迹检测系统(美国Thermo Scientific公司)。
1.2 方法
1.2.1Grx2KO小鼠模型的建立 使用CRISPR/Cas9系统[6],参考文献[7]方法敲除Grx2基因。主要步骤包括:(1)载体设计和构建 主要包括设计小向导RNA(small guide RNA,sgRNA)识别序列以及构建sgRNA质粒并进行测序验证。(2)体外转录 主要包括Cas9、sgRNA质粒的提取和纯化以及其体外转录和纯化。(3)原核注射 主要包括小鼠的超数排卵,注射受精卵后移植,得到F0代小鼠。(4)小鼠基因鉴定 主要包括通过PCR和测序验证Grx2KO小鼠,并进一步测序明确突变序列。
1.2.2Grx2KI小鼠模型的建立 利用CRISPR/Cas9系统和同源重组载体(Donor vector)将Grx2基因插入到目标链特定的位置。主要步骤包括:(1)制作向导RNA(guide RNA,gRNA)和Donor vector 准备CRISPR/Cas9系统需要使用的质粒,设计完成gRNA,并在小鼠体外进行转录,完成Donor vector的制备。(2)小鼠受精卵注射 给予小鼠体外受精获得受精卵,向受精卵显微注射准备好的gRNA、Donor vector和Cas9蛋白。(3)受精卵内CRISPR/Cas9系统开始工作 gRNA负责引导,Cas9蛋白负责在双链DNA特定位点进行剪切,Donor vector负责插入Grx2基因并修复双链DNA[8]。
1.2.3实验小鼠的繁殖及测序 杂合子、品系为C57BL/6J-Grx2KO和C57BL/6J-Grx2KI小鼠饲养于清洁级层流动物房内。剪脚趾进行标号,记录,前肢表示十位数,后肢表示个位数。使用无菌处理的水、食物和垫料,分隔饲养。1月龄发情期后,采用1雄1雌自然配繁。扩繁至5个隔离笼后供给后续实验。母鼠经过约20 d孕期,生育小鼠,小鼠1周龄后分笼饲养,发育可。采用REDExtract-N-Amp Tissue PCR试剂盒进行小鼠基因测序。纯合子Grx2KO的小鼠2条DNA条带都发生了Grx2基因序列的缺失,因此基因型记录为KO-KO;同理,野生型(wild type,WT)小鼠基因型记录为WT-WT,Grx2KO杂合子小鼠基因型记录为KO-WT,纯合子Grx2KI小鼠基因型记录为KI-KI,Grx2KI杂合子小鼠基因型记录为KI-WT。
1.2.4裂隙灯显微镜观察小鼠晶状体混浊情况 每周使用裂隙灯显微镜观察Grx2KO、Grx2KI和C57BL/6JWT小鼠晶状体混浊情况,至5月龄时观察结束。给予小鼠局部联合质量分数0.5%托吡卡胺和0.5%去氧肾上腺素滴眼液点眼,充分扩瞳,1次/5 min,共3次,15 min后,采用裂隙灯显微镜裂隙光源15°入射角,正面观察小鼠晶状体,记录晶状体混浊的部位和程度。参考牛津大学离体大鼠晶状体分级系统[9]对小鼠晶状体进行分级:晶状体完全透明为0级;晶状体透明但皮质出现散在空泡为1级;晶状体核密度轻度增加,晶状体囊膜开始混浊,皮质出现较多空泡为2级;晶状体核密度增加,皮质出现白色片状混浊为3级;晶状体完全呈现白色混浊为4级。
1.2.5苏木精-伊红染色法观察小鼠晶状体、心脏、脑、肝脏和肌肉组织病理学改变 饲养第19个月,使用CO2处死实验小鼠,同时摘出眼球,使用解剖显微镜和显微眼科手术器械,从赤道部剪开小鼠眼球,完整剥离晶状体,不损伤晶状体囊膜,立即使用电子天平测量小鼠晶状体质量,随机选取5枚晶状体放入含有质量分数4%多聚甲醛的塑料包埋盒内,标号,保存,给予苏木精-伊红染色,其余晶状体均用干冰冷冻干燥,放入-80 ℃冰箱保存待用。摘出眼球后,用眼科剪解剖小鼠,取出小鼠的心脏、大脑、肝脏和肌肉等代谢旺盛组织。用眼科剪将组织分割成5 mm×5 mm×2 mm大小,立即放入含有4%多聚甲醛的塑料包埋盒内,标号,保存,进行苏木精-伊红染色。光学显微镜下观察各组织病理学改变。
1.2.6ELISA法测定小鼠晶状体ROS和8-OHdG含量 将-80 ℃冰箱保存的晶状体裂解,匀浆,取上清液,分别采用ROS和8-OHdG ELISA试剂盒说明书操作方法进行检测。采用荧光分光光度仪测量晶状体内ROS和8-OHdG含量。
1.2.7Western blot法测定小鼠晶状体氧化应激相关指标蛋白相对表达量 提取晶状体蛋白溶液,BCA法测定蛋白浓度,等量蛋白在质量分数12%聚丙烯酰胺凝胶上进行SDS-PAGE凝胶电泳,转印至PVDF膜。按照Grx2、GSH、Bcl-2、GSSG、Bax、β-actin一抗稀释比例均为1∶ 1 000,4 ℃孵育8 h;二抗稀释比例均为1∶ 4 000,室温孵育2 h。使用ECL蛋白印迹检测系统进行检测,通过ImageJ图像灰度值分析Grx2、GSH、Bcl-2、Bax蛋白表达水平。以β-actin为内参,计算蛋白相对表达量。
1.3 统计学方法
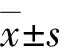
2 结果
2.1 Grx2 KO小鼠基因测序
F1代18#~31#小鼠DNA电泳结果显示,26#、28#、30#、31#小鼠在580 bp和883 bp扩增出2个条带,为KO-WT小鼠(图1)。Grx2KO小鼠F2代基因鉴定电泳结果显示,KO-KO扩增出580 bp 1个条带,WT-WT扩增出883 bp 1个条带,KO-WT扩增出580 bp和883 bp 2个条带(图2)。

图1 Grx2 KO F1代小鼠PCR扩增产物电泳图 Grx2 KO小鼠扩增出580 bp和883 bp 2个条带 数字为鼠尾号,B6为阴性对照,N为空白对照Figure 1 Electrophoretogram of PCR amplicon for Grx2 KO F1 mice A 580 bp and an 883 bp fragments were amplified from Grx2 KO mice.Numbers were mouse tail marking numbers.B6 was negative control,and N was blank control
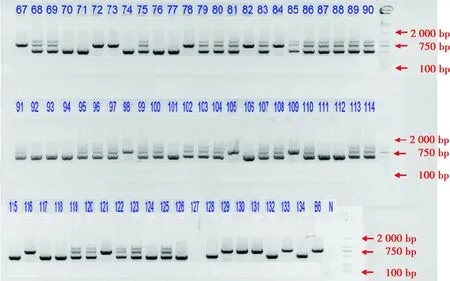
图2 Grx2 KO F2代小鼠PCR扩增产物电泳图 KO-KO扩增出580 bp条带,WT-WT扩增出883 bp条带,KO-WT扩增出580 bp和883 bp 2个条带 数字为鼠编号,B6为阴性对照,N为空白对照Figure 2 Electrophoretogram of PCR amplicon of Grx2 KO F2 mice KO-KO amplified a 580 bp fragment.WT-WT amplified an 883 bp fragment.KO-WT amplified a 580 bp and an 883 bp fragments.Numbers were mouse marking numbers.B6 was negative control,and N was blank control
2.2 Grx2 KI小鼠基因测序
对Grx2KI小鼠进行基因扩增,经PCR扩增和测序确认,110#、113#、114#、115#、118#小鼠为KI-KI纯合子F2代小鼠(图3)。
2.3 小鼠一般情况
对Grx2KO小鼠和Grx2KI小鼠进行培育,获得小鼠数量见表1。Grx2KO小鼠、Grx2KI小鼠和WT小鼠均状况良好,在大小、习性、体质量及生长发育方面,3种基因型小鼠相似。1~19月龄时,同月龄Grx2KO、Grx2KI和WT小鼠晶状体质量比较,差异均无统计学意义(均P>0.05)(图4)。

图3 Grx2 KI F2代小鼠PCR引物电泳图 KI-KI扩增出1 465 bp和2 292 bp,WT-WT扩增出412 bp,KO-WT扩增出所有条带 数字为鼠尾号,P为阳性对照,WT为C57BL/6J野生型,N为空白对照,M为DNA marker,5'arm为基因的5'端,3'arm为基因的3'端,WT为野生型基因片段Figure 3 Electrophoretogram of PCR primers of Grx2 KI F2 mice A 1 465 bp and a 2 292 bp fragments were amplified from the KI-KI mouse.A 412 bp fragment was amplified from the WT-WT mouse.All fragments were amplified from the KO-WT mouse.Numbers were mouse tail marking numbers.P was for positive control,WT for wild-type C57BL/6J mouse,N for blank control,M for DNA Marker.5' arm was the 5' end of the gene, and 3' arm was the 3' end of the gene,and WT indicated wild-type gene fragment
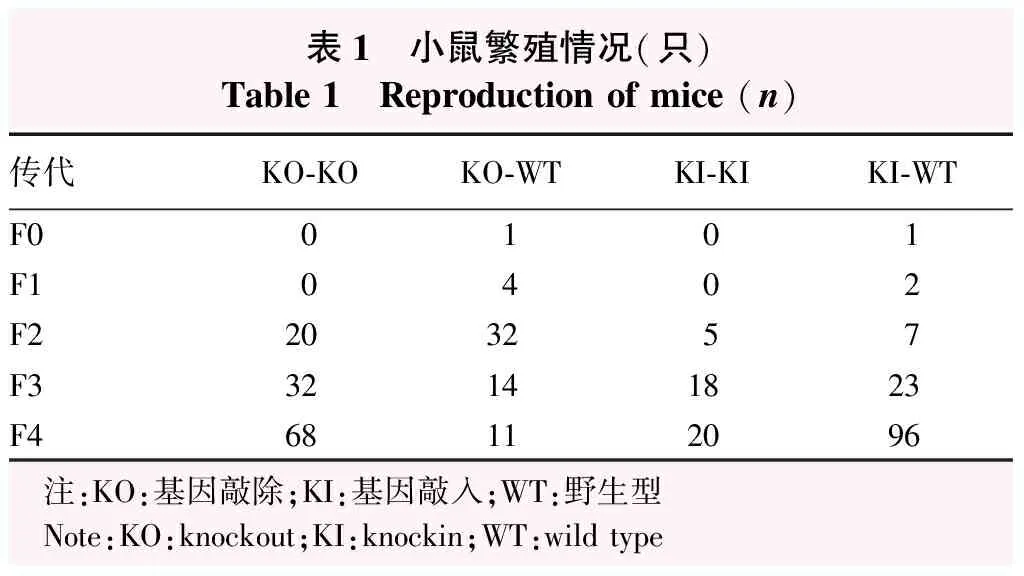
表1 小鼠繁殖情况(只)Table 1 Reproduction of mice (n)传代KO-KOKO-WTKI-KIKI-WTF00101F10402F2203257F332141823F468112096 注:KO:基因敲除;KI:基因敲入;WT:野生型 Note:KO:knockout;KI:knockin;WT:wild type
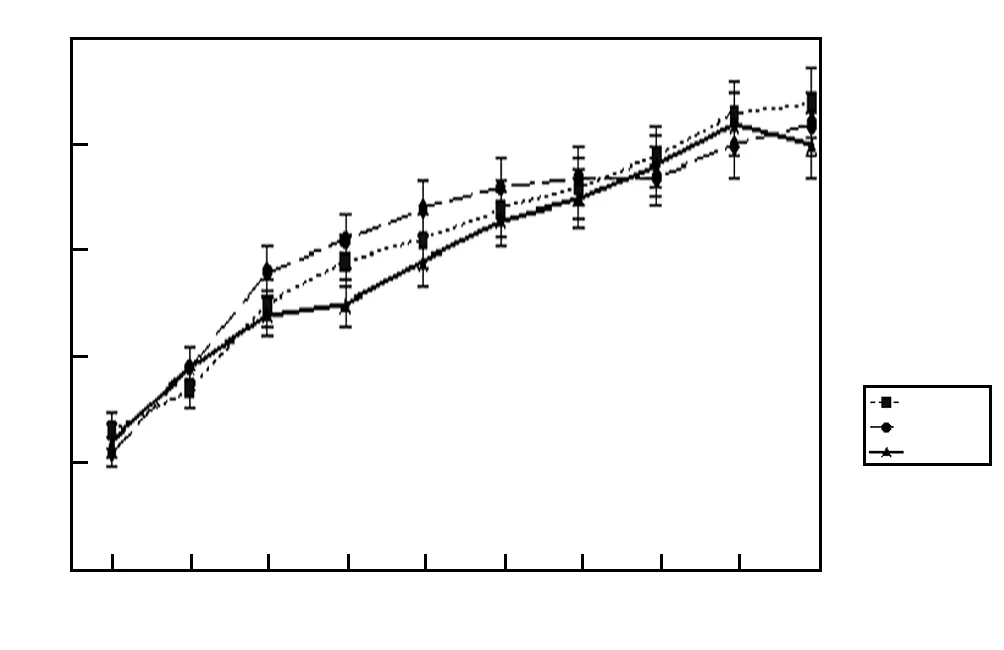
图4 小鼠晶状体质量比较 F=0.469,P=0.739(单因素方差分析) 1~19月龄时,同月龄各组小鼠晶状体质量比较差异均无统计学意义(均P>0.05) WT:野生型(n=120);KO:基因敲除(n=136);KI:基因敲入(n=40)Figure 4 Body weight comparison of mouse lens F=0.469,P=0.739 (One-way ANOVA) From 1 to 19 months,no significant difference was found in lens weight among mice of the same age (all at P>0.05) WT:wild type (n=120);KO:knockout (n=136);KI:knockin (n=40)
2.4 不同基因型小鼠晶状体表现
最初2个月,Grx2KO、Grx2KI和WT小鼠晶状体均保持透明。3月龄时,Grx2KO小鼠晶状体周边仅出现少量空泡;4月龄时,开始出现轻微核密度增加;5月龄时,Grx2KO小鼠晶状体出现片状混浊,仅1只小鼠出现完全混浊。WT小鼠5月龄时,晶状体周边仅有少量空泡出现。Grx2KI小鼠晶状体一直保持透明(图5,表2)。
2.5 不同基因型小鼠晶状体组织病理学改变
苏木精-伊红染色结果显示,5月龄小鼠晶状体LECs呈深色,位于浅层皮质;晶状体纤维规则排列,呈红色。组织病理学染色结果显示,Grx2KO小鼠与Grx2KI、WT小鼠相比,晶状体纤维水肿,可见晶状体纤维断裂、纤维间出现空泡和缝隙(图6)。
2.6 不同基因型小鼠心脏、脑、肝脏、肌肉的组织病理学变化
5月龄时,Grx2KO和Grx2KI小鼠心、脑、肝脏、肌肉未见明显损害,Grx2KO小鼠组织纤维间隙略增加,但与Grx2KI和WT小鼠相比,无明显变化(图7)。
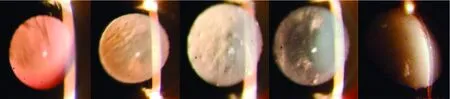
图5 参考牛津大学大鼠晶状体分级系统[9]对小鼠晶状体混浊程度分级 A:0级 B:1级 C:2级 D:3级 E:4级Figure 5 Opacity degree grading of mouse lens according to Oxford Clinical Cataract Classification and Grading System[9] A:Grade 0 B:Grade 1 C:Grade 2 D:Grade 3 E:Grade 4

表2 3种基因型小鼠晶状体混浊级别比较[M(Q1,Q3)]Table 2 Comparison of lens opacity grade among Grx2 KO,Grx2 KI and WT mice (M[Q1,Q3])基因型眼数1月龄2月龄3月龄4月龄5月龄Grx2 KO400(0,0)0(0,1)1(0,2)2(1,3)3(1,4)Grx2 KI400(0,0)0(0,0)0(0,0)0(0,0)0(0,0)WT600(0,0)0(0,0)0(0,1)1(0,2)1(0,2) 注:KO:基因敲除;KI:基因敲入;WT:野生型 Note:KO:knockout;KI:knockin;WT:wild type
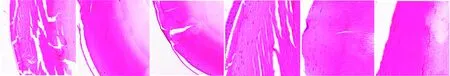
图6 各基因型小鼠晶状体组织病理变化(HE) 与WT小鼠和Grx2 KI小鼠相比,Grx2 KO小鼠晶状体纤维断裂,纤维间出现空泡和缝隙 A:Grx2 KO (×100,标尺=1 000 μm) B:WT (×100,标尺=1 000 μm) C:Grx2 KI (×100,标尺=1 000 μm) D:Grx2 KO (×200,标尺=500 μm) E:WT (×200,标尺=500 μm) F:Grx2 KI (×200,标尺=500 μm)Figure 6 Histopathological changes of lens in Grx2 KO,Grx2 KI and WT mice (HE) Compared with WT and Grx2 KI mice,the lens fibers of Grx2 KO mice were fractured with vacuoles and gaps between fibers A:Grx2 KO (×100,bar=1 000 μm) B:WT (×100,bar=1 000 μm) C:Grx2 KI (×100,bar=1 000 μm) D:Grx2 KO (×200,bar=500 μm) E:WT (×200,bar=500 μm) F:Grx2 KI (×200,bar=500 μm)
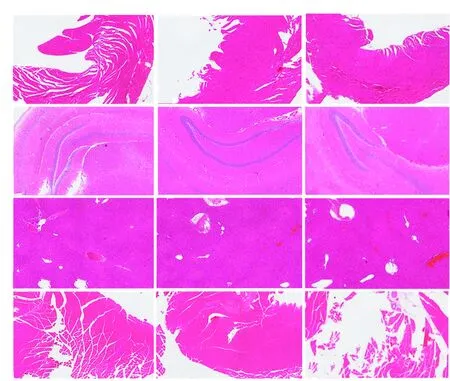
图7 各基因型小鼠心脏、脑、肝脏、肌肉的组织病理学变化(HE ×200,标尺=500 μm) 与WT小鼠和Grx2 KI小鼠相比,Grx2 KO小鼠组织纤维间隙略增加 KO:基因敲除;WT:野生型;KI:基因敲入Figure 7 Pathological changes of heart,brain,liver and muscle in Grx2 KO,Grx2 KI and WT mice (HE ×200,bar=500 μm) Compared with WT and Grx2 KI mice,the fiber space of Grx2 KO mice was slightly increased KO:knockout;WT:wild type;KI:knockin

图8 Grx2 KO小鼠与WT小鼠晶状体中8-OHdG和ROS含量比较(独立样本t检验,n=3) 与WT小鼠比较,a P<0.05 A:8-OHdG B:ROS 8-OHdG:8-羟基脱氧鸟苷;WT:野生型;KO:基因敲除;ROS:活性氧簇Figure 8 Comparison of 8-OHdG and ROS content in lens between Grx2 KO and WT mice (Independent samples t test,n=3) Compared with WT mice,a P<0.05 A:8-OHdG B:ROS 8-OHdG:8-hydroxy-deoxyguanosine;WT:wild type;KO:knockout;ROS:reactive oxygen species
2.7 Grx2 KO小鼠与WT小鼠晶状体8-OHdG和ROS含量比较
5月龄Grx2KO小鼠晶状体8-OHdG含量为(3.886±0.326)ng/ml,高于WT小鼠的(3.531±0.250)ng/ml,差异有统计学意义(t=2.711,P=0.033)(图8)。Grx2KO小鼠晶状体ROS荧光强度为1 594±132,高于WT小鼠的1 157±123,差异有统计学意义(t=3.384,P=0.028)(图9)。
2.9 Grx2 KO小鼠与WT小鼠晶状体Grx2、Bcl-2、GSH、GSSG、Bax蛋白相对表达量比较
5月龄Grx2KO小鼠晶状体中Grx2、GSH和Bcl-2相对表达量分别为0.23±0.01、0.70±0.06和0.32±0.03,较WT小鼠的0.52±0.02、1.04±0.08和0.49±0.04下降,差异均有统计学意义(t=2.815,P=0.020;t=2.457,P=0.033;t=2.279,P=0.041);Grx2KO小鼠晶状体中GSSG和Bax相对表达量分别为0.34±0.03和0.16±0.01,与WT小鼠的0.41±0.03和0.18±0.01比较,差异均无统计学意义(t=0.933、0.752,均P>0.05)(图9)。

图9 Grx2 KO小鼠与WT小鼠晶状体中Grx2、Bcl-2、GSSG、GSH和Bax蛋白表达比较 A:Western blot电泳图 B:Grx2、Bcl-2、GSSG、GSH和Bax蛋白相对表达量比较 与WT小鼠比较,a P<0.05(独立样本t检验,n=3) WT:野生型;KO:基因敲除;GSSG:二硫化谷胱甘肽;GSH:谷胱甘肽;Bcl-2:B淋巴细胞瘤-2基因;Bax:Bcl-2相关X蛋白Figure 9 Comparison of Grx2,Bcl-2,GSSG,GSH and Bax relative expressions in lens between Grx2 KO and WT mice A:Western blot electrophoretogram B:Comparison of relative expressions of Grx2,Bcl-2,GSSG,GSH and Bax Compared with WT mice,a P<0.05 (Independent samples t test,n=3) WT:wild type;KO:knockout;GSSG:glutathione disulfide;GSH:glutathione;Bcl-2:B cell lymphoma-2 gene;Bax:Bcl-2-associated X protein
3 讨论
Grx存在多样性,其中Grx2有3种亚型,Grx3和Grx5有2种亚型[10]。Grx2广泛表达于人体器官内,参与细胞抗氧化的第二道防线,修复细胞内的GSH/GSSG动态平衡,恢复体内的氧化/抗氧化稳定状态[11-12]。正常生理状态下,2分子Grx2和2分子GSH通过硫铁簇相互结合成二聚体的结晶状态,对细胞内的氧化应激更为敏感。当活性氧自由基出现,晶状体空间构型立刻还原为2分子GSH和2分子Grx2,分别发挥抗氧化作用[13-14]。Grx2广泛分布在人体器官中,其中角膜、虹膜、晶状体、视网膜及视神经中均已发现了Grx2的表达[15]。
线粒体与LECs的代谢、分裂、增生和分化密切相关,对维持晶状体正常生理功能发挥着巨大作用[16-17]。分布在线粒体中的同工酶Grx2可直接保护晶状体蛋白和酶,其通过调控细胞内的巯基维持晶状体透明状态。近年来,基因敲除小鼠是国内外进行基因及相应蛋白功能研究的热点。本课题组2010年与美国内布拉斯加州大学合作,首次以Grx1基因敲除小鼠作为模型,对其白内障的发生情况及各生化指标随年龄的变化进行了观察和研究[18-19],为Grx1基因敲除小鼠的制作和繁育积累了一定经验。Wu等[7]采用ES打靶法构建Grx2敲除小鼠模型,发现小鼠3月龄时开始出现晶状体混浊。为了进一步探明Grx2基因在白内障发病中的作用,2014年美国内布拉斯加州大学Marjorie F.Lou教授再次采用CRISPR/Cas9系统制作了Grx2基因敲除小鼠,探明白内障的形成和线粒体功能的关系[20]。与ES打靶法相比,CRISPR/Cas9系统在敲除鼠中有一定的优势,缩短了基因鼠的构建周期。但在Grx2基因敲除的策略上,两者都选择了敲除外显子2。在敲除的效果上,2种敲除方法对Grx2蛋白表达量影响无明显差异。本课题组与Marjorie F.Lou教授继续合作,制作B6J-Grx2KO小鼠,并在国际上首次制作了B6J-Grx2KI小鼠,利用B6J-Grx2KO和B6J-Grx2KI小鼠模型,研究白内障发生过程中Grx2担任的角色和抑制晶状体混浊的分子机制。
本研究中,Grx2KO小鼠发育正常,除了体质量略轻于WT小鼠外,未见其他全身性变化。这一现象在Grx家族另一成员Grx1KO小鼠中也有表现[21]。线粒体是主要的能量代谢场所,为了解Grx2KO小鼠是否有全身性异常,本研究对小鼠代谢旺盛的部位(心脏、大脑、肝脏和肌肉)均进行组织病理学分析,结果显示Grx2KO和Grx2KI小鼠各个器官并未见明显异常,这说明Grx2基因的缺失或表达上调均未导致线粒体形态异常,未引起细胞病理改变。
然而对晶状体进行观察时,却发现从3月龄开始,Grx2KO小鼠晶状体出现了少量空泡,从4月龄到5月龄,Grx2KO小鼠晶状体混浊加快。同一年龄段的WT小鼠晶状体只有少许空泡出现。然而,观察的5个月内,Grx2KI小鼠晶状体一直保持透明。晶状体无血管和神经分布,主要起屈光折射和调节作用。成年小鼠晶状体会进入一个快速的生长和分化期,各种内源性、外源性应激条件均可诱导晶状体蛋白聚集,最终导致白内障发生,氧化应激就是其中的主要损伤形式之一[22]。晶状体内的氧化损伤和抗氧化修复的动态平衡是维持晶状体透明的原因。本研究中对Grx2KO小鼠晶状体的ROS水平进行分析,发现其远高于WT小鼠。对DNA氧化损伤标志物8-OHdG水平进行检测,证实Grx2KO小鼠晶状体的8-OHdG表达上调。GSH系统是晶状体内小分子抗氧化物,是晶状体内抗氧化还原平衡主要参与者,还是保护蛋白质的巯基与GSSP平衡的关键蛋白。对Grx2KO小鼠晶状体的GSH系统进行分析证明,与WT小鼠相比,Bcl-2、GSH、Bax蛋白表达水平均下降,这说明作为Grx1的同工酶,Grx2具有相类似的维持GSH/GSSG平衡的作用。
综上所述,本研究通过建立Grx2KO和Grx2KI小鼠模型,发现Grx2KO可以加速年龄相关性白内障的发生,同时证实Grx2参与了细胞氧化损伤的修复。本研究揭示了Grx2对小鼠正常晶状体生理功能起保护作用。Grx2能够抑制ROS的产生,下调8-OHdG的表达,并且能够保护还原态的GSH,修复氧化态的GSSG。Grx2在修复晶状体氧化损伤和维持晶状体的透明过程中发挥了重要作用。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明郭勇:参与实验设计、实施研究、论文撰写;郭辰峻:实验操作、论文修改;张婕:论文修改;宁小娜:统计数据;严宏:实验设计、论文修改及定稿;陈曦:动物饲养

