基于六邻体蛋白及纤维蛋白序列测定的腺病毒性结膜炎分类分析
王旌 朱剑锋 陆丽娜
上海市眼病防治中心/上海市眼科医院 上海市第一人民医院 国家眼部疾病临床医学研究中心 上海市眼底病重点实验室 上海眼视觉与光医学工程技术研究中心 上海市眼科疾病精准诊疗工程技术研究中心,上海 200040
腺病毒性结膜炎好发季节为春末至秋初,分为流行性角结膜炎(epidemic keratoconjunctivitis,EKC)、咽结膜热(pharyngeal conjunctival fever,PCF)和单纯滤泡性结膜炎,均可通过接触传播[1]。EKC和PCF在密闭环境和高密度人群中极易传播和流行,甚至爆发。人类腺病毒(human adenovirus,HAdV)是EKC的主要病原体[2],其分型与腺病毒性结膜炎的分型、临床表现和预后密切相关。目前,基因鉴定技术已基本替代了传统血清学检测用于腺病毒检测,其中,六邻体蛋白是常见检测靶点,可对腺病毒进行初步分型,其次是纤维蛋白和五邻体蛋白,针对纤维蛋白的检测能够预测腺病毒的角膜致病性。与单基因测序相比,六邻体蛋白及纤维蛋白联合测序和系统发育分析能够更好地推断出HAdV分型,以及HAdV对角膜结膜上皮的黏附力和致病力[3]。腺病毒多基因联合测序系统进一步的系统发育分析研究较少。本研究对六邻体蛋白和纤维蛋白进行联合测序及系统发育分析,以期提高腺病毒性结膜炎分型检测的敏感性,为准确预判流行特征、指导个性化用药提供新的方法。
1 材料与方法
1.1 材料
1.1.1标本来源 收集2015年1月至2017年8月于上海市眼病防治中心或上海市红眼病防控办公室下属红眼病监测站点就诊来自上海市城区及周边县区的可疑病毒性结膜炎患者256例,其中男132例,女124例。病毒性结膜炎诊断标准:(1)急性结膜充血、水肿,起病后约1周达发病高峰,对局部抗生素治疗不敏感;(2)大量结膜滤泡;(3)大量水样分泌物;(4)可能伴耳前淋巴结肿大、压痛;(5)早期可能伴角膜上皮微囊样病变,进而发展成角膜上皮浸润,甚至角膜上皮下浅基质层白色局部病灶;(6)可能伴上呼吸道感染;(7)可能出现结膜伪膜。本研究经上海市第一人民医院伦理委员会审核批准(批文号:2020科202),所有被检者均对本研究目的和过程知情并自愿签署知情同意书。
1.1.2主要试剂及仪器 Hank缓冲液(美国Gibco公司);QIA-amp mini试剂盒(美国Qiagen公司);标准相对分子质量DNA、PCR反应缓冲液(美国Invitrogen公司);TaqDNA聚合酶(5 U/μl,商品单位)、三磷酸脱氧核糖核苷(deoxy-ribonucleoside triphosphate,dNTP)(10 μmol/μl,美国Roche公司);BigDye Terminator试剂盒(美国ABI公司)。紫外分析仪(LMS-20,美国UVP公司);UV-240紫外分光光度计(Nanodrop 2000,美国ThermoFisher公司);PCR仪(T100,美国Bio-Rad公司);测序仪(3130xl,美国ABI公司)。
1.2 方法
1.2.1标本采集 用蘸取生理盐水的棉签擦拭患者下穹隆部结膜囊。棉签保存在含有50 mg/ml庆大霉素、500 U/ml青霉素、1 mg/ml两性霉素B和质量分数5%牛血清蛋白的Hank缓冲液中。
1.2.2HAdV基因组DNA的提取和保存 采用QIA-amp mini试剂盒提取病毒基因组DNA,-20 ℃冰箱内保存。通过质量分数1%琼脂糖凝胶电泳,与标准相对分子质量DNA对比,在紫外分析仪下观察,可见1条边界清楚的金黄色荧光条带,长度约35 000 bp,无拖尾现象,说明DNA纯度和完整性俱佳。采用UV-240紫外分光光度计检测DNA的A260/A280值为1.7~1.8,说明DNA样品未受到蛋白质、RNA和碳水化合物等污染。DNA样品质量浓度(μg/μl)=A260×稀释倍数×50/1 000。将部分DNA样本稀释至10 ng/μl以备PCR使用。剩余DNA于-20 ℃长期保存。
1.2.3HAdV六邻体蛋白基因测序 对256份样本分别进行六邻体蛋白PCR扩增,其正向引物序列为5'-AAAGTCTCTCAAACGCCGAC-3',反向引物序列为5'-CTCCTGTTCGCTTGAACCCA-3'。反应体系为20 μl,包括5 U/μl TaqDNA聚合酶0.1 μl,含Mg2+的PCR反应缓冲液2.0 μl,10 mol/L dNTP 0.5 μl,10 μmol/μl上、下游引物各0.5 μl,ddH2O 11.4 μl,10 ng/μl模板DNA 5.0 μl。反应条件:95 ℃预变性5 min;95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸1 min,共30个循环;72 ℃延伸5 min后冷却至4 ℃保存。扩增产物经1%琼脂糖凝胶电泳后,紫外分析仪上成像并摄片,显示目的片段清晰。六邻体蛋白PCR扩增产物长度约为3 000 bp,无特异条带,估测质量浓度在30 ng/μl以上。将PCR产物纯化后,采用BigDye Terminator试剂盒进行测序反应,测序引物即为正向引物。测序反应体系为10 μl,包括PCR产物和测序引物各1 μl,Terminator Ready Reaction Mix 8 μl。采用3130xl型测序仪进行电泳分析。将所测得基因序列与NCBI GenBank数据库(blast.ncbi.nlm.nih.gov)中已提交基因序列进行比对,初步确定HAdV血清型。
1.2.4HAdV纤维蛋白基因测序 对六邻体蛋白PCR扩增阳性标本进行纤维蛋白的PCR扩增和测序,其正向引物、反向引物见表1。PCR反应体系与六邻体蛋白相同。用上述方法经1%琼脂糖凝胶电泳后得到纤维蛋白PCR扩增产物,长度约为1 500 bp,无特异条带,估测质量浓度在30 ng/μl以上。采用1.2.3部分相同的纯化和测序反应进行基因测序。测序结果通过以74种HAdV原型作为参考,对六邻体蛋白及纤维蛋白序列进行系统发育分析。
1.2.5系统发育分析 从GenBank获取74种HAdV原型作为参考,其分型及登录号包括C1(AF534906)、C2(NC_001405)、B3(NC_011203)、E4(NC_003266)、C5(AY339865)、C6(FJ349096)、B7(AC_000018)、D8(AB448767)、D9(AJ854486)、D10(AB695622)、B11(FJ597732.1)、A12(X73487)、D13(JN226747)、B14(AY803294)、D15(JN226748)、B16(AY601636)、D17(AF108105)、A18(GU191019)、D19(JQ326209)、D20(JN226749)、B21(AY601633)、D22(FJ404771)、D23(JN226750)、D24(JN226751)、D25(JN226752)、D26(EF153474)、D27(JN226753)、D28(FJ824826)、D29(JN226754)、D30(JN226755)、A31(AM749299)、D32(JN226756)、D33(JN226758)、B34(AY737797)、B35(NC_004001)、D36(GO384080)、D37(DQ900900)、D38(JN226759)、D39(JN226760)、F40(NC_001454)、F41(AB728839)、D42(JN226761)、D43(JN226762)、D44(JN226763)、D45(JN226764)、D46(AY875648)、D47(JN226757)、D48(EF153473)、D49(DQ393829)、B50(AY737798)、D51(JN226765)、G52(DQ923122)、D53(FJ169625)、D54(NC_012959)、B55(FJ643676)、D56(HM770721)、C57(HQ003817)、D58(HQ883276)、D59(JF799911)、D60(HQ007053)、A61(JF964962)、D62(JN162671)、D63(JN935766)、D64(EF121005)、D65(AP012285)、B66(JN860676)、D67(AP012302)、B68(JN860678)、D69(JN226748)、D70(KP641339)、D71(KF268207)、D72(KF268335)、B79(AY601636)、D81(AB765926)。采用MEGA7.0.26软件对样本的六邻体蛋白及纤维蛋白序列进行分析,并与74株HAdV原型进行比对。采用最大似然比程序构建纤维蛋白和六邻体蛋白基因的系统发育树;采用1 000个自引复制验证树的可靠性,利用Kimura-2参数计算遗传距离。

表1 7种人类腺病毒的纤维基因引物Table 1 Fiber gene primers for seven types of humanadenoviruses腺病毒种类引物序列(5'-3')扩增片段长度(bp)A 正向引物:TTCCCAATCCCTACCCACCAT反向引物:AAAGGGGGAAAGGGAGGTAT1 918B 正向引物:TTCCCAATCCCTACCCACCAT反向引物:AAAGGGGGAAAGGGAGGTAT1 111C 正向引物:AGATTCCTCTTGTTCCTGCCC反向引物:TGGGAAGGGGGAGGCAAAAT1 891D 正向引物:GTCCACAATTTTCATTGTCTTCCCT反向引物:CATCTCAATCACCGACCCCC1 348E 正向引物:TGTCAAATTCCTCCTGTCCCTC反向引物:AAAGGTGGGTTGGCATGCAG1 352F、G 正向引物:AGGCGCAATCTTCGCATTTC反向引物:GGGGGAGGGAGATTAACGG1 745
考虑到HAdV-D8、HAdV-D19和HAdV-D37为腺病毒性结膜炎,尤其是流行性角结膜炎的重要病原体,因此,HAdV和非HAdV分别构建发育树,以方便图形展示。在非HAdV构建系统发育树时,将HAdV-D8、HAdV-D19和HAdV-D37原型序列作为HAdV-D的代表性序列,以展示HAdV-D与其他腺病毒序列的系统发育关系。
2 结果
2.1 HAdV的分型与临床表现
89例患者样本可扩增得到约3 000 bp的清晰条带,占34.8%,表明此89例样本中含有HAdV DNA。将六邻体蛋白基因序列与NCBI数据库比对,确定此89例患者中HAdV-C1 1例、HAdV-C2 7例、HAdV-B3 20例、HAdV-E4 6例、HAdV-D8 23例、HAdV-D19 17例、HAdV-D37 15例,分别占1.12%、7.87%、22.47%、6.74%、25.84%、19.10%和16.85%。
HAdV-C1和HAdV-C2患者均表现为单纯滤泡性结膜炎。HAdV-B3患者伴耳前淋巴结肿大压痛、上呼吸道感染、轻度角膜上皮浸润者分别为13、10和5例,HAdV-E4患者伴上述改变者分别为3、4和1例。伴轻度角膜上皮浸润的HAdV-B3和HAdV-E4患者均未发展为浅基质层白色病灶。HAdV-D8、HAdV-D19和HAdV-D37患者伴耳前淋巴结肿大压痛者分别有15、10和8例,伴结膜伪膜者分别有6、4和3例,伴轻度角膜上皮浸润者分别有13、8和8例,伴浅基质层白色病灶者分别有7、4和3例(表2)。
2.2 HAdV系统发育分析
在六邻体蛋白序列系统发育分析中,此89例患者序列均与相应参考序列原型聚集。除2例HAdV-D8样本与参考序列间遗传距离为0.04和0.01外,其余样本与原型间遗传距离皆小于0.001(图1,2)。
进一步纤维蛋白序列系统发育分析显示,HAdV-D19和HAdV-D37的参考序列接近,遗传距离<0.01,二者样本存在交叉聚集,1例HAdV-D37样本与HAdV-D19参考序列原型聚集,15例HAdV-D19样本与HAdV-D37参考序列原型聚集,其余样本,包括HAdV-C1、HAdV-C2、HAdV-B3、HAdV-E4和HAdV-D8均与相应的参考序列原型聚集(图1,2)。纤维蛋白聚集情况不同的HAdV-D19和HAdV-D37阳性病例临床体征占比差别不明显。
六邻体蛋白系统发育组间比较提示,以HAdV-D六邻体蛋白序列为参考,HAdV-B和HAdV-E遗传距离较短,其次为HAdV-C。HAdV-A、HAdV-F和HAdV-G六邻体蛋白遗传距离较远。纤维蛋白系统发育组间比较提示,以HAdV-D六邻体蛋白序列为参考,HAdV-C遗传距离最短,其次为HAdV-E和HAdV-B。HAdV-A、HAdV-F和HAdV-G纤维蛋白遗传距离同样较远。

表2 不同HAdV分型临床体征例数及所占比例[n(%)]Table 2 Cases and the ratio of different HAdv genotypes with various clinical manifestations (n[%])HAdV分型上呼吸道感染耳前淋巴结肿大压痛结膜伪膜角膜上皮浸润阴性阳性阴性阳性阴性阳性阴性轻度上皮浸润浅基质层病灶总例数HAdV-C11(100.00)0(0.00)1(100.00)0(0.00)1(100.00)0(0.00)1(100.00)0(0.00)0(0.00)1HAdV-C27(100.00)0(0.00)7(100.00)0(0.00)7(100.00)0(0.00)7(100.00)0(0.00)0(0.00)7HAdV-B310(50.00)10(50.00)7(35.00)13(65.00)20(100.00)0(0.00)15(75.00)5(25.00)0(0.00)20HAdV-E42(33.33)4(66.67)3(50.00)3(50.00)6(100.00)0(0.00)5(83.33)1(16.67)0(0.00)6HAdV-D823(100.00)0(0.00)10(43.48)13(56.52)17(73.91)6(26.09)5(21.74)11(47.83)7(30.43)23HAdV-D1917(100.00)0(0.00)7(41.18)10(58.82)13(76.47)4(23.53)5(29.41)8(47.06)4(23.53)17HAdV-D3715(100.00)0(0.00)7(46.67)8(53.33)12(80.00)3(20.00)3(20.00)8(53.33)4(26.67)15注:HAdV:人类腺病毒Note:HAdV:human adenovirus
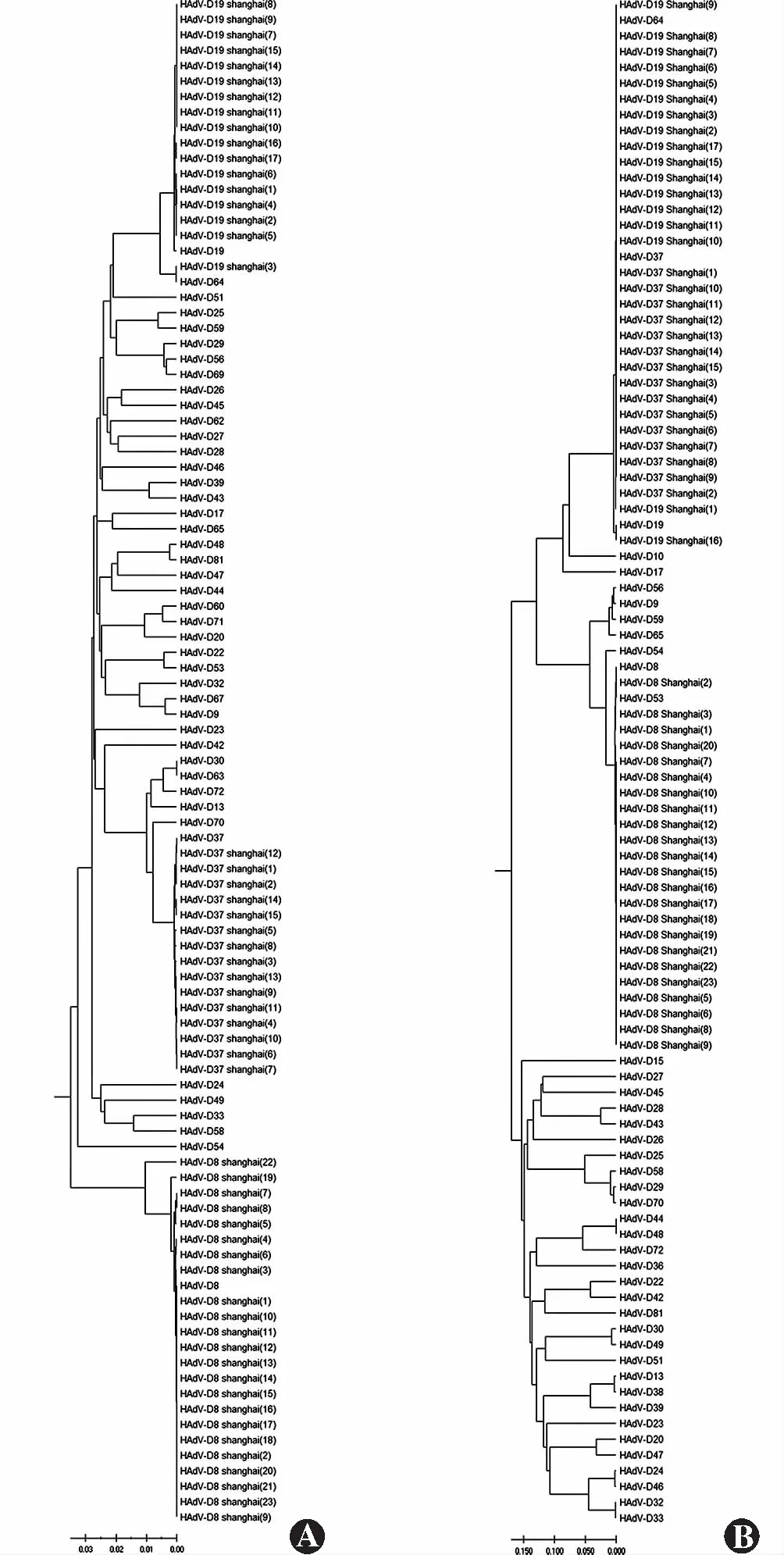
图1 HAdV-D腺病毒阳性样本序列及腺病毒参考序列在六邻体基因和纤维基因的系统发育树 A:六邻体蛋白基因 B:纤维蛋白基因 HAdV:人类腺病毒Figure 1 Phylogenetic tree of HAdV-D positives and HAdV reference strains in hexon gene and fiber gene A:hexon gene B:fiber gene HAdV:human adenovirus
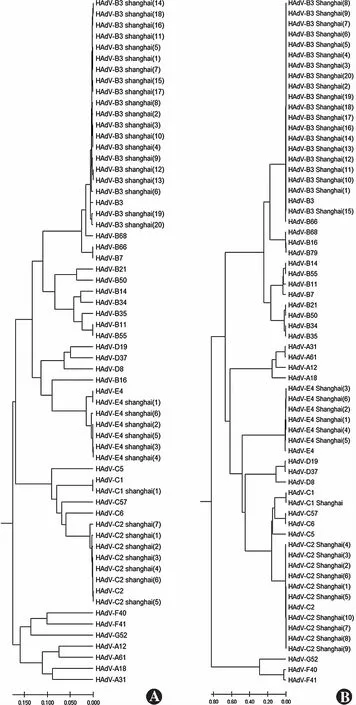
图2 非HAdV-D腺病毒阳性样本序列及腺病毒参考序列在六邻体基因和纤维基因的系统发育树 A:六邻体蛋白基因 B:纤维蛋白基因 HAdV:人类腺病毒Figure 2 Phylogenetic tree of non-HAdV-D positive samples and HAdV reference strains in hexon gene and fiber gene A:hexon gene B:fiber gene HAdV:human adenovirus
3 讨论
HAdV属于腺病毒科的哺乳动物腺病毒属,为无包膜双链DNA病毒,直径为65~80 nm,由1个二十面体形状的蛋白质衣壳组成,包括252个壳粒、含DNA病毒基因组的核蛋白核心和内部蛋白质。HAdV已鉴定出70余种分型,分为HAdV-A~G 7种,可引起人体多种组织感染,包括结膜炎、胃肠炎、肝炎、心肌炎和肺炎等。腺病毒性结膜炎主要通过手眼接触、眼分泌物以及与眼科护理人员及医疗器械的接触传播[4]。
HAdV分型与临床分型高度相关。EKC是腺病毒性结膜炎中最严重的表现,主要由HAdV-D引起,HAdV-D8、HAdV-D19和HAdV-D37较常见,还包括HAdV-D54、HAdV-D56等[5-8],一般病程持续约3周,表现为水样分泌物、结膜充血、结膜伪膜、角膜浸润、睑球粘连和同侧淋巴结肿大,部分角膜斑翳可能会残存数年[1,9];PCF表现为突然发热、咽炎、双侧结膜炎和耳周淋巴结肿大,常由HAdV-B引起,包括HAdV-B3、HAdV-B5、HAdV-B7和HAdV-B11等[10];单纯滤泡性结膜炎仅表现为结膜滤泡,无角膜或全身受累,HAdV-B、HAdV-C、HAdV-D和HAdV-E均可引起,包括HAdV-B3、HAdV-B7、HAdV-B11、HAdV-C1、HAdV-C2、HAdV-C5、HAdV-C6、HAdV-D8、HAdV-D9、HAdV-D10和HAdV-E4等。HAdV-B、HAdV-C、HAdV-D和HAdV-E较易引起腺病毒性结膜炎,这与其在六邻体蛋白及纤维蛋白上存在较近的遗传距离有关。同样,在六邻体蛋白和纤维蛋白结构上遗传距离较大的HAdV-A、HAdV-F和HAdV-G,则较少引起腺病毒性结膜炎。
快速、经济、简便的HAdV检测和分型可以为腺病毒性结膜炎的确诊和进一步临床分型提供重要依据,为疗效的预判、个性化用药选择、减少抗生素滥用提供实验基础[11-12]。大多数腺病毒性结膜炎为自限性,轻症者不需要治疗,或仅需要使用人工泪液等支持性治疗缓解症状,清洁眼表;严重病例需要局部使用糖皮质激素滴眼液减少角膜斑翳、结膜伪膜和睑球粘连[13],甚至可能需行准分子激光手术切削严重的角膜斑翳[14-15]。但单纯依靠症状和体征的腺病毒性结膜炎的临床诊断准确率低于50%,缺乏快速、准确的诊断方法使很多腺病毒性结膜炎被误诊为细菌性结膜炎,造成不必要的抗生素使用[2]。
PCR检测结膜标本中的HAdV基因以及进一步的基因测序已经替代细胞培养联合免疫荧光,成为HAdV检测的常用方法[16]。六邻体蛋白是目前HAdV分型最重要和常用的依据,其在所有血清型中都保留了抗原决定簇,能够检测几乎全部的HAdV分型。基于六邻体蛋白的快速抗原检测试剂盒已得到美国食品和药物管理局批准,用于临床HAdV分型。六邻体蛋白基因位于HAdV基因组中部,相对保守,可以通过1对通用引物扩增不同种的HAdV。但是,单纯的六邻体蛋白基因分析仅能得到HAdV分型的初步依据,而不能取代基因组或蛋白组测序带来的完整生物学信息。
纤维蛋白是HAdV区别于其他二十面体病毒的特有蛋白,相关序列变化带来的空间构像变化与HAdV致病力的进化有关[17]。纤维蛋白基因位于HAdV基因组尾部,在各种HAdV中变异较大,各种HAdV需要设计不同的引物进行扩增和测序,可以识别宿主细胞表面的柯萨奇/HAdV受体,促使HAdV颗粒与宿主细胞链接并锚定,在HAdV的内吞过程中起到重要作用。但是,部分类型的HAdV具有近似的纤维蛋白结构,因此,单纯针对纤维蛋白的基因测序不能有效进行HAdV分型,例如,HAdV-D19与HAdV-D37纤维蛋白结构高度相似,本研究中也出现了HAdV-D19和HAdV-D37样本与参考序列原型互相交叉聚集的现象。纤维蛋白与六邻体蛋白的联合基因测序可以更加有效地确定HAdV分型,并进行进一步的毒力分析。然而,本研究中存在交叉聚集的HAdV-D19与HAdV-D37样本在临床表现占比上无明显差异。一方面可能是因为HAdV-D19与HAdV-D37纤维蛋白结构差异较小,另一方面可能是因为样本量有限。但对纤维蛋白结构的系统发育分析仍是腺病毒致病力分析的重要方法之一。
在HAdV-D53之后出现了大量由现有HAdV的基因组变异、替换和重组发展出的新的基因组类型。通过五邻体蛋白(P)、六邻体蛋白(H)和纤维蛋白(F)标记和命名这些新型HAdV已经成为国际通用的方法,如HAdV-D53(P37H22F8)、HAdV-D59(P64H25F56)、HAdV-C57(P1H57F6)、HAdV-D58(P58H58F29)和HAdV-D63(P30H30F29)等。这些新型的HAdV也可能引起腺病毒性结膜炎,甚至可能引起EKC爆发,并日益成为EKC流行的重要血清型[8,18-21]。如果仅通过单个基因的测序分析,这些新型的HAdV可能会被错误地鉴定为传统的HAdV,而双基因,甚至三基因的联合测序可以有效鉴定出新型HAdV。
相比于单纯的基因测序和比对,系统发育分析为HAdV分类和分子进化监测提供了一种更加有效、可靠的方法。系统发育分析提示,HAdV-D与HAdV-B、HAdV-C、HAdV-E的亲缘关系更近,而与HAdV-A、和HAdV-F的亲缘关系较远。这可以从侧面解释HAdV-D、HAdV-B、HAdV-C、HAdV-E容易引起眼部感染,而HAdV-A和HAdV-F引起眼部感染的可能性较小。
六邻体蛋白基因和纤维蛋白基因位于HAdV基因组中部和尾部,变异程度较大,是进行HAdV分型、变异研究和毒力分析的重要靶点[22]。本研究选用六邻体蛋白基因和纤维蛋白基因的联合测序,可以涵盖HAdV基因组中近80%的变异,相对于全基因组测序更加快速、有效、易推广,也比针对单一的六邻体蛋白或纤维蛋白测序更加可靠,并且可能发现由基因变异、替换和重组发展出的新型HAdV。本研究方法在所得数据丰度上逊于全基因组测序,但种系分析能够比单纯的序列比对提供更丰富的病毒进化和发展信息。总之,六邻体蛋白基因和纤维蛋白基因的联合测序可能为临床预后判断、减少角膜病损的发生及个性化治疗方法的选择提供丰富的分型和毒力分析信息。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明王旌:实施研究、采集数据、统计分析、论文撰写和修改;朱剑锋、陆丽娜:分析数据、论文修改及定稿

