中国视网膜下基因治疗药物注射术操作规范推荐专家共识(2022)
中华医学会眼科学分会眼底病学组 中国医师协会眼科医师分会眼底病专业委员会
遗传性视网膜疾病(inherited retinal diseases,IRDs)是一组以原发性视网膜退行性改变和视功能进行性不可逆损害为主要临床特征的遗传性眼病,既往无公认的有效治疗方法[1]。基因治疗是指采用相关载体实现目标基因递送或编辑、操纵修饰基因表达、改变活细胞生物学特性的治疗手段,目前已用于多种单基因遗传病的治疗[2]。Luxturna(Spark Therapeutics)是全球首个获得美国食品药品监督管理局及欧盟批准的眼科基因治疗药物,自2017年获批以来已用于RPE65基因突变所致的相关视网膜变性疾病的治疗[3]。近年来,IRDs的基因治疗研究蓬勃发展,多个基因治疗药物正处于各期临床试验阶段,这些疾病包括无脉络膜症(CHM基因型)、X性连锁视网膜色素变性(RPGR基因型)、常染色体隐性遗传性视网膜色素变性(MERTK基因型)、青少年黄斑营养不良(ABCA4基因型)、全色盲(CNGA3和CNGB3基因型)等[4]。临床实践和实验研究表明,除了基因治疗药物外,基因疗法的效果、病毒载体的分布、宿主组织的免疫反应程度还取决于药物能否被安全、高效地递送至靶区域的视网膜下腔。目前IRDs基因治疗药物的眼内给药途径主要有3种,即视网膜下注射、玻璃体腔注射以及脉络膜上腔注射。考虑到各种类型的IRDs治疗靶细胞不同、各视网膜细胞层之间药物渗透效率不同以及各载体对视网膜组织细胞特异性和转染效率不同,同时由于内界膜或Bruch膜对药物作用的影响,针对累及光感受器和视网膜色素上皮(retinal pigment epithelium,RPE)细胞的IRDs,选择视网膜下注射术在提高基因治疗药物递送效率、降低病毒潜在免疫反应方面具有先天优势,是广为接受的给药途径。视网膜下注射基因治疗是在手术显微镜直视下的微创操作,可将携带治疗基因的病毒载体注入目标区域光感受器和RPE层之间的视网膜下空间,药物可以精准作用于靶细胞,提高载体对靶细胞的转染效率,有效减少载体用量,减少局部及全身免疫反应[5-6]。
目前我国已开展IRDs等眼底病变基因治疗的临床试验[7],且相关研究逐年增多,然而,仍缺乏一个详细完整的、适于我国临床应用的基因治疗药物视网膜下注射术操作规范。为促进我国眼科基因治疗进一步发展,中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病专业委员会成立专家组,邀请相关专家充分了解目前研究概况,依据国内外现有关于IRDs等眼底病变基因治疗的研究证据、实践经验、器械设备、治疗效率及安全性评价结果,制定了《中国视网膜下基因治疗药物注射术操作规范推荐专家共识(2022)》(简称《推荐》),为临床医生的相关实践提供专家指导意见。
1 专家推荐的制定方法
为了规范视网膜下注射术在我国IRDs等眼底病变基因治疗中的应用,中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病专业委员会于2022年5—7月在全国成立《中国视网膜下基因治疗药物注射术操作规范推荐专家共识(2022)》专家组,共邀请眼底病、遗传性眼病等领域的专家80人,其中主要专家组成员12人,负责《推荐》制定的组织、监督和执笔等工作。主要专家组成员的构成充分考虑了专业知识、专业技能、价值观和地区分布的平衡。
《推荐》专家组于2022年5月对基因治疗药物视网膜下注射术的应用情况进行深入调查研究,通过会议及邮件广泛征集该技术在临床实践中的问题,充分检索回顾近年已发表的相关重要文献,结合前期开展的研究工作和实践经验,全面评估视网膜下注射术在IRDs基因治疗中的安全性和有效性,对基因治疗药物视网膜下注射术的流程步骤、操作规范及原理机制等进行反复讨论和推敲,从利于疗效、重于安全、便于实施出发,撰写形成《推荐》初稿。《推荐》初稿于2022年6—7月通过邮件函审的形式请专家组成员进行评阅和修改。主要专家组成员对修改意见进行多轮整理、归纳、论证,提交各位专家的回复说明,并于2022年7月16日召开会议,对关键问题进行反复商议、修订,于8月最终形成《推荐》终稿。本《推荐》制定共经历3个月余。
2 IRDs基因治疗给药途径的选择
目前IRDs基因治疗除了视网膜下注射术外,其他眼内给药方法还包括玻璃体腔注射术和脉络膜上腔注射术。玻璃体腔给药的优势在于操作便捷、学习曲线短,可能是未来基因治疗药物递送的发展方向之一。由于大多数IRDs基因治疗的靶细胞是位于外层视网膜的光感受器和RPE细胞,考虑到目前病毒转染效率以及视网膜内界膜屏障作用等,玻璃体腔给药对光感受器和RPE细胞转染效率偏低,更适用于主要累及视网膜神经纤维层、视网膜神经节细胞层等内层视网膜的遗传性眼病,如Leber遗传性视神经病变和X性连锁视网膜裂症等[8-9]。此外,由于玻璃体腔的免疫豁免效应不如视网膜下空间,故玻璃体腔给药病毒容易通过睫状体等组织吸收后进入患者全身组织或器官,发生免疫反应的风险也更高。新近研究采用脉络膜上腔微导管法递送基因治疗药物[10],该技术尚无法精准将药物注射至目标区域,且药物进入脉络膜上腔后仍可能无法穿透RPE和Bruch膜水平的血-视网膜外屏障,同时存在随脉络膜血管扩散至全身的风险,引起全身免疫反应,因此还有待更多的探索性研究和验证。现阶段视网膜下注射给药依然是IRDs基因治疗的优先选择。
3 基因治疗药物视网膜下注射术的方法及步骤
手术全称为基因治疗药物视网膜下注射术。手术设备和器材包括:(1)眼科手术显微镜,建议选用带有集成光相干断层扫描(optical coherence tomography,OCT)的手术显微镜;(2)玻璃体视网膜手术系统;(3)23G/25G/27G等微创玻璃体视网膜手术套件;(4)1 ml微量流体控制(viscous fluid control,VFC)注射器(图1A);(5)38G及以上的视网膜下微注射针头(图1B);(6)18G过滤针头;(7)硅油输注管件。
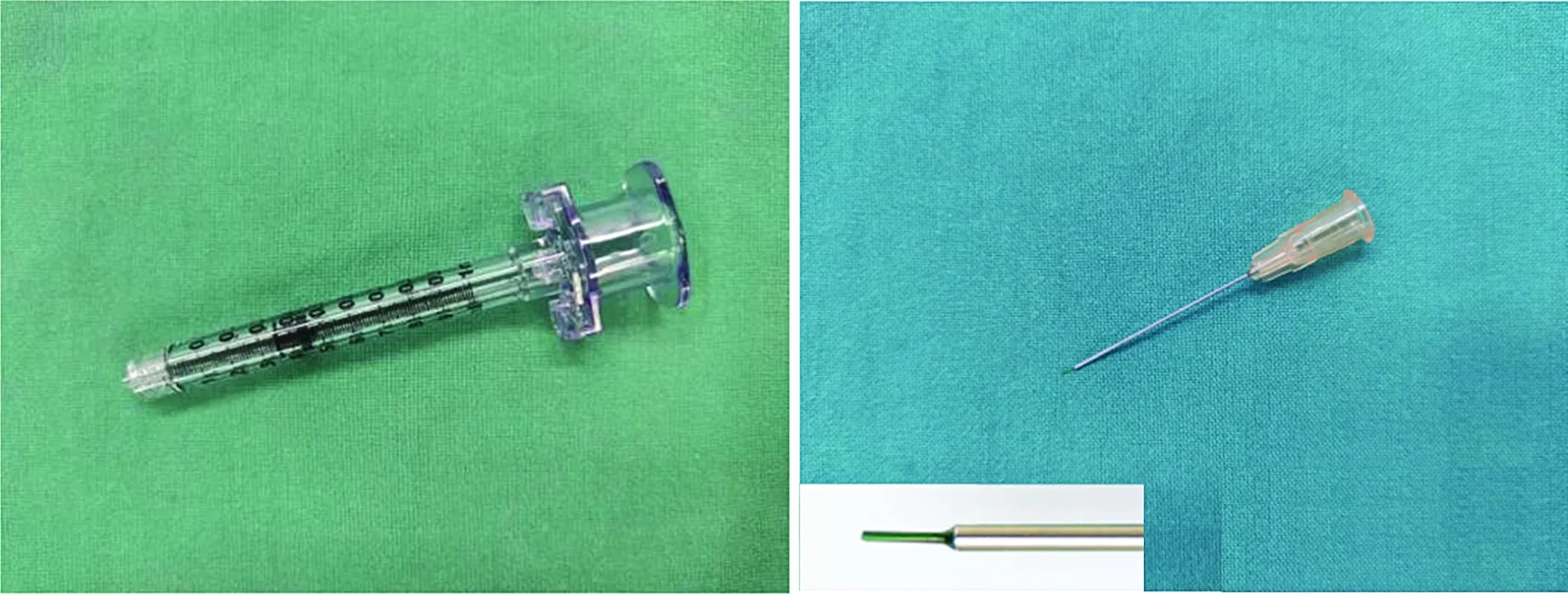
图1 基因治疗药物视网膜下注射术所需部分器材(注:为样品照片,可能因为品牌和大小不同而有所区别) A:1 ml VFC注射器 B:38G视网膜下微注射针头,针尖为38G长2 mm的聚丙烯纤维,针尖后部针头长28 mm
3.1 术前药物准备
考虑到目前国内尚未有已上市的视网膜下注射基因治疗药物,本药物准备工作主要针对已在GCP机构备案、获得所在大学或者医院临床研究学术委员会科学性和药物安全性批准,并取得相应伦理批件和患者知情同意后在符合一定资质要求的医疗机构开展临床试验时参考,指导相关手术操作。(1)基因治疗药物进入医疗机构前需完成相应企业放行标准相关检测,包括基因组滴度、基因鉴别、外壳蛋白鉴别、药物纯度、内毒素、支原体、残留成分、空壳率等项目;(2)医疗机构GCP药房应要求申办方提供基因治疗药物相关审查材料,包括但不限于药物说明、药物检测报告、药物标签、药物运输物流单据、运输温度记录单、药物专用处方、药物出入库信息等;(3)由于多数基因治疗药物通过深低温(≤-60 ℃)冷链运输和储存,建议在治疗场所根据药物保存要求就近配置专用深低温冰箱,转运时采用带有实时电子温度监控装置的保温箱,避免因反复冻融造成的药物活性降低。医疗机构GCP药房应要求物流企业出具全程实时温度记录数据,核对温度读数;(4)有条件医疗机构GCP药房应建立院前放行标准,对每批次基因治疗药物抽样,进行快速内毒素检测等院内快检复合;(5)正式治疗前,临床医生首先确定手术时间,依据该时间逆推规划,以确保药物可在解冻后规定期限内进行视网膜下注射;(6)按药物产品说明或处方要求,提前溶解和复苏。如药物需要稀释制备,相关医生或药剂师在手术室内或负压通风橱采用无菌操作原则,按照产品说明进行配制;(7)术前检查药物是否有污染迹象,确认药物名称、浓度和剂量,并注意有效期;(8)建议对每例患者准备2份同一批次的药物,作为配置或手术中发生意外时的备用药物。配置多余的药物按照医疗机构GCP药房要求进行回收,也可在必要时进行药物复检。
3.2 基因治疗手术设计规划
基因治疗药物视网膜下注射前应进行严格的设计规划。(1)术前详细评估是否存在周边视网膜裂孔、变性区或黄斑前膜等;(2)依据IRDs类型和治疗目的,对术眼眼底和OCT图像进行临床评估,确定治疗的目标区域;(3)根据事先拟定的注射剂量,合理规划视网膜下注射点位,必须能覆盖目标治疗区域;(4)视网膜下注射点位推荐后极部沿颞侧上下血管弓附近,并距离中心凹至少2个视盘直径的距离。通常选择视网膜厚度相对正常,无视网膜前膜覆盖的部位,避免严重视网膜脉络膜萎缩、色素大量沉积、乳斑束或神经纤维层过厚区域;(5)如目标治疗区域或预计注射剂量较大(>200 μl),为了避免单个视网膜隆起张力过大而出现医源性视网膜或黄斑裂孔,可规划多个视网膜下注射点位。
3.3 视网膜下注射系统的连接
视网膜下注射系统的连接需遵循以下步骤:(1)将VFC注射器尾部连接硅油输注管件,硅油输注管件另一头接入玻璃体切割机;(2)VFC注射器安装过滤针头,在玻璃体切割机的硅油取出模式下,调整吸力至650 mmHg(1 mmHg=0.133 kPa),控制脚踏,抽取适量基因治疗药物,并在注射器上标记;(3)VFC注射器更换38G或以上视网膜下微注射针头,在玻璃体切割机的硅油注入模式下,调整推注压力至20 mmHg,控制脚踏,将VFC注射器内基因治疗药物推至合适量,并排出任何可见小气泡(图2);(4)如果拟定预制视网膜下水泡,可以另准备1支VFC注射器,采用上述相同步骤,抽取适量平衡盐溶液(balanced salt solution,BSS),并在注射器上标记;(5)最终获得2支VFC注射器(1支装载基因治疗药物,1支装载BSS),完成视网膜下注射系统准备工作。
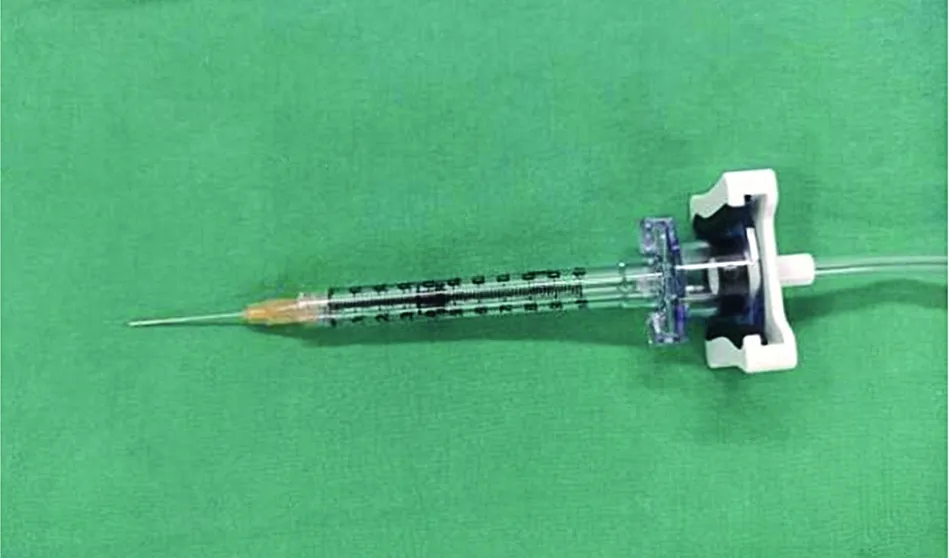
图2 视网膜下注射系统的连接 VFC注射器尾部连接硅油输注管件,头部连接38G或以上视网膜下微注射针头
3.4 标准经睫状体平坦部三切口玻璃体切割术
视网膜下注射前先完成标准经睫状体平坦部三切口玻璃体切割术。(1)常规手术消毒铺巾麻醉;(2)采用23G/25G/27G等微创玻璃体视网膜手术套件,需注意的是拟注射一侧的巩膜切口套管应与视网膜下微注射针头最粗处管径匹配;(3)常规进行前部玻璃体切割,诱导玻璃体后脱离,完成核心玻璃体切割;(4)检查黄斑区是否存在视网膜前膜,如存在且手术医生判断影响视网膜下注射,则应剥除;原则上内界膜不需要处理,如出现继发性黄斑裂孔,则需剥除内界膜;(5)周边部玻璃体切割范围可由手术医生视具体情况判断。如检查发现周边部视网膜裂孔,可采用常规视网膜激光光凝或冷凝处理;(6)对于儿童患者,由于其眼部解剖结构与成人不同,在进行玻璃体切割术时,有几点需重视[11]。考虑到儿童眼球较小以及睫状体平坦部未发育成熟,巩膜切口选择需依据儿童年龄。一般切口位置与角膜缘的距离选择应遵循以下原则:0~6个月1.5 mm;>6~12个月2.0 mm;>1~2岁2.5 mm;>2~6岁3.0 mm;>6~18岁3.5 mm[12]。大多数儿童无玻璃体后脱离,术中可在视盘处进行高负压吸引,必要时借助眼内镊完成,应尽可能形成玻璃体后脱离[13]。专家组建议对于儿童患者应缝合巩膜切口,避免切口渗漏导致低眼压。
3.5 预制视网膜下BSS水泡
可采用BSS预制视网膜下水泡。(1)完成核心玻璃体切割、玻璃体后脱离以及清除周边玻璃体后制作视网膜下水泡;(2)注射前将眼内灌注压降低至10~15 mmHg;(3)建议采用非接触黄斑镜观察并识别注射点位;(4)将玻璃体切割机调整至硅油注入模式,设定最大推注压力为20~25 mmHg;(5)打开手术显微镜集成OCT,标准模式下扫描后极部视网膜,调整至清晰;(6)将装载BSS的VFC注射器从套管处进入玻璃体腔,将手术显微镜集成OCT扫描定位到注射点位附近,并开始扫描视网膜;(7)将注射器针头尖端斜向45°,与计划注射点位的视网膜表面接触。注射器针头尖端轻轻刺压视网膜。手术显微镜集成OCT可观察到位于视网膜表面的注射器针尖呈低反射,视网膜受针尖压触,呈现一小凹陷(图3A);(8)控制脚踏板以向视网膜下缓慢渗透并注入少量BSS,直至观察到1个小的穹顶状局限性视网膜隆起水泡。手术显微镜集成OCT影像可见注射点位周围视网膜神经上皮层隆起,呈视网膜下低反射空间(图3B)。如果在注射过程中未能成功预制BSS视网膜下水泡,则应重新定位针尖,并重复该步骤。

图3 预制视网膜下BSS水泡 A:装载BSS的VFC注射器针头尖端斜向45°轻轻刺压计划注射点位的视网膜表面。手术显微镜集成OCT影像可见低反射注射器针尖,压触视网膜表面形成一小凹陷 B:向视网膜下缓慢渗透注入少量BSS,直至观察到1个小的穹顶状局限性视网膜隆起水泡。手术显微镜集成OCT影像可见注射点位周围视网膜神经上皮层隆起,呈视网膜下低反射空间
3.6 基因治疗药物视网膜下注射
基因治疗药物视网膜下注射步骤为:(1)将视网膜下注射系统更换为装载基因治疗药物的VFC注射器;(2)将装载基因治疗药物的VFC注射器针头尖端从隆起的视网膜水泡原注射点位处进入视网膜下;(3)按2.5中描述的方法,将手术显微镜集成OCT扫描范围定位于注射点位附近视网膜并开始扫描,确认针尖位于隆起的视网膜下空间;(4)按2.3中的描述方法,设定最大推注压力为20~25 mmHg,控制脚踏板,向视网膜下缓慢渗透并注入适量基因治疗药物。采用手术显微镜集成OCT影像可以观察到随着基因药物进入视网膜下腔,视网膜隆起高度逐渐增加,隆起范围逐渐扩大(图4A);(5)将手术显微镜集成OCT扫描范围定位至黄斑中心凹,如果目标治疗区域需覆盖中心凹,则观察OCT影像,直到中心凹视网膜隆起。OCT实时监测中心凹视网膜隆起高度和视网膜厚度,如果OCT显示中心凹轮廓反转或过度拉伸,则立即停止注射,避免因过度拉伸而出现继发性视网膜或黄斑裂孔(图4B);(6)单次注射药物剂量过大会导致视网膜隆起的张力加剧,引起视网膜撕裂或者注射孔变大。实际操作中,由于中心凹视网膜菲薄,如果药物跨越黄斑部视网膜下且视网膜隆起较高,非常容易造成黄斑裂孔。因此根据目标治疗区域覆盖情况,必要时可通过增加注射点位来达到所需药物剂量。
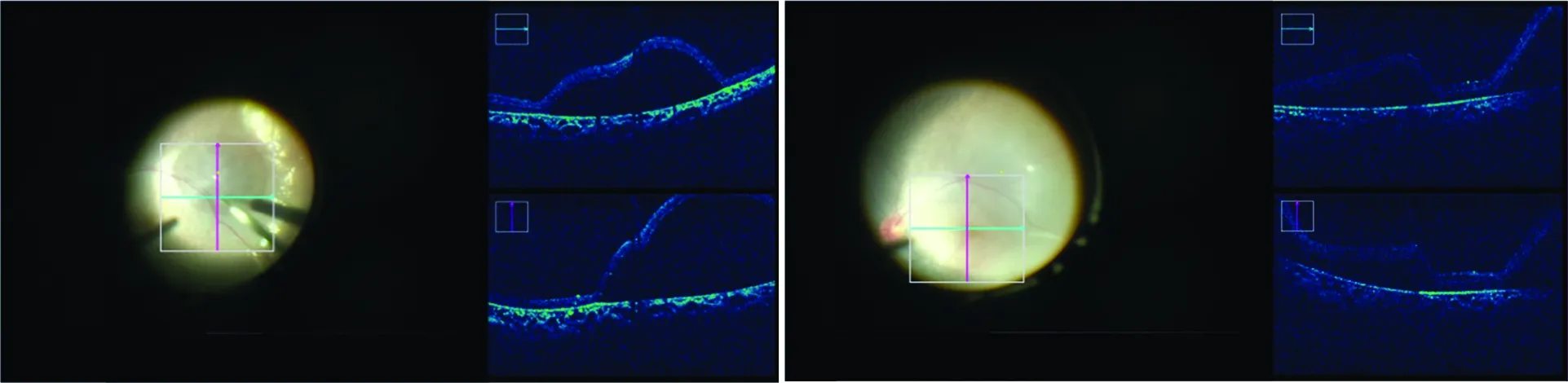
图4 基因治疗药物视网膜下注射 A:装载基因治疗药物的VFC注射器针头尖端从隆起视网膜水泡原注射点位处进入视网膜下,缓慢注入适量基因治疗药物。手术显微镜集成OCT可观察到随着基因治疗药物进入视网膜下腔,视网膜隆起高度逐渐增加,范围逐渐扩大 B:将手术显微镜集成OCT扫描范围定位至黄斑中心凹,实时监测中心凹视网膜隆起高度和视网膜厚度
3.7 基因治疗药物视网膜下注射后处理方法
基因治疗药物视网膜下注射后进行如下处理:(1)恢复眼内灌注压至注射前水平;(2)通常注射孔处不需要处理;(3)再次检查周边部视网膜;(4)使用软管笛针进行气液交换,气体占玻璃体腔的40%~50%;(5)依据巩膜切口渗漏情况选择是否缝合伤口;(6)按手术常规,纱布覆盖术眼,返回病房;(7)术后患者保持仰卧位24 h;(8)根据当地病毒类药品生物安全指南处理剩余基因治疗药物和注射器。
4 基因治疗药物视网膜下注射术注意事项
关于基因治疗药物的视网膜下注射手术步骤中是一步完成,还是分两步注射入视网膜下尚存在争议。目前视网膜下注射基因治疗药物多采用“两步法”,即先在视网膜下注射少量BSS形成小范围水泡,再从原注射点缓慢注入基因治疗药物,而非直接在视网膜下注射药物。使用BSS预制视网膜下水泡的优势在于其可以确保给药时针头位于视网膜下,从而精确控制注射剂量,同时避免药物返流玻璃体腔造成炎症反应。此外,根据Luxturna上市后的相关研究结果,接受视网膜下注射治疗的10例患者18眼中观察到中心凹旁视网膜脉络膜萎缩,其中大部分患者的萎缩区域与术中药物覆盖范围存在明显对应关系。虽然发生该并发症的机制尚未明确,但推测可能与病毒载体的毒性、局部免疫反应、RPE脉络膜毛细血管复合体变薄以及视网膜下注射流速较高等多种因素有关[14]。由此,适量BSS水泡还可以稀释局部病毒载体浓度,降低载体毒性的潜在风险。然而,对于儿童患者,有研究者建议可省略预制BSS水泡步骤,考虑到儿童患者眼底色素改变程度通常较轻,视网膜易与RPE分离而隆起,直接进行药物视网膜下注射既可以保证高成功率,又可以避免额外的组织损伤[15]。
关于基因治疗药物视网膜下注射手术操作中的难点在于会人为造成局部视网膜脱离的问题,首先原则上视网膜下注射前无需剥除黄斑部内界膜[9],术毕注射孔也无需行激光封闭处理。值得注意的是,在预制视网膜下水泡时,注射器针头穿刺深度不必深入视网膜下,只需将针头刺压视网膜表面,确保内界膜连续性中断,注射时的推注压力会让液体直接冲破视网膜进入视网膜下腔。术中预制的水泡应尽量小,可以避免过度拉伸视网膜和稀释药物。其次,水泡预制成功后另一手术难点是将基因治疗药物足量注射入视网膜下,剂量不够可能会部分降低疗效,而剂量过大容易引起药物反流或视网膜破裂。由于多数IRDs患者视网膜下存在各种色素沉着,导致视网膜和RPE各方向黏附力不同,药物通常沿着视网膜容易分离的方向扩展。当药物进入视网膜下腔后,很难控制视网膜扩张隆起的方向、范围和高度,需要经验丰富的手术医生根据情况随时调整注射速率以及针尖进入视网膜下的程度和方向,确保持针手的良好稳定性,避免注射孔被撑大,手术显微镜下OCT导航是很好的辅助监测手段。
视网膜下注射尽可能采用单点位注射是减少继发性视网膜脱离等并发症发生的有效手段,但当总给药量超过200 μl或目标治疗区域较大时,单点位注射存在一定困难,建议采用多点位注射策略。此外,当治疗目标区域涉及黄斑中心凹时,尤其对于中心凹视网膜菲薄的患者,多点位注射可以通过增加表面积减少每个点位处视网膜隆起高度,从多个方向逐渐向中心凹靠近。对于儿童患者,考虑到儿童眼球较小,注射同样体积的药物儿童视网膜承受张力更大,更易造成黄斑裂孔等并发症[12],因此建议至少需要2个注射点位,注射过程中在显微镜集成OCT导航下密切监测视网膜隆起高度和张力是非常有必要的。
本《推荐》汇总了基因治疗药物视网膜下注射术操作规范的专家意见,并依据前期国内外临床研究中手术经验对意见进行系统性细化归纳。临床医生在实践中可根据患者个体情况、具体药物说明、器械配置状态等灵活应用。目前,基因治疗药物视网膜下注射术仍处于早期应用阶段,本《推荐》的制定将遵循“提出问题,注重实践,后效评价,止于至善”的原则,持续关注相关临床研究进展过程中新出现的问题和疗效评价结果,不断更新完善,为我国广大眼科医生开展IRDs等眼底病变的相关基因治疗提供有价值的参考。
形成共识意见的专家组成员:
中华医学会眼科学分会眼底病学组 中国医师协会眼科医师分会眼底病专业委员会
黎晓新 厦门大学附属厦门眼科中心 北京大学人民医院(顾问)
许 迅 上海交通大学附属第一人民医院眼科 国家眼部疾病临床医学研究中心(组长,主要执笔人)
学组副组长及秘书(以下按姓氏拼音排序):
吕 林 中山大学中山眼科中心(副组长)
王雨生 空军军医大学西京医院眼科 全军眼科研究所(副组长)
魏文斌 首都医科大学附属北京同仁医院眼科中心(副组长)
徐格致 复旦大学附属眼耳鼻喉科医院(副组长)
赵明威 北京大学人民医院眼科(副组长)
孙晓东 上海交通大学附属第一人民医院眼科 国家眼部疾病临床医学研究中心(学组秘书,主要执笔人)
冯竞仰 上海交通大学附属第一人民医院眼科 国家眼部疾病临床医学研究中心(秘书,主要执笔人)
学组委员(以下按姓氏拼音排序)
常 青 复旦大学附属眼耳鼻喉科医院
陈 蕾 中国医科大学附属第一医院
陈 松 天津市眼科医院
陈伟奇 汕头大学·香港中文大学联合汕头国际眼科中心
陈晓隆 中国医科大学盛京医院
陈有信 北京协和医院
崔 彦 山东大学齐鲁医院
戴 虹 北京医院
方肖云 浙江大学附属第二医院
贺 涛 武汉大学人民医院
姜春晖 复旦大学眼耳鼻喉科医院
蒋 沁 南京医科大学眼科医院
柯根杰 安徽省立医院
李秋明 郑州大学第一附属医院
李甦雁 徐州市第一人民医院
李筱荣 天津医科大学眼科医院
李 燕 昆明医科大学第一附属医院
梁建宏 北京大学人民医院
梁小玲 中山大学中山眼科中心
刘 静 中国中医科学院望京医院
刘 堃 上海交通大学附属第一人民医院
刘庆淮 南京医科大学第一附属医院
刘铁城 解放军301总医院
刘 武 首都医科大学附属北京同仁医院眼科中心
刘晓玲 温州医学院附属眼视光医院
刘 勇 陆军军医大学第一附属医院
刘早霞 吉林大学第二医院眼科中心
柳 林 上海交通大学医学院附属仁济医院
陆 方 四川大学华西医院
马 翔 大连医科大学附属第一医院
曲进锋 北京大学人民医院
佘海澄 首都医科大学附属北京同仁医院眼科中心
沈丽君 浙江省人民医院眼科中心
沈 玺 上海交通大学医学院附属瑞金医院
宋艳萍 中部战区总医院
宋宗明 河南省立眼科医院
苏冠方 吉林大学第二医院眼科医院
孙大卫 哈尔滨医科大学附属第二医院
孙旭芳 华中科技大学同济医学院附属同济医院
唐罗生 中南大学湘雅二院
万光明 郑州大学第一附属医院
王 方 同济大学附属第十人民医院
王 鲜 贵州医科大学附属医院
王兴荣 山东中医药大学附属眼科医院
王艳玲 首都医科大学附属北京友谊医院
魏 勇 温州医科大学附属眼视光医院
文 峰 中山大学中山眼科中心
肖 云 解放军474医院
徐国兴 福建医科大学第一临床医学院
徐海峰 山东第一医科大学附属青岛眼科医院
杨培增 重庆医科大学附属第一医院
俞素勤 上海交通大学附属第一人民医院
喻晓兵 北京医院
于旭辉 哈尔滨医科大学附属第一医院
袁容娣 陆军军医大学第二附属医院
张 风 首都医科大学附属北京同仁医院眼科中心
张国明 深圳市眼科医院
张红兵 西北大学第一附属医院(西安市第一医院)
张美霞 四川大学华西医院
张 明 四川大学华西医院
张少冲 深圳市眼科医院
张喜梅 山西省眼科医院
张新媛 北京市眼科研究所
张学东 重庆医科大学附属第一医院
赵博军 山东省立医院
赵培泉 上海交通大学医学院附属新华医院
周 琼 南昌大学第一附属医院
朱 丹 内蒙古医科大学附属医院
本共识其他专家组成员(以下按姓氏拼音排序)
刘海芸 上海交通大学附属第一人民医院眼科(执笔人)
王 泓 上海交通大学附属第一人民医院眼科(执笔人)
睢瑞芳 北京协和医院
利益冲突本文为专家意见,为临床研究提供指导,并非在各种情况下都必须遵循的医疗标准;本文内容与相关产品的生产和销售厂商无经济利益关系;专家组成员均声明不存在利益冲突

