补阳还五汤对高糖环境下miR-21介导的人视网膜微血管内皮细胞自噬的影响△
石 颖 陈子扬 陈凯铭 胡艳红 胡 俊 陈 胜
糖尿病视网膜病变(DR)是由于糖尿病(DM)患者体内长期处于高血糖状态导致的糖脂代谢紊乱引发的慢性炎症,损害视网膜微血管细胞,引起微血管的扩张、渗漏、闭塞,继而出现视网膜无灌注区,使视网膜缺血、缺氧,最终发展成增生型DR[1]。相关研究表明,中国有超过40%的DM患者会出现DR[1]。在一项纳入了北美洲、大洋洲、 欧洲和亚洲人群的荟萃分析结果表明,DR的总发病率达34.6%,近20年全世界范围内DR导致失明人群增加了27%,DR 相关的视力障碍增加了64%[2-3]。可见DR发病率仍处于居高不下的状态,防治DR仍是眼科防盲的重点。
微小RNA(miRNA)表达和视网膜细胞自噬状态的异常与DR的发生发展关系密切。本课题组前期研究发现,增生型DR患者的外周血血浆中miR-21的表达水平明显高于非增生型DR患者[4]。此外,在DR患者视网膜中,异常的自噬参与了视网膜神经变性、炎症、氧化应激、凋亡等病理改变;在DR模型中,人视网膜微血管内皮细胞(HRCECs)存在异常的自噬,可进一步导致血管内皮细胞迁移增强,并促进新生血管形成[5-6]。有证据表明,在缺血、缺氧、高糖细胞模型中已发现miR-21可以影响细胞的自噬[7-9]。但此调控机制在高糖环境下HRCECs中的作用仍有待进一步证实。
DR属于中医学的消渴内障范畴,本课题组临床长期应用补阳还五汤(清·王清任·《医林改错》)加减治疗DR,发现其具有增效作用[10]。但其具体的作用机制是否与影响高糖下HRCECs的自噬和miR-21表达有关尚未明确。因此,本研究拟观察补阳还五汤对高糖培养下的HRCECs 的miR-21表达的影响,并探讨补阳还五汤对miR-21介导的自噬的影响,以期为DR自噬调控机制及药物治疗提供依据。
1 材料与方法
1.1 细胞HRCECs(购自深圳豪地华拓生物科技有限公司),用含有体积分数10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的DMEM培养基,置于37 ℃、含体积分数5%CO2和饱和湿度的培养箱中培养。每2 d换液1次。待细胞长至约80%融合时,用2.5 g·L-1胰蛋白酶消化传代。取对数生长期细胞用于实验。
1.2 药品补阳还五汤的中药组成为黄芪125 g、当归6 g、赤芍5 g及地龙、川芎、桃仁、红花各3 g[11],以上中药均来自福建中医药大学附属第二人民医院中药房。将以上生药水煎煮并浓缩成浓度1000 g·L-1药液,灭菌注射用水稀释成5 g·L-1,冷却到常温后,用0.22 μm直径针头式过滤器过滤备用。
1.3 主要试剂与仪器低糖培养基、2.5 g·L-1胰蛋白酶溶液(美国Gibco公司),体积分数5%葡萄糖(湖南科伦制药有限公司),DMEM/F-12(北京Solarbio公司),优质胎牛血清(德国PAN biotech公司),PBS(美国Hyclone公司),Lipofectamine3000试剂盒(美国Invitrogen 公司),Trizol试剂盒、Promega试剂盒、Takara SYBR Green荧光定量试剂盒(美国Santa Cruz公司)。RIPA细胞裂解液和蛋白定量试剂盒(上海碧云天有限公司)。兔抗人LC3多克隆抗体、过氧化物酶标记羊抗兔IgG、GAPDH(美国Proteintech公司)。Multiskan FC型酶标仪 (美国Thermo Fisher Scientific公司);IX71型倒置荧光显微镜(日本Olympus公司);7500 Fast型实时荧光定量PCR(qRT-PCR)系统(美国Applied Biosystems公司) 。
1.4 miR-21 mimic转染取对数生长期HRCECs,按1×105个·mL-1接种于6孔培养板,细胞长至约80%融合时,按Lipofectamine3000试剂盒说明书操作转染,配制转染液:A液为25 μL opti-MEM加入7.5 μL Lipofectamine 3000;B液为25 μL opti-EME加入10 μL miR-21 mimic(20 μmol·L-1)。A液与B液混匀并避光静置5 min,将A、B混合液滴加至细胞培养板中,于细胞培养箱中静置培养6 h后更换为完全培养基,荧光显微镜下观察、拍照并计算荧光强度。
1.5 细胞分组及给药处理根据前期预实验结果用含25.0 g·L-1葡萄糖的培养基孵育HRCECs作为高糖损伤模型,5 g·L-1的补阳还五汤水提液干预24 h用于探讨补阳还五汤水提液对高糖下培养的HRCECs的保护作用。实验分为5组,其中,正常对照组:用含低糖(5.5 g·L-1葡萄糖)的培养基孵育HRCECs;高糖组:用含25.0 g·L-1葡萄糖的培养基孵育HRCECs;补阳还五汤组:用含25.0 g·L-1葡萄糖和5 g·L-1补阳还五汤水提液的培养基孵育HRCECs;miR-21 mimic组:用含25.0 g·L-1葡萄糖的培养基孵育转染miR-21 mimic的HRCECs;miR-21 mimic+补阳还五汤组:用含25.0 g·L-1葡萄糖和5 g·L-1补阳还五汤水提液的培养基孵育转染 miR-21 mimic的 HRCECs。各组细胞均孵育24 h后用于后续实验。
1.6 qRT-PCR法检测miR-21表达将HRCECs按每孔1×105个接种到6孔培养板中,分组处理24 h后,去除培养基,加入1 mL Trizol提取液提取细胞总RNA。茎环法反转录得到cDNA,取1 μL cDNA样品用于miR-21检测。引物设计与合成由上海博尚生物技术有限公司完成,引物序列:Hsa-miR-21正向引物为5’-CCGCGCCTAGCTTATCAGACTGA-3’,反向引物为5’-AGTGCAGGGTCCGAGGTATT-3’;茎环逆转录引物为5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAACA-3’;内参基因U6正向引物为5’-CTCGCTTCGGCAGCACATATACT-3’,反向引物为5’-ACGCTTCACGAATTTGCGTGTC-3’。整个扩增反应体系参照试剂盒说明书进行,反应条件:95 ℃预变性3 min,95 ℃ 5 s,60 ℃ 15 s,70 ℃ 10 s,40个循环。采用公式2-ΔΔCt计算miR-21的相对表达量。
1.7 Western blot检测细胞中LC3蛋白表达将HRCECs按每孔1×105个接种到6孔培养板中,分组处理24 h后,去除培养基,用细胞裂解液RIPA裂解细胞。收集细胞裂解液,用蛋白定量试剂盒检测LC3蛋白的含量。上样20 μg蛋白进行SDS-page电泳和PVDF转膜。将转膜后的PVDF膜进行封闭,室温孵育30 min,加兔抗人LC3多克隆抗体(110 000) 或GAPDH(110 000)4 ℃孵育过夜;TBST漂洗3次(每次10 min)后加入过氧化物酶标记羊抗兔IgG(120 000)室温孵育1 h;TBST漂洗3次(每次10 min)后进行化学发光显色。用化学发光成像仪检测LC3蛋白表达。
1.8 统计学分析数据采用SPSS 21.0软件进行分析。计量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 miR-21 mimic转染情况荧光显微镜下可见,转染miR-21 mimic后,HRCECs的细胞形态完整,呈纤维状,大部分细胞呈绿色荧光(图1),荧光强度为32.708±1.001。
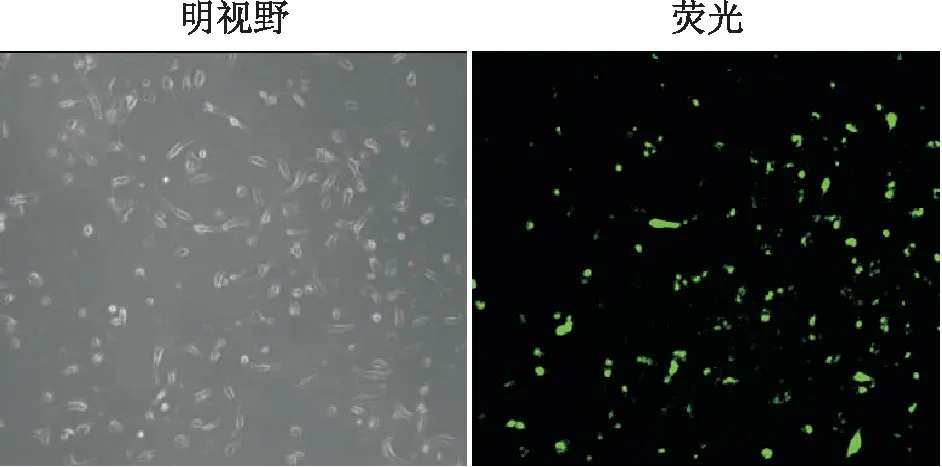
图1 转染 miR-21 mimic后的HRCECs(×100)
2.2 补阳还五汤对高糖培养的HRCECs的miR-21表达的影响qRT-PCR检测结果显示,正常对照组、高糖组、补阳还五汤组、miR-21 mimic组miR-21相对表达量分别为0.993±0.015、5.892±0.341、1.264±0.063和106.677±5.787。经统计学处理,与正常对照组相比,高糖组HRCECs中miR-21相对表达量明显升高(P<0.001);与高糖组相比,miR-21 mimic组miR-21相对表达量明显升高(P<0.01),补阳还五汤组 miR-21相对表达量明显下降(P<0.001);补阳还五汤组与正常对照组HRCECs中miR-21相对表达量相比差异无统计学意义(P=0.296)。提示补阳还五汤可以抑制高糖诱导的HRCECs中miR-21表达增高。
2.3 miR-21在补阳还五汤抑制高糖培养下的HRCECs自噬中的作用各组HRCECs中LC3蛋白表达见图2。与正常对照组比较,高糖组和miR-21 mimic组HRCECs中LC3蛋白相对表达量均升高,差异均有统计学意义(均为P<0.05),且miR-21 mimic组HRCECs中LC3蛋白相对表达量高于高糖组,差异有统计学意义(P=0.001)。补阳还五汤组HRCECs中LC3蛋白相对表达量低于高糖组和miR-21 mimic组,差异均有统计学意义(均为P<0.05),与正常对照组比较差异无统计学意义(P=0.197)。miR-21 mimic+补阳还五汤组HRCECs中LC3蛋白相对表达量低于miR-21 mimic组,但高于补阳还五汤组,差异均有统计学意义(均为P<0.05),与高糖组比较差异无统计学意义(P=0.930)(图2)。
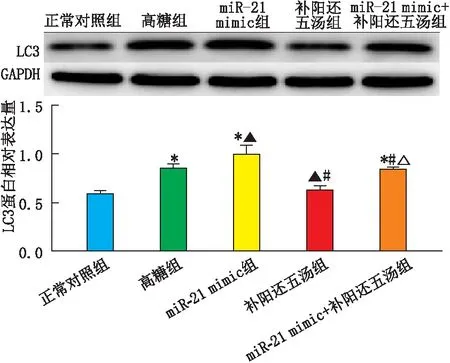
图2 Western blot检测各组HRCECs中LC3蛋白表达 与正常对照组比较,*P<0.05;与高糖组比较,▲P<0.05;与miR-21 mimic组比较,#P<0.05;与补阳还五汤组比较,△P<0.05。
3 讨论
随着DR发病率的逐年上升,寻求有效控制DR病程及减少并发症的治疗方法迫在眉睫。miRNA在DR的发病机制中发挥着重要作用。已有研究发现,miR-21不仅在DR患者血清中表达上调,而且在增生型DR患者的血清中miR-21表达水平较非增生型DR患者中的表达水平明显上调[12]。血浆miR-21可通过负向调控染色体上的磷酸酶张力蛋白同源性缺失导致下游的血管内皮生长因子表达量增高,进而促进新生血管生成,推进了DR的发展速度[13-14]。国外有学者研究发现,在DR大鼠模型中血管内皮细胞的miR-21表达显著高于对照组,miR-21可进一步激活炎症介质通路,促进血管炎症的发生,亦可通过诱导细胞分化和调节炎症反应参与DR的进展[15-17]。本研究通过细胞实验发现了高糖环境下HRCECs的miR-21表达较正常对照组明显增高,同样证实了miR-21参与微血管内皮细胞的高糖损伤过程。
自噬是细胞在生理或病理因子作用下,通过溶酶体途径对错误折叠的蛋白质和功能受损的细胞器进行有效识别和降解的过程[18]。因此,自噬被认为是细胞除凋亡和坏死之外的第三种死亡方式。研究发现,在高糖环境下,色素上皮细胞、视网膜 Müller 细胞、血管内皮细胞均发生自噬[19]。高糖可以激活视网膜血管内皮细胞自噬,最终通过影响细胞的增殖、分化,进而提升细胞迁移和管腔形成能力,发挥促进血管生成的作用[20-21]。LC3 是自噬活化过程的关键蛋白,是观察自噬现象是否存在、研究自噬活性较为可靠的生物学标志物[22-23]。本研究发现,高糖环境下的HRCECs 的LC3蛋白表达较正常对照组升高,与文献报道[20-21]结果相似。此外有研究表明,miRNA参与调控细胞的自噬,如miR-21可以影响高糖损伤的足细胞模型的自噬[9]。为明确高糖下miR-21对HRCECs自噬的影响,本研究检测了LC3蛋白的表达,结果发现,在转染了miR-21 mimic的HRCECs中,LC3蛋白的表达量进一步增高,说明HRCECs中miR-21的表达对细胞自噬有一定的影响。
DR为中医“消渴内障病”,其病位在瞳神。祖国医学认为,DR的发展经历了由气阴两虚至肝肾亏虚再至阴阳两虚的转化特点,虚、痰、瘀是发病过程中3个重要致病因素[24];且在非增生期的早期表现以“虚”为主,至中后期表现以“瘀”为主,最终发展为增生型DR,出现新生血管是痰瘀互结的病理产物[25]。有学者认为,DR以“气虚”为本,“血瘀”贯穿DR发病的始终,不同发病阶段病机有所差异,但“气虚血瘀”贯穿整个疾病的始终,这为益气活血法治疗消渴奠定了理论基础[26-28]。补阳还五汤具有补气活血通络之功效,虽然是治疗中风的名方,但目前已被临床广泛应用于治疗各科疾病,其在治疗糖尿病及其诸多并发症中具有显著的疗效,能促进内皮祖细胞修复损伤的血管内皮[29]。本课题组前期研究发现,补阳还五汤加减方在治疗DR及其相关并发症中有着增效作用[10],但其机制尚未明了,本研究在前期已经证明的补阳还五汤减轻高糖环境下HRCECs自噬的基础上,进一步探讨了miR-21的作用。结果表明,补阳还五汤可以下调高糖环境下HRCECs的miR-21表达,并降低高糖环境下转染miR-21 mimic的HRCECs的LC3蛋白表达。说明补阳还五汤下调miR-21和LC3表达的作用相互影响。
综上所述,高糖环境中,miR-21介导了HRCECs的自噬,补阳还五汤可以下调HRCECs的miR-21表达,进而减少细胞自噬,对高糖导致的HRCECs损伤起到保护作用。

