微生物发酵转化皂苷类化合物机制的研究进展
李 倩,于 丹,国立东,都晓伟
微生物发酵转化皂苷类化合物机制的研究进展
李 倩,于 丹,国立东,都晓伟*
黑龙江中医药大学药学院,黑龙江 哈尔滨 150040
皂苷类化合物是天然药物中存在的一类重要化学成分,通过微生物技术可以将其转化为多种衍生物,常用的微生物主要为细菌和真菌,转化反应以水解脱去糖基为主,来提高转化产物的生物利用度和药理活性。此外,通过羟基化、糖基化、羰基化和酯化等反应,能够降低底物的不良反应,改善药物功效。甾体皂苷的微生物转化主要以皂苷与皂苷元之间的相互转化为主,是实现某些特殊皂苷类化合物规模化生产的有效途径。以人参皂苷、甘草次酸、黄芪皂苷、薯蓣皂苷、知母皂苷等为例,分析并阐述皂苷类化合物的微生物发酵转化机制,以期为皂苷类成分生物合成及新药研究开发提供参考。
微生物发酵;三萜皂苷;甾体皂苷;人参皂苷;甘草次酸;黄芪皂苷;薯蓣皂苷;知母皂苷;生物转化;机制
皂苷类化合物是药用植物重要的活性成分,广泛存在于黄芪、黄精、三七、桔梗、人参、甘草、柴胡、知母、灵芝等中药材中,具有保护心脏、增强免疫、抗炎、抗病毒等药理作用。作为高相对分子质量的两亲化合物,皂苷由亲脂的皂苷元和亲水的糖链部分组成[1],根据苷元结构的不同,其可划分为三萜皂苷和甾体皂苷,三萜皂苷的苷元由30个碳原子组成,甾体皂苷的苷元由27个碳原子组成。根据连接糖链数目不同,其分为单糖链皂苷、双糖链皂苷及三糖链皂苷,也有在糖链末端通过酯键连接其他基团的结构。由于相对分子质量大,膜通透性差,皂苷的体内生物利用度低,但可以通过断掉部分糖链等方法转化成小分子化合物来促进吸收,亦可通过生物转化方法进行结构修饰,以提高药物的吸收利用,增强药物的作用[2]。
微生物转化是利用微生物发酵药物,通过微生物产生的酶及酶系产物等催化药物部分成分发生特定的化学反应,进行结构修饰获得新的化合物或其他药物成分。微生物在发酵过程中可以利用药物中多糖、纤维、蛋白质等成分获取养分,药物中低活性有效成分被转化为高活性有效成分。研究表明,微生物转化具有反应特异性强、副产物少、条件温和、对环境友好等优点,且微生物繁殖能力强、生长周期短、适应能力好,微生物发酵转化技术被广泛应用于天然药物合成及结构修饰,以达到减毒增效的目的[3]。
1 微生物转化三萜皂苷
三萜皂苷通常是指骨架由30个碳原子组成的萜类化合物,一般是皂苷元与糖类结合或游离于植物中。三萜皂苷具有广泛的药理活性,如抗病毒、抗炎、抗菌、抗肿瘤、抗过敏等,被应用于多种疾病的治疗,在人参、甘草、黄芪等药用植物中含量较高,作为主要成分发挥药效。
1.1 人参皂苷
人参皂苷是五加科植物人参C. A. Mey.、西洋参L.、三七(Burk.) F. H. Chen等药材中的主要活性成分,具有抗衰老、抗炎、抗老年痴呆、抗肿瘤、抗抑郁、抗心肌缺血、抗氧化、增强免疫等生物活性[4]。迄今为止,已报道180多种人参皂苷,并有60多种皂苷结构被确定,包括含量较高的主要人参皂苷和含量极少的稀有人参皂苷。人参皂苷主要包含人参皂苷Rb1、Rc、Rd、Re、Rf、Rg1等,稀有人参皂苷包含人参皂苷Rh1、Rh2、CK、Rh4、Rk1、Rg3、Rg5、Rk3等。众多学者发现,稀有皂苷具有更高的药用价值,开发潜力大,因而将主要人参皂苷转化为稀有人参皂苷是多年来研究的热点[2]。近年来,对人参皂苷微生物转化的报道较多,挖掘出了一定量的发酵菌株,其转化途径及发酵菌种情况见表1和图1。
微生物发酵转化人参皂苷的过程,主要依赖于微生物所产生的一系列酶系产物,如β-葡萄糖苷酶、α--阿拉伯呋喃糖苷酶、α-鼠李糖苷酶等,这些酶主动水解人参皂苷中的糖基,促使人参皂苷发生转化。
发酵过程中的主要作用酶是β-葡萄糖苷酶,但不同微生物来源的β-葡萄糖苷酶对糖苷键的水解作用不同,其水解的原因尚不明确。若转化人参皂苷Rb1时,对C-20位糖基选择性更高,则水解外侧1分子葡萄糖获得中间产物人参皂苷Rd,如冬虫夏草菌、锥毛壳菌、伯克霍尔德菌GE17-7、长柄木霉、黑曲霉J7、副干酪乳酪杆菌坚韧亚种等;若对C-3位糖基选择性更高,则获得中间产物绞股蓝皂苷ⅩⅤII[17],如类消化乳杆菌LH4。中间产物人参皂苷Rd的C-20、C-3位仍然存在糖基,因此β-葡萄糖苷酶能继续催化其生成不同的产物。对C-3位糖基选择性更高,则生成人参皂苷F2,如冬虫夏草菌、裂褶菌、黑曲霉J7等;若对C-20位糖基选择性更高,则生成产物人参皂苷Rg3,如伯克霍尔德菌GE17-7、长柄木霉、副干酪乳酪杆菌坚韧亚种等。裂褶菌、黑曲霉J7等菌株的β-葡萄糖苷酶可以继续水解使人参皂苷F2生成稀有人参皂苷CK。来自副干酪乳酪杆菌坚韧亚种MJM60396的β-葡萄糖苷酶可以继续水解人参皂苷Rg3中C-3位的1分子葡萄糖,获得终产物人参皂苷Rh2[16]。吴秀丽等[9]从人参根际分离并筛选出了1株真菌黑曲霉SRS-69,其发酵过程中产生的β-葡萄糖苷酶同样可以水解人参皂苷Re的C-20位糖基产生人参皂苷Rg2,并可以水解人参皂苷Rg1的C-3位糖基和人参皂苷Rf的C-6位糖基生成人参皂苷Rh[17]。
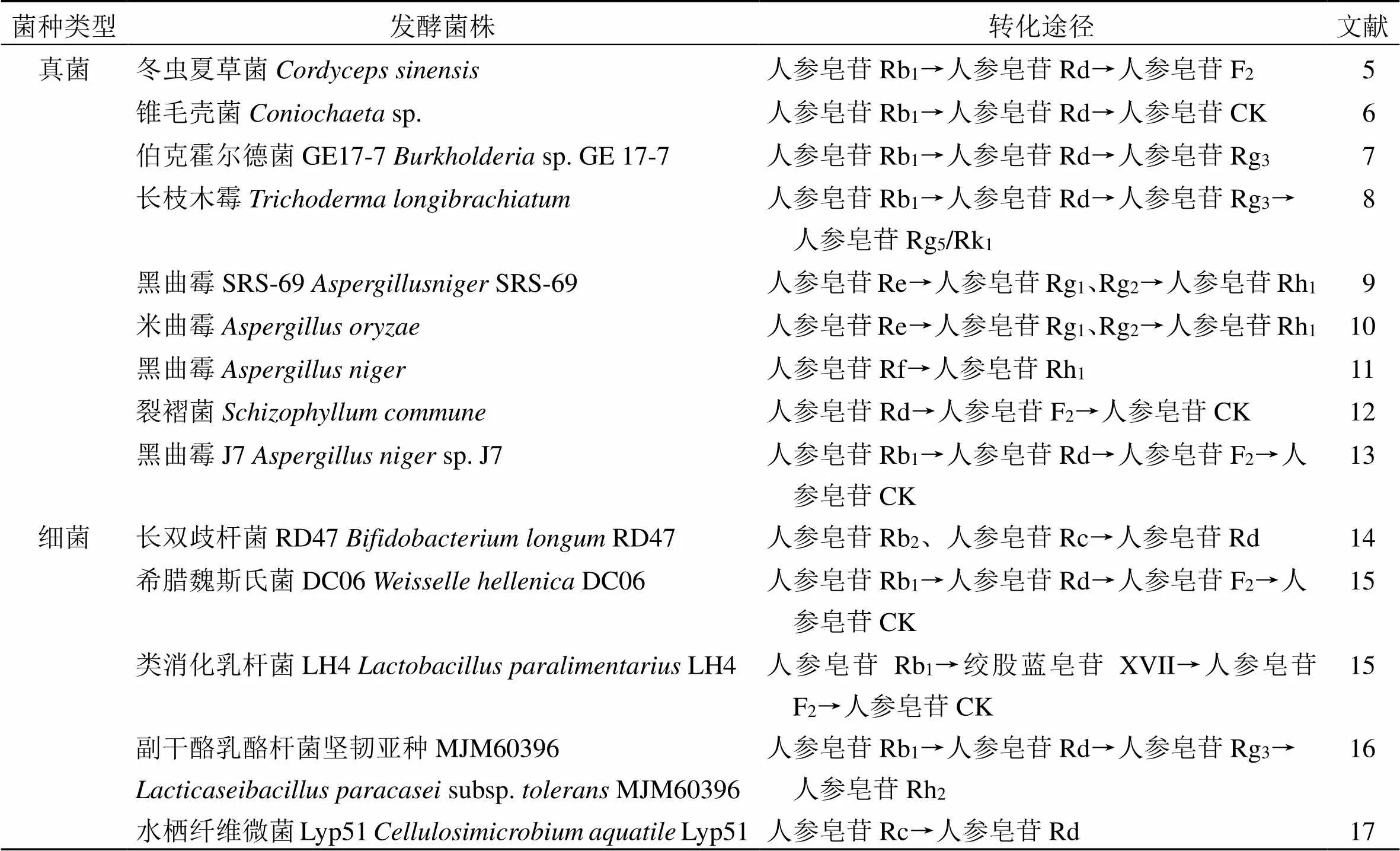
表1 人参皂苷微生物转化途径及发酵菌种
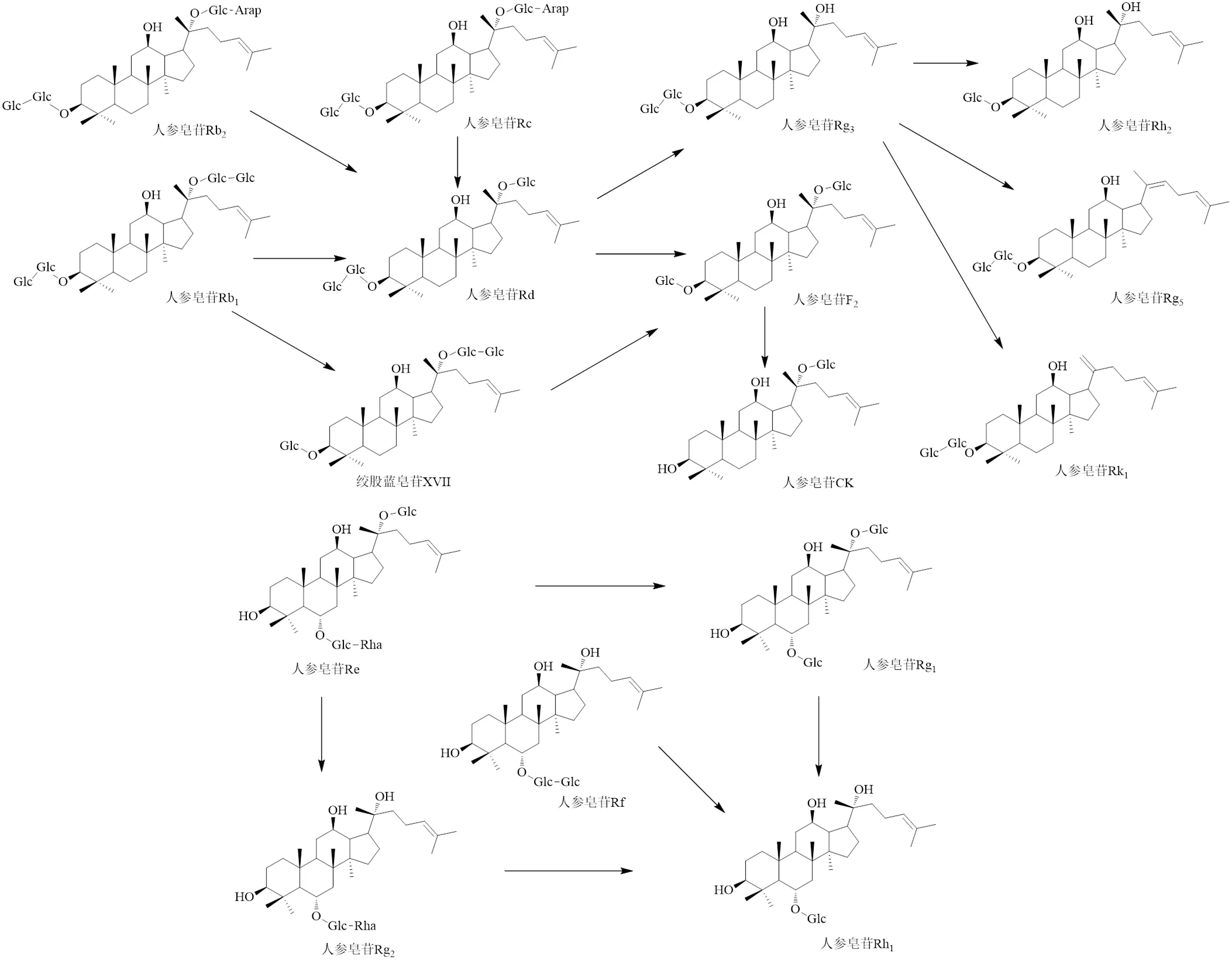
图1 人参皂苷的微生物转化途径
发酵过程中的次要作用酶为α-鼠李糖苷酶和α--阿拉伯呋喃糖苷酶。α-鼠李糖苷酶专注于水解人参皂苷C-6位外侧的鼠李糖基。黑曲霉SRS-69发酵转化人参皂苷Re、Rg2,其中α-鼠李糖苷酶水解人参皂苷Re和Rg2C-6位的鼠李糖基分别产生人参皂苷Rg1、Rh1[9];来自茅台酒曲的水栖纤维微菌Lyp51发酵转化人参皂苷Rc,产生的α--阿拉伯呋喃糖苷酶作用于人参皂苷Rc C-20位的阿拉伯呋喃糖苷键,生成终产物人参皂苷Rd。
1.2 甘草皂苷
甘草皂苷是豆科植物甘草Fisch.中发挥药理作用的主要成分,目前分离出甘草皂苷20余种,皂苷结构一般是以3β-羟基齐墩果烷型五环三萜为苷元,连接2分子葡萄糖醛酸为主构型,具有保肝、抗病毒、抗动脉粥样硬化、抗炎、抗癌、抗哮喘、抗过敏等药理活性[18-20]。同样为三萜皂苷,甘草皂苷像人参皂苷一样,结构中糖链的多少直接影响其药理作用和生理功能,可通过水解反应去除部分或全部糖基来提高或改变其药理作用。微生物发酵转化主要是以甘草酸和甘草次酸为底物,探究其转化途径及机制。
1.2.1 甘草酸 其是从传统中药甘草根部提取出来的一种三萜类化合物,不仅可以作为天然的食品添加剂,还具有抗肿瘤、抗过敏、抗氧化、抗炎等多种药理活性[19],在临床上应用于支气管炎、肝炎等的治疗,同时也用于疾病的辅助治疗,如可缓解新型冠状病毒肺炎患者的炎症反应等。甘草酸虽药理作用较广,但其结构中含有2分子葡萄糖醛酸,极性较大,不易透膜,且具有首关效应[20],导致生物利用度低,故可以通过去除葡萄糖醛酸基团来提高其生物利用度,并且不减弱药理活性。多年以来,人们对甘草酸微生物发酵转化的相关研究颇多,发现了许多转化菌种,但甘草酸的转化途径比较简单,基本概括为甘草酸→甘草次酸、甘草酸→单葡萄糖醛酸甘草次酸(glycyrrhetinic acid monoglucuronide,GAMG)。
用于微生物转化的菌株一般于发酵过程中产生β--葡萄糖醛酸苷酶,不同来源的β--葡萄糖醛酸苷酶对糖苷键的水解作用具有立体选择性,一部分水解掉甘草酸的1分子葡萄糖醛酸得到单葡萄糖醛酸甘草次酸,另一部分则可以水解2分子葡萄糖醛酸得到甘草次酸。GAMG因只含有1分子葡萄糖醛酸,极性介于甘草酸和甘草次酸之间,具有很好的跨膜运输能力,溶解度较高,生物利用度增大。
研究表明,GAMG的甜度比甘草酸高5倍,可作为牛奶饮品、饮料、汤料等食品的添加剂[21],增加食品风味,也可作为遮盖其他腥味、苦味等的去苦剂。在药理作用方面,杨永安[22]通过动物实验发现甘草酸衍生物在抗肿瘤活性上差异较大,β构型化合物的活性比α构型更弱,二糖结构的化合物活性比单糖化合物的更弱,显而易见,18α-GAMG具有比甘草酸和甘草次酸更高的抗肿瘤活性,相对安全且不良反应较小,特别是对于肝癌有更好的效果,是潜在的抗肝癌新药成分。微生物转化途径及发酵菌株见表2和图2。
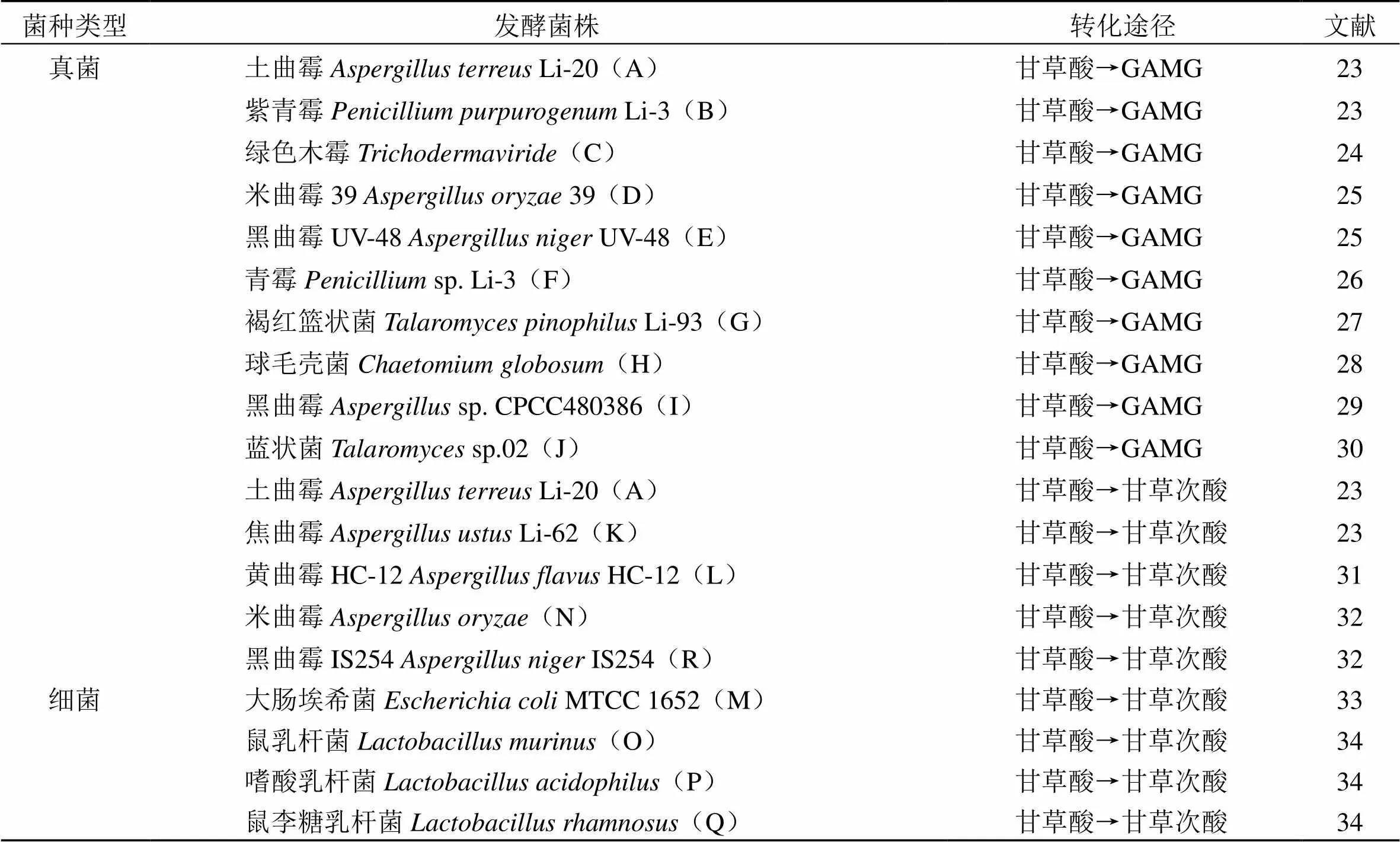
表2 甘草酸微生物转化途径及发酵菌株
A~R代表不同发酵菌株,同图2
A—R represents different fermentation strains, same as fig. 2
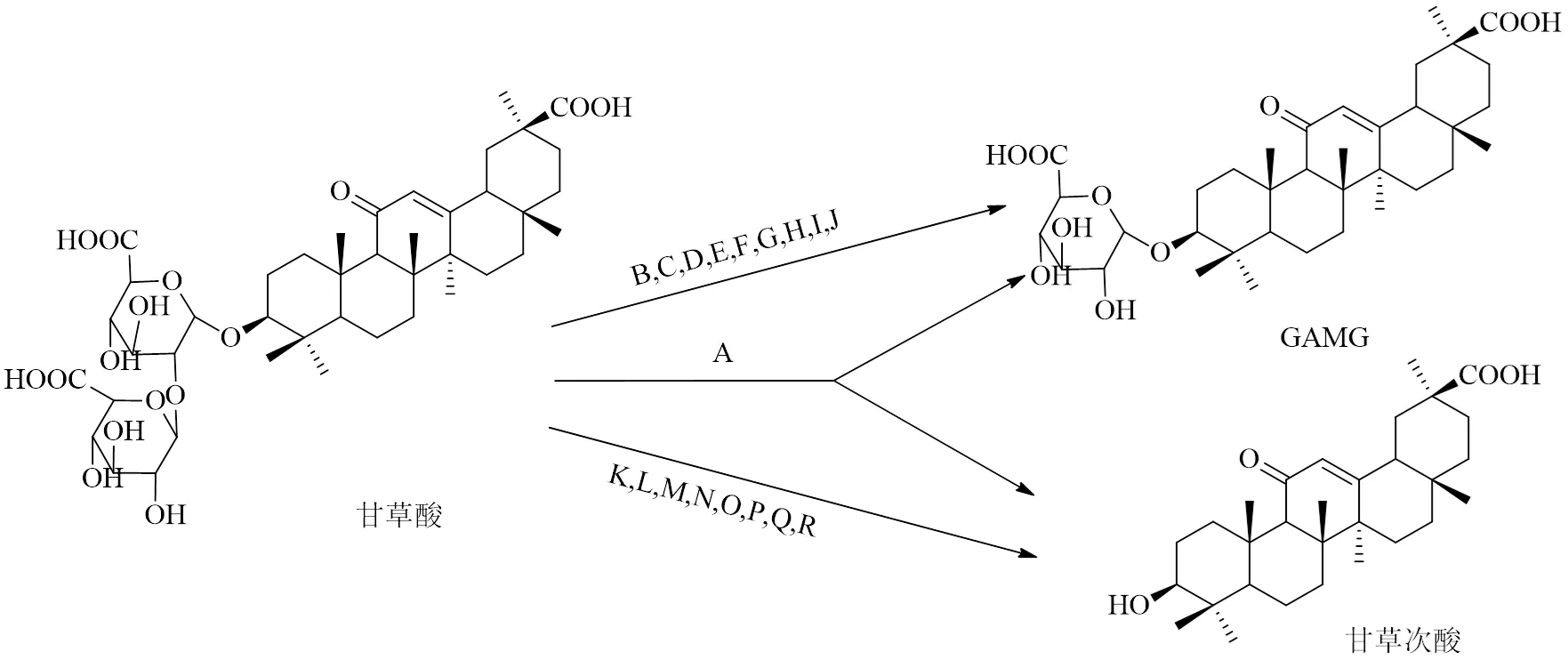
图2 甘草酸的微生物转化途径
1.2.2 甘草次酸 其是甘草酸三萜苷元成分,药理作用包括抗病毒、保肝、抗癌等,可通过抑制炎症因子的产生以及调节相关通路来降低炎症反应,主要作用部位在肝脏[35]。对于一些原癌细胞或能够引发恶性肿瘤的病毒均有抑制作用,如艾滋病毒、肝炎病毒等,但甘草次酸具有醛固酮样活性,易导致低血钾、高血压、水肿等不良反应,且极性小,高浓度时容易产生毒性,所以对其进行结构修饰来改善溶解性以及减轻不良反应[36]。甘草次酸的结构改变是在特定位点进行的化学反应,如羟基化、羰基化、糖基化、乙酰化、酯化等,羟基化反应发生在C-1、C-6、C-7、C-15、C-24、C-27位,羰基化主要发生在C-3和C-7位,糖基化主要出现在C-3和C-30位上,乙酰化只发生在C-3位,酯化只发生在C-7与C-27位之间并成环。甘草次酸微生物转化产物及发酵菌种见表3和图3。甘草次酸本身无神经保护活性,但当C-3位无羰基化时,C-7位羟基化、C-15位羟基化、C-7位和C-15位同时羟基化时,神经保护活性会显著增强。
1.3 黄芪皂苷
黄芪皂苷是豆科植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao或膜荚黄芪(Fisch.) Bge主要活性成分之一,包括黄芪皂苷I、黄芪皂苷II、黄芪皂苷III、黄芪甲苷等[46],药理作用广泛,如抗病毒、抗哮喘、抗炎、抗纤维化、抗氧化、调节免疫功能等,黄芪皂苷在黄芪的研究中占有举足轻重的位置,尽管目前国内关于黄芪微生物发酵方面的研究并不十分丰富,但均极具代表性,可以通过优化皂苷结构而得到新的化合物,从而降低不良反应,提高药理活性。
1.3.1 真菌发酵 阮鸣[47]使用香菇(Berk.) Pegler、灵芝(Leyss. ex Fr.) Karst、姬松茸Murill和桑黄(L. ex Fr)等不同的药(食)用真菌发酵黄芪,发现均可以将黄芪甲苷转化成异黄芪甲苷。并推测其转化机制为灵芝菌发酵过程中所产生的某种木糖苷酶水解黄芪甲苷的1分子木糖后将其转化成异黄芪甲苷。
刘晓会[48]筛选出了1种能够从黄芪总皂苷中高效转化出黄芪甲苷的菌株伞枝犁头霉AS2,在黄芪总皂苷中鉴定出4个可以转化为黄芪甲苷的化合物,分别为黄芪皂苷I、黄芪皂苷II、异黄芪皂苷I、异黄芪皂苷II,这4个化合物与黄芪甲苷的区别就是结构上多了1个或2个乙酰基,因此揭示了伞枝犁头霉中含有黄芪皂苷去乙酰化酶,并且此酶对底物的专一性较差,继而验证了4个前体化合物转化为黄芪甲苷的具体途径:黄芪皂苷I→(异黄芪皂苷II、黄芪皂苷II)→黄芪甲苷、黄芪皂苷II→黄芪甲苷、异黄芪皂苷I→黄芪皂苷II→黄芪甲苷、异黄芪皂苷II→黄芪皂苷II→黄芪甲苷。黄芪甲苷的抗病毒、抗癌、抗糖尿病、抗心肌损伤等作用使其开发成为临床新药,解决了化学合成方法较为复杂且困难的问题。
1.3.2 细菌发酵 Wang等[49]从土壤中分离并筛选出了一株芽孢杆菌LG-502sp. LG-502,并推测其对黄芪甲苷的转化途径为黄芪甲苷→ cyclogaleginoside B→环黄芪醇,芽孢杆菌中的葡萄糖苷酶和木糖苷酶在此途径中发挥了主要作用,由于2种酶存活的最适温度、最适pH等条件不同,葡萄糖苷酶在芽孢杆菌的培养条件下比木糖苷酶活性更高,所以黄芪甲苷优先脱掉1分子葡萄糖,其次脱掉1分子木糖,得到环黄芪醇。黄芪甲苷结构中含有糖基,极性较大,影响生物利用度,而脱掉2分子糖基后的环黄芪醇具有良好的膜通透性,并且环黄芪醇可以激活端粒酶,达到抗衰老、增强免疫力等功效[50],在临床医药中应用广泛。

表3 甘草次酸微生物转化产物及发酵菌株
a~j代表不同发酵菌株,同图3
a—j represents different fermentation strains, same as fig. 3

图3 甘草次酸微生物转化途径[45]
黄芪皂苷微生物发酵转化途径见图4。
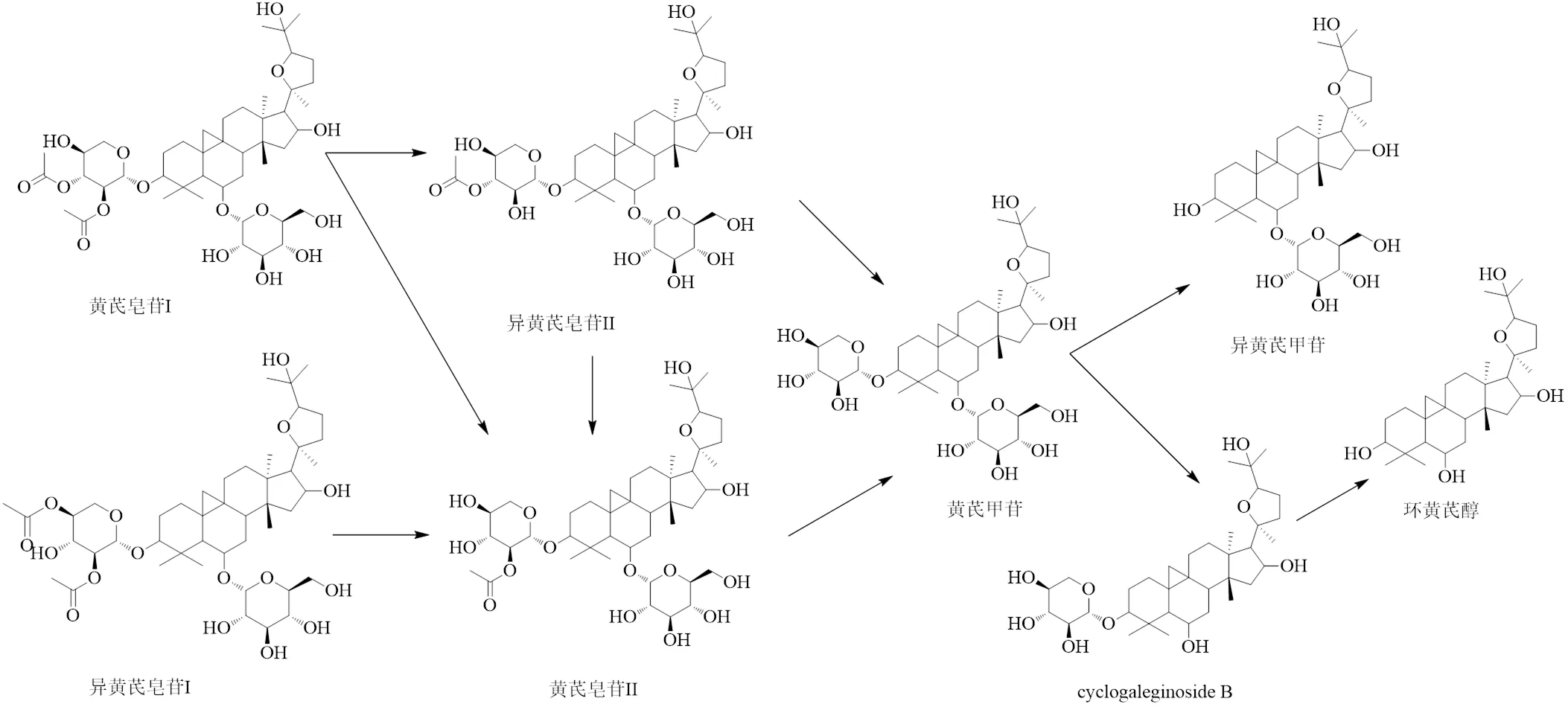
图4 黄芪皂苷微生物转化途径
人参、甘草、黄芪的三萜皂苷生物转化中微生物以真菌居多,反应机制以水解反应为主,通常发生在C-3、C-6、C-20位等,脱掉糖基,既能提高生物利用度,也能选择性增强抗癌、抗病毒、抗炎等药理活性;除了水解反应,还包括去乙酰化、羟基化、糖基化、羰基化、乙酰化等反应,具体发生在C-1、C-6、C-7、C-15、C-24、C-27位等,降低底物的不良反应,改善功效,有利于药物的研究和开发。
2 微生物转化甾体皂苷
甾体皂苷是以螺甾烷类化合物与糖基结合的甾体苷类,基本母核由27个碳原子构成,并且结构中具有6个环,为螺甾烷衍生物。较早以前,甾体皂苷已经成为激素类以及甾体避孕药等的原料,后期临床中开发出了多种新药,在治疗心绞痛、心肌缺血、糖尿病、心脏病等方面有明显成效,应用甚广。甾体皂苷多存在于单子叶植物中,双子叶植物中非常少,在穿山龙、黄精、重楼、知母等药用植物中常见[51]。
2.1 薯蓣皂苷
甾体皂苷微生物转化中比较典型的代表为薯蓣皂苷。薯蓣皂苷主要存在于薯蓣科植物黄山药Prain et Burk.、穿龙薯蓣Makino和盾叶薯蓣C. H. Wright中,具有抗癌、降血糖、调血脂、抗氧化等作用[52],并且仍然作为合成甾体避孕药物以及部分激素类药物的重要原料,但薯蓣皂苷脂溶性较大,生物利用度不高,对薯蓣皂苷进行一定的结构优化和修饰,可提高其生物利用度和药效作用。
2.1.1 真菌发酵 刘琳[53]发现盾叶薯蓣中含量较多的甾体皂苷为薯蓣皂苷和盾叶新苷,利用哈茨木霉可将这2种成分转化成薯蓣皂苷元,并且苷元得率较高,转化途径见图5。发酵过程中,哈茨木霉所分泌的纤维素酶可破坏盾叶薯蓣的细胞壁,使皂苷类成分释放出来,盾叶新苷在葡萄糖淀粉酶作用下脱掉鼠李糖基,继而被胞外β-葡萄糖苷酶水解掉葡萄单糖得到延龄草次苷,延龄草次苷进入菌体胞内,促使哈茨木霉产生胞内β-葡萄糖苷酶,进而水解掉延龄草次苷末端的葡萄二糖,最终生成薯蓣皂苷元。如果利用米曲霉CICC 2436[54]转化2种薯蓣皂苷,主要是α--鼠李糖苷酶、β--葡萄糖苷酶以及外切-1,4-β--葡萄糖苷酶发挥水解作用,并且鼠李糖的水解速度比葡萄糖水解速度快,先水解掉鼠李糖,再从末端逐个水解掉葡萄糖得到薯蓣皂苷元,因此盾叶新苷不能转化成为薯蓣皂苷。Zheng等[55]采用里氏木霉发酵转化盾叶薯蓣皂苷为薯蓣皂苷元,而延龄草次苷是中间产物,相关酶首先水解掉外侧的鼠李糖,再裂解葡萄糖苷键,去掉所有糖链获得苷元[56],此菌转化薯蓣皂苷元的效率可达90%。郭梦真[57]筛选出的1株塔宾曲霉,可以将薯蓣皂苷先转化为延龄草次苷,再转化为薯蓣皂苷元,并揭示了塔宾曲霉先水解掉外侧鼠李糖,后水解葡萄糖的规律。薯蓣皂苷元与其他薯蓣皂苷衍生物不同的是,没有侧链或糖链,苷元是发挥药理作用的中心结构,所以薯蓣皂苷元比其他多侧链衍生物的药效更强一些。
利用从穿龙薯蓣中提取分离的少根根霉原变种var.发酵穿龙薯蓣药液,可使薯蓣皂苷元含量增加,此菌株能够高效转化薯蓣皂苷,且提高薯蓣皂苷元的提取率[58]。一方面菌株发酵过程中产生的生物酶会使药液中的细胞壁破裂,薯蓣皂苷元破壁而出,从而提高了苷元提取率;另一方面菌株发酵所产生的淀粉酶能够断裂糖苷键,导致药材中的薯蓣皂苷脱掉糖链,转变成苷元。陈宇[59]从盾叶薯蓣根部筛选出3株菌,均能将薯蓣皂苷转化为薯蓣皂苷元,分别是米曲霉GIM 3GIM 3、No.2.20140425和泡盛曲霉,它们的转化机制大体相同,也是通过产生糖苷酶,逐步水解糖链得到次级苷以及苷元。经筛选及优化,发现No.2.20140425和泡盛曲霉混合发酵后的转化率最高,达到71.57%。
吴广畏[60]发现真菌杂色云芝(L.) Fr.可以发酵转化薯蓣皂苷元,转化途径见图6,由细胞色素P450单加氧酶系催化生成5个产物,首次发现薯蓣皂苷元C-21位甲基可以被羟基化,并且在C-7、C-12、C-15位都可以羟基化,据推测,5个产物应该是由不同的细胞色素P450氧化酶催化而成。
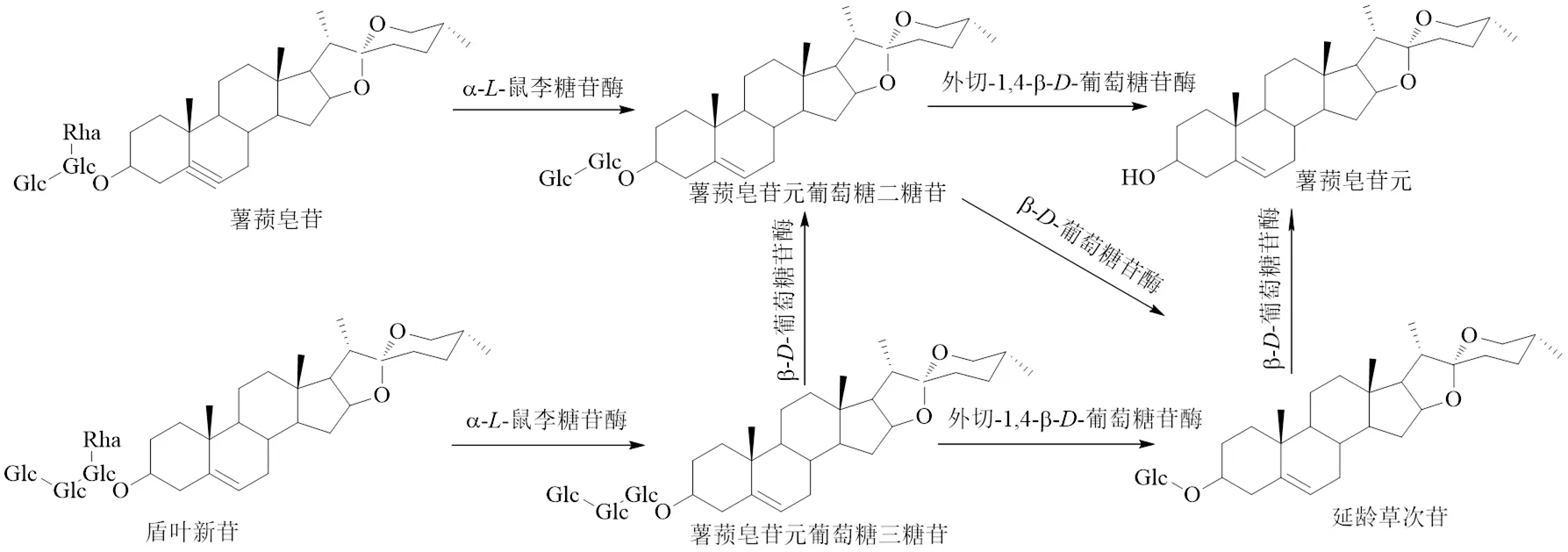
图5 薯蓣皂苷的微生物转化途径
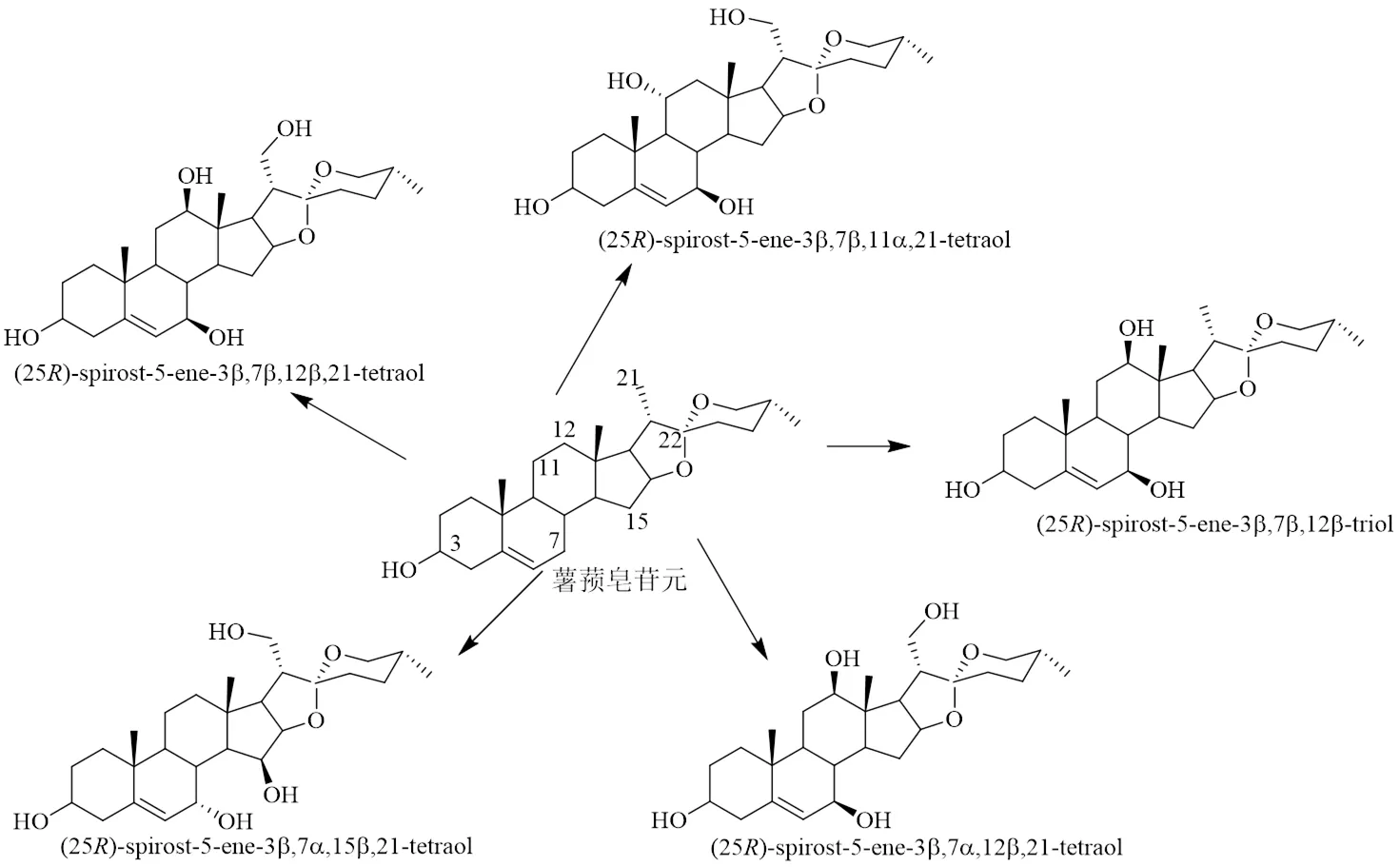
图6 杂色云芝发酵转化薯蓣皂苷元的途径
有报道利用刺孢小克银汉霉CGMCC 3.2716的静息细胞发酵转化薯蓣皂苷元,得到4种代谢物,并推测出了1个中间产物(化合物I)[61],见图7,研究发现该菌会产生不同的细胞色素P450单加氧酶,一种酶可以只催化C-7位羟基化,一种酶可以催化C-7位或C-11位发生羟基化,还有一种酶可以催化C-7位或C-12位发生羟基化,其中的脱氢酶通过中间产物促使C-11位羟基脱氢成酮,但由于反应速度过快,只能测到最终产物(25)-spirost-5-ene-3β,7β-diol-11-one。

图7 刺孢小克银汉霉发酵转化薯蓣皂苷元的途径
全波等[62]培养米曲霉AS3.951来发酵转化原薯蓣皂苷。米曲霉既可以先水解原薯蓣皂苷C-3位外侧的一分子鼠李糖基生成26--β-glucopyranosyl(25)-22-hydroxy-5-ene-furostane-3β,26-diol-3--[α-rhamnopyranosyl]-β-glucopyranoside(8-2),并且其他位置不发生变化;也可以将C-20位羟基还原成双键形成26--β-glucopyranosyl(25)-5,20 (22)-dienefurostane-3β,26-diol-3--[(α-rhamnopyranosyl)- α-rhamnopyranosyl]-β-glucopyranoside(8-3)和26--β-glucopyranosyl(25)-5,20(22)-diene-furostane-3β,26-diol-3--[α-rhamnopyranosyl]-β-glucopyranoside(8-4);还可以继续断裂C-26位糖链形成diosgenin-3--[(α-rhamnopyranosyl)-α-rhamnopyranosyl]-β-glucopyranoside(8-5)和diosgenin-3--[α-rhamnopyranosyl]- β-glucopyranoside(8-6)。崔乃菠等[63]利用酵母菌发酵菊叶薯蓣,将原薯蓣皂苷转化成薯蓣皂苷,通过工艺优化达到富集薯蓣皂苷的目的,并推测转化途径见图8,原薯蓣皂苷属于呋甾皂苷,薯蓣皂苷属于螺甾皂苷,呋甾皂苷上的糖链比螺甾皂苷的多,且水溶性较高,研究表明,C-26位的糖苷键比C-3位的糖苷键更容易断裂,故通常呋甾皂苷水解掉C-26位糖苷键转化为螺甾皂苷。酵母菌产生相关生物酶,使原薯蓣皂苷在发酵过程中自薯蓣药材细胞中破壁而出,同时使薯蓣皂苷更好地扩散于提取介质中,其中的水解酶使原薯蓣皂苷C-26位上糖链断裂获得薯蓣皂苷,因此薯蓣皂苷含量有了显著的提升。

图8 原薯蓣皂苷的微生物转化途径
2.1.2 细菌发酵 1株弗吉尼亚链霉菌IBL14被报道将薯蓣皂苷元发酵转化为异壬酮,中间产物为薯蓣酮,研究人员揭示其转化机制是由菌株发酵产生的胆固醇氧化酶将苷元催化生成薯蓣酮,薯蓣酮C-25位发生羟基化得到异壬酮,这是首次发现薯蓣皂苷元C-25位上的叔羟基化反应[64]。转化途径见图9。
薯蓣皂苷出现了皂苷与皂苷元之间的转化,同样以糖苷酶水解脱糖为主,进一步暴露苷元结构。在这些微生物发酵过程中,产生了罕见的细胞色素P450单加氧酶,催化特定位点发生羟基化。而另一种特殊的胆固醇氧化酶导致羰基化,催化生成新的化合物。

图9 弗吉尼亚链霉菌发酵转化薯蓣皂苷元的途径
2.2 知母皂苷
知母皂苷主要来源于百合科植物知母Bunge,属于甾体皂苷类,包括知母皂苷I~IV、AI~AIV、BI~BIV等[65],知母皂苷具有抗肿瘤、抗抑郁、抗阿尔茨海默病、降血压、降血糖等药理活性[66],对于某些知母皂苷,改变构型或进行结构修饰可以增强其原有的药效或减轻不良反应。
Hu等[67]利用酿酒酵母发酵转化知母皂苷AIII,最终目标产物为其立体异构体(20,25)-5β-spirostane- 3β-ol-3--β-glucopyranosyl-β-galacopyanoside(10-1),知母皂苷AIII及其立体异构体均具有生长抑制作用,转化途径见图10。此转化过程中,知母皂苷AIII首先在糖基转移酶催化下C-26位开环并发生糖基化反应生成知母皂苷BII;其次知母皂苷BII脱水生成知母皂苷BIII;知母皂苷BIII通过加水、环化、重排3个反应生成知母皂苷AIII的立体异构体;知母皂苷BII及知母皂苷BIII的C-15位羟基化分别生成15-羟基-知母皂苷BII和15-羟基-知母皂苷BIII。发酵工艺优化有望更高效地生产化合物10-1。
Zhao等[68]利用胶孢炭疽菌转化知母皂苷BII,转化途径见图11,通过鉴别其代谢物结构来推断药理作用机制。研究证明,此菌中的糖苷酶可以同时水解C-3位和C-26位葡萄糖得到知母皂苷AI和知母皂苷AIII,并产生了水解产物的C-22位对映异构体[(25)-5β-spirostan-3β-yl]2--(β-glucopyranosyl)-β-galactopyranoside(11-1)和25()-22β--spirostane-3β--galactopyranside(11-2),最终异构体的转化量多于原型,这是关于单一微生物同时裂解C-3位和C-26位糖基的首次报道。
甾体皂苷的微生物转化中,多数以皂苷与皂苷元之间的相互转化为主,其中在C-3、C-26位通常会发生水解反应,羟基化主要发生在C-7、C-11、C-12、C-15、C-21、C-25位等,C-20位发生还原反应,C-26位易开环发生糖基化反应。与三萜皂苷相比,甾体皂苷的微生物转化机制简单,涉及到的反应类型少,但为特定衍生物的大规模生产提供了新方法。
3 结语与展望
通过微生物发酵技术,可以将皂苷类化合物转化为多种衍生物,为生物活性筛选提供新的结构,同时也是特殊皂苷类化合物扩大生产的有效途径。能够进行皂苷类成分生物转化的微生物种类繁多,包括细菌和真菌,转化机制主要有羟基化、糖基化、羰基化、水解和酯化等;与真菌相比,细菌的相关报道较少,且转化机制与真菌类似,而其他类型的微生物如放线菌的发酵和转化则更为少见。目前,微生物发酵转化皂苷类化合物取得了较大的进展,但在技术和方法上仍需着力解决以下几个方面的问题。首先,菌种的选育是微生物发酵的前提,大多数研究所选用的菌种包括3个来源:一是从能够产生糖苷酶的已知菌种中筛选出转化效率高的优良菌种;二是从药用植物生长环境中的微生物筛选出具有转化优势的优良菌种;三是从植株机体组织所含有的内生菌中筛选优良菌种,内生菌作为植株中不可或缺的一部分,与植株同生长、共进化,在转化药用植物的有效成分上具有不可比拟的优势。其次,皂苷与微生物发酵体系的稳定性是转化过程的重要方面,拥有稳定的转化体系,可以扩大培养规模,提高转化率,节约生产成本,因此开发固定化的发酵体系是解决问题的关键。此外,在优良的发酵菌种和稳定的发酵体系基础上,产物的分离技术仍有待提高,根据特定的产物结构开发应用合理且降低生产成本的分离手段,将会推进微生物发酵转化皂苷类化合物持续走向工业化进程。

图10 知母皂苷AIII的微生物转化途径
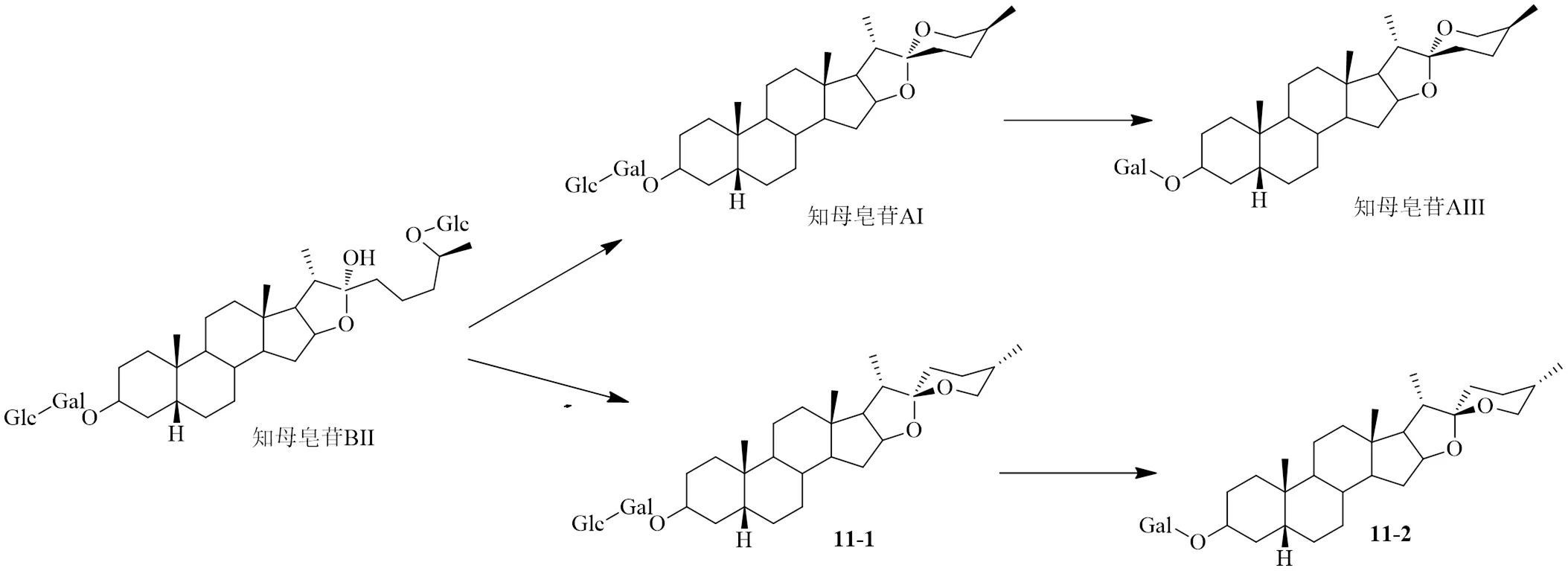
图11 知母皂苷BII微生物转化途径
微生物发酵转化皂苷类化合物的机制还有很大的研究空间,应用现代色谱、质谱等技术,深度挖掘皂苷类成分的转化原理,随着酶工程、蛋白组学、代谢组学、基因工程等技术的迅速发展,可以通过多基因集成的工程菌,实现皂苷类化合物多步骤的系列转化,为药物的基础性研究和新药研发提供新思路、新途径。
利益冲突 所有作者均声明不存在利益冲突
[1] Singh D, Chaudhuri P K. Structural characteristics, bioavailability and cardioprotective potential of saponins [J]., 2018, 7(1): 33-43.
[2] 李瑞婷. 生物转化法制备稀有人参皂苷及其生物活性研究[D]. 昆明: 昆明理工大学, 2020.
[3] 郑丽娜, 张明春. 中药有效成分的酶法生物转化 [J]. 时珍国医国药, 2010, 21(10): 2556-2558.
[4] Wang C M, Liu J, Deng J Q,. Advances in the chemistry, pharmacological diversity, and metabolism of 20()-ginseng saponins [J]., 2020, 44(1): 14-23.
[5] 许文迪, 闫炳雄, 邱智东, 等. 冬虫夏草菌生物转化人参皂苷Rb1的研究 [J]. 科学技术与工程, 2015, 15(31): 12-17.
[6] 郭从亮, 杨晓艳, 陈子明, 等. 一株植物内生菌sp.对三七总皂苷中人参皂苷Rb1的特异性转化含量测定 [J]. 中药材, 2016, 39(5): 1075-1078.
[7] 李俊莹, 武伦鹏, 康辰凯, 等. 人参内生菌sp. GE 17-7制备人参皂苷Rg3的研究 [J]. 生物学杂志, 2019, 36(2): 41-45.
[8] Ge F, Huang Z J, Yu H,. Transformation ofsaponins by steaming and[J]., 2016, 30(1): 165-172.
[9] 吴秀丽, 刘成, 陈靖. 黑曲霉对人参皂苷Re的微生物转化 [J]. 中国当代医药, 2011, 18(33): 7-9.
[10] Li Z P, Ahn H J, Kim N Y,. Korean ginseng berry fermented by mycotoxin non-producingand: Ginsenoside analyses and anti-proliferative activities [J]., 2016, 39(9): 1461-1467.
[11] Liu L, Gu L J, Zhang D L,. Microbial conversion of rare ginsenoside Rf to 20()-protopanaxatriol by[J]., 2010, 74(1): 96-100.
[12] Liu Z, Li J X, Wang C Z,. Microbial conversion of protopanaxadiol-type ginsenosides by the edible and medicinal mushroom: A green biotransformation strategy [J]., 2019, 4(8): 13114-13123.
[13] 高娟, 周安东, 原野, 等. 黑曲霉降解人参皂苷Rb1制备稀有皂苷compound K [J]. 生物技术进展, 2016, 6(2): 98-104.
[14] Ku S, You H J, Park M S,. Effects of ascorbic acid on α--arabinofuranosidase and α--arabinopyranosidase activities fromRD47 and its application to whole cell bioconversion of ginsenoside [J]., 2015, 58(6): 857-865.
[15] Quan L H, Kim Y J, Li G H,. Microbial transformation of ginsenoside Rb1to compound K byparalimentarius [J]., 2013, 29(6): 1001-1007.
[16] Palaniyandi S A, Son B M, Damodharan K,. Fermentative transformation of ginsenoside Rb1fromC. A. Meyer to Rg3and Rh2bysubsp.MJM60396 [J]., 2016, 21(5): 587-594.
[17] Hou J G, Xue J J, Sun M Q,. Highly selective microbial transformation of major ginsenoside Rb1to gypenoside LXXV byCNU120806 [J]., 2012, 113(4): 807-814.
[18] 李娜, 张晨, 钟赣生, 等. 不同品种甘草化学成分、药理作用的研究进展及质量标志物 (Q-Marker) 预测分析 [J]. 中草药, 2021, 52(24): 7680-7692.
[19] 赵云生, 毛福英, 赵启鹏, 等. 甘草多糖抗炎与抗胃溃疡作用研究 [J]. 亚太传统医药, 2015, 11(9): 12-14.
[20] 邓桃妹, 彭灿, 彭代银, 等. 甘草化学成分和药理作用研究进展及质量标志物的探讨 [J]. 中国中药杂志, 2021, 46(11): 2660-2676.
[21] 卢定强, 肖洁瑾, 李晖, 等. 一种制备异甘草次苷的方法: 中国, CN100999755A [P]. 2007-07-18.
[22] 杨永安. 18α-单葡萄糖醛酸甘草次酸及其衍生物的合成及生物活性评价 [D]. 南京: 南京大学, 2014.
[23] Wang C, Guo X X, Wang X Y,. Isolation and characterization of three fungi with the potential of transforming glycyrrhizin [J]., 2013, 29(5): 781-788.
[24] 王云. 微生物转化甘草酸生成单葡萄糖醛酸甘草酸 [J]. 食品工业科技, 2005, 26(11): 146-155.
[25] 吴少杰, 杨志娟, 朱丽华, 金风燮. 甘草皂苷生物转化的研究 [J]. 中草药, 2003, 34(6): 516-518.
[26] 冯世江, 李春, 李晖, 等. 葡糖酸苷酶生产菌株的筛选及其酶学特性的研究 [J]. 高校化学工程学报, 2007, 21(6): 977-982.
[27] Xu Y H, Feng X D, Jia J T,. A novel β-glucuronidase fromLi-93 precisely hydrolyzes glycyrrhizin into glycyrrhetinic acid 3--mono-β--glucuronide [J]., 2018, 84(19): e00755-e00718.
[28] 吴文婷. 植物内生真菌转化甘草酸生成单葡萄糖醛酸基甘草次酸 [D]. 南昌: 江西科技师范大学, 2016.
[29] 刘贻胜. 单葡萄糖醛酸甘草次酸的微生物转化及分离纯化 [D]. 鞍山: 辽宁科技大学, 2014.
[30] 郭立纯, 赵伟. 产单葡萄糖醛酸甘草次酸菌株的筛选及发酵条件的优化 [J]. 食品工业科技, 2017, 38(16): 88-94.
[31] 陈永强, 徐春, 徐凯, 等. 微生物发酵转化甘草提高其药效的研究 [J]. 四川大学学报: 自然科学版, 2007, 44(5): 1147-1150.
[32] 全艳玲, 刘贻胜, 徐云剑, 等. 甘草生物转化菌种选育 [J]. 中国酿造, 2013, 32(4): 123-125.
[33] 苏龙, 梁广波, 陈光丽, 等. 甘草酸微生物转化菌的筛选鉴定及发酵条件优化 [J]. 湖北农业科学, 2017, 56(10): 1918-1923.
[34] Yuan T J, Wang J, Chen L T,.murinus improved the bioavailability of orally administered glycyrrhizic acid in rats [J]., 2020, 11: 597.
[35] Li J Y, Cao H Y, Liu P,. Glycyrrhizic acid in the treatment of liver diseases: Literature review [J]., 2014, 2014: 872139.
[36] 杨晓宇, 苏秀兰. 甘草次酸保肝功效的通路作用机制 [J]. 中国组织化学与细胞化学杂志, 2019, 28(1): 66-70.
[37] 和朝军, 孙华, 李鹏举, 等. 新月弯孢霉KA-91对甘草次酸的转化研究 [J]. 药物生物技术, 2011, 18(3): 238-241.
[38] Xu S H, Chen H L, Fan Y,. Application of tandem biotransformation for biosynthesis of new pentacyclic triterpenoid derivatives with neuroprotective effect [J]., 2020, 30(4): 126947.
[39] Fan B Y, Jiang B C, Yan S S,. Anti-inflammatory 18β-glycyrrhetinin acid derivatives produced by biocatalysis [J]., 2019, 85(1): 56-61.
[40] Maatooq G T, Marzouk A M, Gray A I,. Bioactive microbial metabolites from glycyrrhetinic acid [J]., 2010, 71(2/3): 262-270.
[41] Xin X L, Yang G W, Gou Z P,. Structural determination of two new triterpenoids biotransformed from glycyrrhetinic acid bypolymorphosporus [J]., 2010, 48(2): 164-167.
[42] 马媛, 谢丹, 王照华, 等. 短刺小克银汉霉对甘草次酸的微生物转化 [J]. 中国中药杂志, 2015, 40(21): 4212-4217.
[43] Ma Y, Liu J M, Chen R D,. Microbial transformation of glycyrrhetinic acid and potent neural anti-inscommatory activity of the metabolites [J]., 2017, 28(6): 1200-1204.
[44] Shen P P, Zhang J, Zhu Y Y,. Microbial transformation of glycyrrhetinic acid derivatives byATCC 6633 andCGMCC 1.1741 [J]., 2020, 28(11): 115465.
[45] 赵子璇, 李春峰, 杨洪旺, 等. 五环三萜类化合物微生物转化研究进展 [J]. 天然产物研究与开发, 2021, 33(8): 1415-1426.
[46] 孟欣桐, 乐世俊, 杨智睿, 等. 黄芪皂苷类成分在人源肠道菌群中生物转化特征研究 [J]. 食品与药品, 2018, 20(3): 161-167.
[47] 阮鸣. 不同药(食)用真菌固体发酵对黄芪中黄芪甲苷的影响 [J]. 中草药, 2011, 42(7): 1421-1424.
[48] 刘晓会. 伞枝犁头霉corymbifera AS2生物转化富集黄芪甲苷研究 [D]. 上海: 复旦大学, 2012.
[49] Wang L M, Chen Y. Efficient biotransformation of astragaloside IV to cycloastragenol bysp. LG-502 [J]., 2017, 183(4): 1488-1502.
[50] Hong H F, Xiao J, Guo Q Q,. Cycloastragenol and astragaloside IV activate telomerase and protect nucleus pulposus cells against high glucose-induced senescence and apoptosis [J]., 2021, 22(5): 1326.
[51] 张瑜, 吴军凯, 于丹, 等. 甾体皂苷生物转化研究进展 [J]. 现代生物医学进展, 2015, 15(22): 4391-4393.
[52] Zhang G X, Zeng X C, Zhang R,. Dioscin suppresses hepatocellular carcinoma tumor growth by inducing apoptosis and regulation of TP53, BAX, BCL2 and cleaved CASP3 [J]., 2016, 23(12): 1329-1336.
[53] 刘琳. 哈茨木霉生物转化盾叶薯蓣中的皂苷及其产物提取分离 [D]. 大连: 大连理工大学, 2010.
[54] Dong Y S, Teng H, Qi S S,. Pathways and kinetics analysis of biotransformation ofby[J]., 2010, 52(2/3): 123-130.
[55] Zheng T X, Yu L D, Zhu Y L,. Evaluation of different pretreatments on microbial transformation of saponins infor diosgenin production [J]., 2014, 28(4): 740-746.
[56] Zhu Y L, Huang W, Ni J R,. Production of diosgenin fromtubers through enzymatic saccharification and microbial transformation [J]., 2010, 85(5): 1409-1416.
[57] 郭梦真. 盾叶薯蓣总皂苷提取及微生物转化研究 [D]. 武汉: 华中科技大学, 2017.
[58] 李长田, 田风华, 李江楠, 等. 少根根霉原变种发酵生产薯蓣皂苷元 [J]. 菌物学报, 2012, 31(5): 754-761.
[59] 陈宇. 薯蓣皂苷元的微生物发酵法制备及其体外抗氧化活性的研究 [D]. 广州: 华南理工大学, 2015.
[60] 吴广畏. 两株真菌转化薯蓣皂苷元的研究 [D]. 杨凌: 西北农林科技大学, 2010.
[61] Dong T, Wu G W, Wang X N,. Microbiological transformation of diosgenin by resting cells of filamentous fungus,CGMCC 3.2716 [J]., 2010, 67(3/4): 251-256.
[62] 全波, 马百平, 冯冰, 等. 米曲霉 () 对原薯蓣皂苷的生物转化 [J]. 中国天然药物, 2006, 4(5): 377-381.
[63] 崔乃菠, 马境谦, 余河水, 等. 生物发酵菊叶薯蓣富集薯蓣皂苷的研究 [J]. 中南药学, 2022, 20(2): 340-344.
[64] Wang F Q, Li B, Wang W,. Biotransformation of diosgenin to nuatigenin-type steroid by a newly isolated strain,IBL-14 [J]., 2007, 77(4): 771-777.
[65] 孙宇. 知母化学成分及其活性研究 [D]. 沈阳: 沈阳药科大学, 2015.
[66] 刘艳平. 知母皂苷成分的药理活性及作用机制研究进展 [J]. 药学实践杂志, 2018, 36(1): 24-29.
[67] Hu Y M, Yu Z L, Fong W F. Stereoselective biotransformation of timosaponin A-III by[J]., 2011, 21(6): 582-589.
[68] Zhao Y, Jiang T, Han B,. Preparation of some metabolites of timosaponin BII by biotransformation[J]., 2015, 50(12): 2182-2187.
Research progress on mechanism of transformation of saponins by microbial fermentation
LI Qian, YU Dan, GUO Li-dong, DU Xiao-wei
College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China
Saponins are a class of important chemical components in natural medicines. Microbial fermentation technology can convert saponins into various derivatives. The microorganisms that can transform saponins are mainly bacteria and fungi. The hydrolysis reaction is the main method, and the sugar group is removed, which can improve the bioavailability and pharmacological activity of the transformation product. In addition, through reactions such as hydroxylation, glycosylation, carbonylation, and esterification, the side effects of the substrate are reduced, and the drug efficacy is improved. The microbial transformation of steroidal saponins is mainly based on the mutual transformation between saponins and sapogenins, which is an effective way to realize the large-scale production of some special saponins. In this paper, ginsenoside, glycyrrhetinic acid, astragaloside, dioscin, timosaponin and other medicinal materials are used as examples to analyze the microbial transformation mechanism of saponins, in order to provide reference for the biosynthesis of saponins and the development of new drugs.
microbial fermentation; triterpenoid saponins; steroidal saponins; ginsenoside; glycyrrhetinic acid; astragaloside; dioscin; timosaponin; biotransformation; mechanism
R282.15
A
0253 - 2670(2022)22 - 7264 - 15
10.7501/j.issn.0253-2670.2022.22.031
2022-06-21
国家自然科学基金资助项目(81872967)
李 倩(1999—),女,硕士研究生。E-mail: LQ18847101179@163.com
都晓伟(1962—),女,教授,博士,研究方向为中药质量标准与新药研发。Tel: (0451)87260824 E-mail: xiaoweidu@hotmail.com
[责任编辑 崔艳丽]

