UHPLC-Q-Exactive Orbitrap HRMS分析黄连解毒汤的化学成分及大鼠组织分布
王永丽,黄广建,刘从进,戚胜兰,李荣胜,刘 伟,
UHPLC-Q-Exactive Orbitrap HRMS分析黄连解毒汤的化学成分及大鼠组织分布
王永丽1,黄广建3,刘从进3,戚胜兰1,李荣胜2*,刘 伟1, 2*
1. 上海中医药大学 中药研究所,上海 201203 2. 上海中医药大学附属曙光医院 肝病研究所,肝肾疾病病证教育部重点实验室,上海市中医临床重点实验室,上海 201203 3. 复旦大学附属华山医院,上海 200040
运用UHPLC-Q-Exactive Orbitrap HRMS技术实现高效、快速、精准分析鉴定黄连解毒汤的化学成分及大鼠ig后其主要成分在不同组织中的分布。色谱分离采用Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 µm),以0.1%甲酸水溶液-甲醇为流动相梯度洗脱,通过HRMS的正、负离子监测模式,全扫描及自动触发二级质谱扫描功能(Full MS/dd-MS2),对黄连解毒汤中的化学成分进行快速分析及鉴定。在此基础上,对大鼠口服黄连解毒汤后血及组织中的移行成分进行鉴定。通过化合物的一级、二级质谱信息,结合对照品比对确认与相关文献报道分析,从黄连解毒汤中共鉴定出110种化学成分,包括36种黄酮类、28种环烯醚萜、15种生物碱、15种有机酸、5种木脂素以及11种其他类化合物。大鼠ig黄连解毒汤后,分别从血清、心、肝、脾、肺、肾、脑、睾丸中检测到40、50、55、65、61、62、32、46种原型成分。根据各原型成分在原方、血清及各组织中的均一化峰面积,可知栀子新苷、黄连碱、小檗碱、巴马汀、药根碱、黄柏碱等成分在肝、肾等组织中有较大的暴露量。借助UHPLC-Q-Exactive Orbitrap HRMS技术系统、准确、快速地实现了黄连解毒汤化学成分鉴定,并揭示了黄连解毒汤大鼠ig给药后主要成分的组织分布特征,为后续黄连解毒汤潜在药效物质基础研究及临床应用提供参考。
UHPLC-Q-Exactive Orbitrap HRMS;黄连解毒汤;组织分布;药效物质;栀子新苷;黄连碱;小檗碱;巴马汀;药根碱;黄柏碱
黄连解毒汤为清热解毒剂之代表方,出自东晋葛洪《肘后备急方》卷二,未出方名。黄连解毒汤方名始见唐代王焘《外台秘要》卷一引《崔氏方》。其方由黄连(三两)、黄芩(二两)、黄柏(二两)、栀子(十四枚,擘)四味药材组成[1]。主治三焦实热火毒壅盛之证。症见大热、狂躁错语、不眠、目赤眼痛,或热病出血;或外科痈疡疔毒。临床用于治疗败血症、脓毒血症、肺炎、2型糖尿病和胆道感染、阿尔茨海默病等症[2-5]。近年来国内外在黄连解毒汤的药理研究报道较多,研究表明黄连解毒汤具有降血压[6]、抗心律失常、抗菌、抗炎[7]、抗动脉粥样硬化[8]、抗内毒素[9]等广泛的药理活性。对黄连解毒汤全面的化学成分和组织分布的报道较少,相关研究主要集中在栀子苷、黄芩苷、小檗碱、黄柏碱及其他生物碱等成分的药动学方面[10-12]。因此,为了全面准确地表征黄连解毒汤的化学组成和组织分布情况,解析黄连解毒汤潜在活性物质基础,本研究借助目前较成熟的超高效液相串联四极杆-静电场轨道阱高分辨质谱(UHPLC-Q-Exactive Orbitrap HRMS)分析技术,采用正、负离子模式扫描,根据化合物保留时间、相对分子质量、二级碎片离子等信息,结合对照品比对、文献报道、数据库比对等方式,快速、系统的开展黄连解毒汤的化学成分与组织分布研究[13]。以期为揭示黄连解毒汤的潜在药效物质基础、复方的质量控制及临床合理应用等提供部分科学依据和参考。
1 仪器与材料
1.1 仪器
UHPLC-Q-Exactive Orbitrap HR-MS液质联用系统:Dionex Ultimate 3000型高压液相色谱串联Q-Exactive四极杆/静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司);Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm,美国Waters公司);Milli-Q超纯水处理系统(美国Millipore公司);BP211D电子分析天平(DE Sartorius公司)。
1.2 药物与试剂
奎宁酸(批号MB6731)、黄芩苷(批号D0321AS)、黄芩素(批号J0227AS)、芦丁(批号J0509AS)购自大连美仑生物技术有限公司;咖啡酸(批号190425)、隐绿原酸(批号15020603)购自上海融禾医药科技发展有限公司;绿原酸(批号PRF7102045)、原儿茶酸(批号PRF10061151)、原儿茶醛(批号PRF10041021)、小檗碱(批号PRF10092648)、黄连碱(批号PRF21011403)、巴马汀(批号PRF10030643)、黄柏碱(批号PRF10031323)、小檗红碱(批号PRF20112344)、小檗碱(批号PRF10092648)、甲基黄连碱(批号PRF10031223)、去亚甲基小檗碱(批号PRF20030224)、野黄芩苷(批号PRF10120301)、毛蕊花糖苷(批号PRF10082001)、西红花苷I(批号PRF10071003)、西红花苷II(批号PRF10081201)、西红花酸(批号PRF10031207)、京尼平-1-β龙胆双糖苷(批号PRF9051521)、羟异栀子苷(批号PRF9040843)、京尼平(批号PRF10072302)、栀子苷(批号PRF10072502)均购自成都普瑞法科技开发有限公司;以上对照品经HPLC峰面积归一化法测定,质量分数均≥98.0%。
甲醇、乙腈、甲酸为HPLC级(美国Thermo Fisher Scientific公司);实验用水为超纯水,由Milli-Q超纯水处理系统制得;黄连(批号20201201)和黄柏(批号20210501)购自江西弘康中药饮片有限公司;黄芩(批号200401)和栀子(批号201201)购自江西顺福堂中药饮片有限公司。其他试剂均为分析纯。
1.3 实验动物
雄性健康Wistar大鼠6只,体质量(220±20)g;由上海斯莱克实验动物有限责任公司提供,生产许可证号SCXK(沪)2017-0005;饲养于上海中医药大学动物实验中心,使用许可证号SYXK(沪)2020-0009,室内温度为22~26 ℃,相对湿度为40%~70%,光照/黑暗时间各12 h。动物实验通过上海中医药大学实验动物伦理委员会批准(批准号PZSHUTCM210709016)。
2 方法
2.1 溶液的制备
2.1.1 黄连解毒汤供试品溶液的制备 称取黄连(90 g)、黄芩(60 g)、黄柏(60 g)、栀子(90 g),加2400 mL水浸泡30 min,煎煮60 min,纱布滤过药液,药材再进行第2次煎煮,加水1800 mL,煎煮45 min,滤过,合并2次的药液,减压回收定容至250 mL,即得黄连解毒汤提取液(1.2 g/mL)。取上述提取溶液适量,使用20%甲醇稀释获得按生药量计算为50 mg/mL的稀释溶液,摇匀,经0.22 μm微孔滤膜滤过后即得黄连解毒汤供试品溶液。
2.1.2 对照品溶液的制备 精密称取各对照品约1.0 mg,加入甲醇配制成1.0 mg/mL的单一对照品储备液。从上述各单一对照品中精密称取储备液适量,加入20%甲醇水稀释,配制质量浓度为1 μg/mL的单一对照品溶液,同时从上述各单一对照品中精密量取储备液适量,混合后加入20%甲醇水稀释,配制得到各对照品质量浓度为1 μg/mL的对照品混合溶液。
2.2 色谱和质谱条件
2.2.1 色谱条件 使用Dionex Ultimate 3000高压液相系统,Acquity UPLC BEH CI8色谱柱(100 mm×2.1 mm,1.7 μm);流动相为甲醇-0.1%甲酸水溶液,梯度洗脱:0~4 min,4%甲醇;4~10 min,4%~12%甲醇;10~30 min,12%~70%甲醇;30~35 min,70%甲醇;35~38 min,70%~95%甲醇;38~42 min,95%甲醇;42~45 min,4%甲醇。体积流量0.3 mL/min;柱温40℃,进样量5 μL。
2.2.2 质谱条件 使用Q Exactive四极杆-静电场轨道阱高分辨质谱仪作为分析检测的仪器;离子源为电喷雾离子源(H-ESI),辅助气流量13 arb,辅助加热器温度300 ℃,离子传输管温度320 ℃,自动增益控制(AGC)1×106,S-lens射频水平50;正离子模式:鞘气(N2)流量35 arb,喷雾电压3.5 kV;负离子模式:鞘气(N2)流量35 arb,喷雾电压2.5 kV,扫描方式采用正负离子Full MS/dd-MS2模式,其中包括1次一级全扫描(分辨率为70 000 FWHM)和1次数据依赖的二级扫描(分辨率为17 500 FWHM)2个事件,正、负离子扫描范围均为/80~1200,碰撞能梯度为20、50、100 V。
2.3 黄连解毒汤所含化合物分析
按照“2.2”项下色谱、质谱条件分别对对照品混合溶液和黄连解毒汤供试品溶液进行数据采集、结果分析。根据高分辨质谱提供的准分子离子、[M]+、[M+H]+、[M+Na]+、[M-H]−、[M+COOH]−等信息提取到对应的一级质谱离子峰和精确的相对分子质量,经Xcalibur 3.0软件在允许误差范围内±1×10−5拟合计算可能的元素组成,并结合对照品、报道文献、MassBank和ChemicalBook等数据库提供的相对保留时间及二级质谱离子碎片信息比对,进一步鉴定出黄连解毒汤所含化学成分。
2.4 组织样品收集
给药前将大鼠禁食12 h,自由饮水。大鼠随机分为空白组和黄连解毒汤组,空白组给予超纯水,黄连解毒汤组按照生药量3.09 g/kg ig黄连解毒汤提取液(按65 kg成人等效剂量换算获得),在给药后1 h,0.3%戊巴比妥钠麻醉后腹主动脉取血至未抗凝的离心管中,置于4℃箱过夜,在4500×下离心15 min(4℃)获得血清,收集心、肝、脾、肺、肾、脑、睾丸,用0.9%生理盐水清洗表面残留血,滤纸吸干,置−80℃保存待用。
2.5 组织样品处理
准确称取各组织约200 mg至1.5 mL EP管中,加入1 mL色谱甲醇,使用全自动组织匀浆机(65 Hz)匀浆2 min,4500×离心15 min(4℃),取上清液800 μL至1.5 mL EP管中,温和37℃氮气流吹干,加80 μL 20%甲醇水溶液复溶,12 000×离心10 min,取上清液进样。血清样品取200 μL,加入1000 μL甲醇沉淀蛋白,12 000×离心10 min(4℃),取上清液960 μL至1.5 mL EP管,温和37℃氮气流吹干,加80 μL 20%甲醇水溶液复溶,12 000×离心10 min,取上清液进样分析。
3 结果
3.1 基于UHPLC-Q-Orbitrap HR-MS技术的黄连解毒汤化学成分鉴定
基于“2.2”项下色谱、质谱条件优化后对黄连解毒汤及大鼠血清及其心、肝、脾、肺、肾、脑、睾丸进行数据采集、定性定量分析。在正、负离子同时扫描模式下从黄连解毒汤中共鉴定出110种化学成分,包括36种黄酮类、28种环烯醚萜、15种生物碱、15种有机酸、5种木脂素以及11种其他类化合物。其中26种化学成分经对照品比对确证,黄连解毒汤提取液总离子流图见图1,结果见表1。
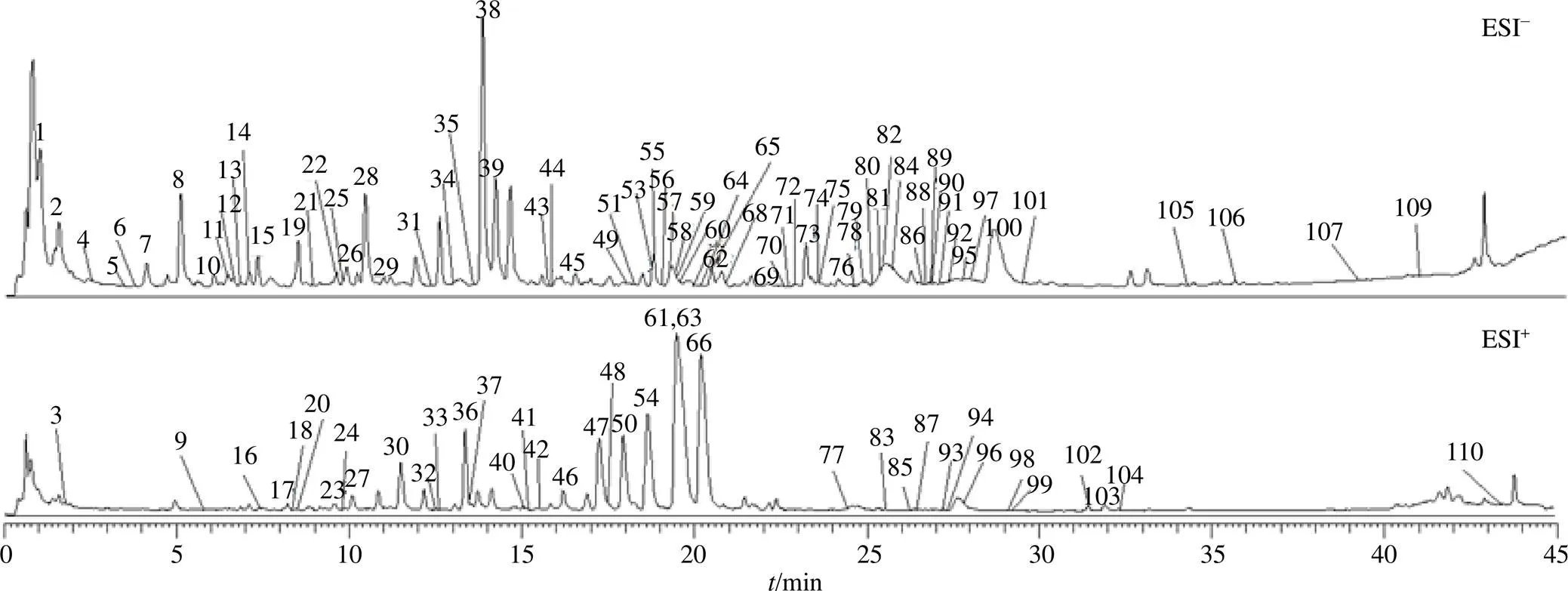
图1 黄连解毒汤提取液总离子流图
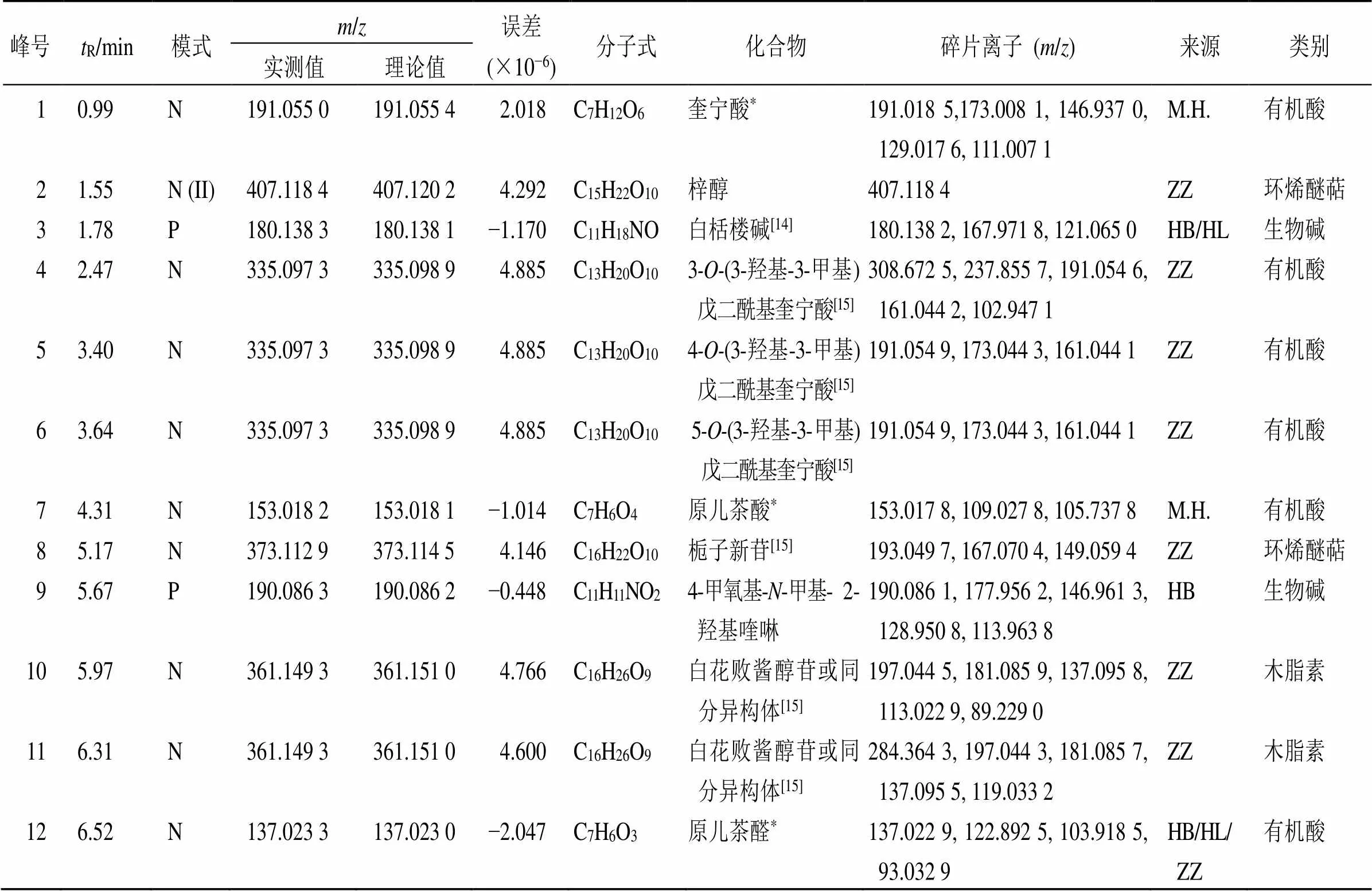
表1 黄连解毒汤化学成分鉴定
续表1
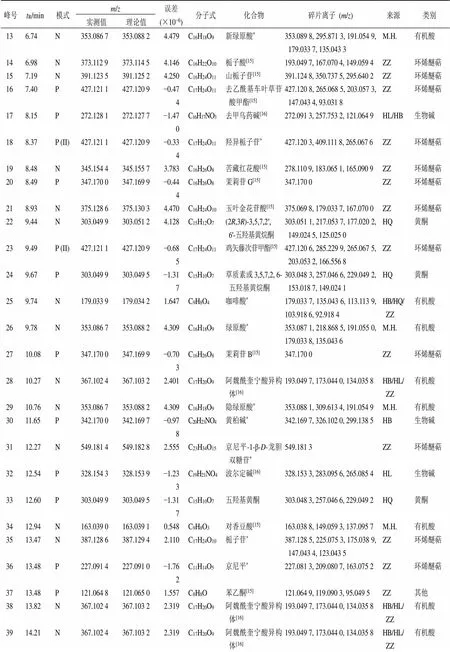
峰号tR/min模式m/z误差(×10−6)分子式化合物碎片离子 (m/z)来源类别 实测值理论值 136.74N353.086 7353.088 24.479C16H18O9新绿原酸*353.089 8, 295.871 3, 191.054 9, 179.033 7, 135.043 3M.H.有机酸 146.98N373.112 9373.114 54.146C16H22O10栀子酸[15]193.049 7, 167.070 4, 149.059 4ZZ环烯醚萜 157.19N391.123 5391.125 24.250C16H24O11山栀子苷[15]391.124 8, 350.737 5, 295.640 2ZZ环烯醚萜 167.40P427.121 1427.120 9−0.474C17H24O11去乙酰基车叶草苷酸甲酯[15]427.120 8, 265.068 5, 203.057 3, 147.043 4, 93.031 8ZZ环烯醚萜 178.15P272.128 1272.127 7−1.470C16H17NO3去甲乌药碱[16]272.091 3, 257.753 2, 121.064 9HL/HB生物碱 188.37P (II)427.121 1427.120 9−0.334C17H24O11羟异栀子苷*427.120 3, 409.111 8, 265.067 6ZZ环烯醚萜 198.48N345.154 4345.155 73.783C16H26O8苦藏红花酸[15]278.110 9, 183.065 1, 165.090 9ZZ环烯醚萜 208.49P347.170 0347.169 9−0.444C16H26O8茉莉苷G[15]347.170 0ZZ环烯醚萜 218.93N375.128 6375.130 34.470C16H24O10玉叶金花苷酸[15]375.069 8, 179.033 7, 167.070 0ZZ环烯醚萜 229.44N303.049 9303.051 24.128C15H12O7(2R,3R)-3,5,7,2′,6′-五羟基黄烷酮303.051 1, 217.053 7, 177.020 2, 149.024 5, 125.025 0HQ黄酮 239.49P (II)427.121 1427.120 9−0.685C17H24O11鸡矢藤次苷甲酯[15]427.120 6, 285.229 9, 265.067 5, 203.053 2, 166.556 8ZZ环烯醚萜 249.67P303.049 9303.049 5−1.317C15H10O7草质素或3,5,7,2, 6-五羟基黄烷酮303.048 3, 257.046 6, 229.049 2, 153.018 7, 149.024 1HQ黄酮 259.74N179.033 9179.034 21.647C9H8O4咖啡酸*179.033 7, 135.043 6, 113.113 9, 103.918 6, 92.918 4HB/HQ/ZZ有机酸 269.78N353.086 7353.088 24.309C16H18O9绿原酸*353.087 1, 218.868 5, 191.055 0, 179.033 8, 135.043 6M.H.有机酸 2710.08P347.170 0347.169 9−0.703C16H26O8茉莉苷B[15]347.170 0ZZ环烯醚萜 2810.27N367.102 4367.103 22.401C17H20O9阿魏酰奎宁酸异构体[16]193.049 7, 173.044 0, 134.035 8HB/HL/ZZ有机酸 2910.76N353.086 7353.088 24.309C16H18O9隐绿原酸*353.088 1, 309.613 4, 191.054 9M.H.有机酸 3011.65P342.170 0342.169 7−0.978C20H23NO4黄柏碱*342.169 7, 326.102 0, 299.138 5HB生物碱 3112.27N549.181 4549.182 82.555C23H34O15京尼平-1-β-D-龙胆双糖苷*549.181 3ZZ环烯醚萜 3212.54P328.154 3328.153 9−1.233C19H21NO4波尔定碱[16]328.153 3, 283.095 6, 265.085 4HL生物碱 3312.60P303.049 9303.049 5−1.317C15H10O7五羟基黄酮303.048 3, 257.046 6, 229.049 2HQ黄酮 3412.94N163.039 0163.039 10.548C9H8O3对香豆酸[15]163.038 8, 149.059 3, 137.095 7M.H.有机酸 3513.47N387.128 6387.129 42.110C17H24O10栀子苷*387.128 5, 225.075 3, 175.038 9, 147.043 4, 123.043 5ZZ环烯醚萜 3613.48P227.091 4227.091 0−1.762C11H14O5京尼平*227.081 3, 209.080 7, 163.075 2ZZ环烯醚萜 3713.48P121.064 8121.065 01.557C8H8O苯乙酮[15]121.064 9, 119.090 3, 95.049 5ZZ其他 3813.82N367.102 4367.103 22.319C17H20O9阿魏酰奎宁酸异构体[16]193.049 7, 173.044 0, 134.035 8HB/HL/ZZ有机酸 3914.21N367.102 4367.103 22.319C17H20O9阿魏酰奎宁酸异构体[16]193.049 7, 173.044 0, 134.035 8HB/HL/ZZ有机酸 4015.10P331.175 1331.174 9−0.784C16H26O7茉莉苷A[15]331.129 9, 267.100 9, 191.070 6ZZ环烯醚萜 4115.22P192.065 5192.065 4−0.779C10H9NO3降氧化北美黄莲次碱[14]192.064 8, 177.956 0, 163.976 7, 128.950 6, 113.963 9HB/HL生物碱 4215.50P331.175 1331.174 9−0.995C16H26O7茉莉苷E[15]331.129 9, 267.100 9, 191.070 6ZZ环烯醚萜 4315.61N681.238 9681.240 62.479C32H42O16松脂醇二葡萄糖苷[17]340.155 2, 325.131 8, 135.420 1HL木脂素 4415.67N183.101 6183.101 81.142C10H16O3茉莉醇[15]183.101 3, 157.121 7, 139.111 2ZZ环烯醚萜
续表1
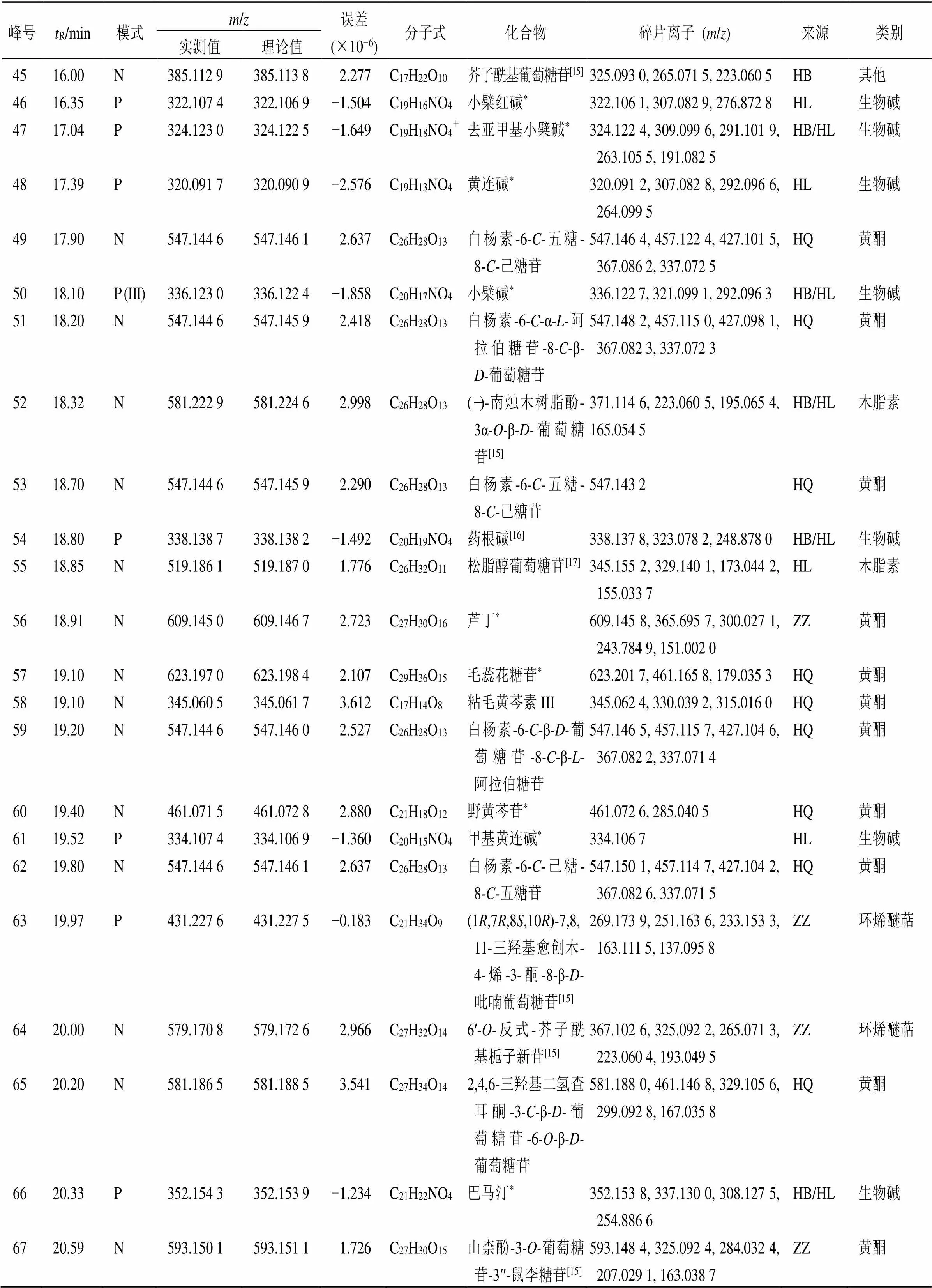
峰号tR/min模式m/z误差(×10−6)分子式化合物碎片离子 (m/z)来源类别 实测值理论值 4516.00N385.112 9385.113 82.277C17H22O10芥子酰基葡萄糖苷[15]325.093 0, 265.071 5, 223.060 5HB其他 4616.35P322.107 4322.106 9−1.504C19H16NO4小檗红碱*322.106 1, 307.082 9, 276.872 8HL生物碱 4717.04P324.123 0324.122 5−1.649C19H18NO4+去亚甲基小檗碱*324.122 4, 309.099 6, 291.101 9, 263.105 5, 191.082 5HB/HL生物碱 4817.39P320.091 7320.090 9−2.576C19H13NO4黄连碱*320.091 2, 307.082 8, 292.096 6, 264.099 5HL生物碱 4917.90N547.144 6547.146 12.637C26H28O13白杨素-6-C-五糖- 8-C-己糖苷547.146 4, 457.122 4, 427.101 5, 367.086 2, 337.072 5HQ黄酮 5018.10P (III)336.123 0336.122 4−1.858C20H17NO4小檗碱*336.122 7, 321.099 1, 292.096 3HB/HL生物碱 5118.20N547.144 6547.145 92.418C26H28O13白杨素-6-C-α-L-阿拉伯糖苷-8-C-β- D-葡萄糖苷547.148 2, 457.115 0, 427.098 1, 367.082 3, 337.072 3HQ黄酮 5218.32N581.222 9581.224 62.998C26H28O13(−)-南烛木树脂酚- 3α-O-β-D-葡萄糖苷[15]371.114 6, 223.060 5, 195.065 4, 165.054 5HB/HL木脂素 5318.70N547.144 6547.145 92.290C26H28O13白杨素-6-C-五糖- 8-C-己糖苷547.143 2HQ黄酮 5418.80P338.138 7338.138 2−1.492C20H19NO4药根碱[16]338.137 8, 323.078 2, 248.878 0HB/HL生物碱 5518.85N519.186 1519.187 01.776C26H32O11松脂醇葡萄糖苷[17]345.155 2, 329.140 1, 173.044 2, 155.033 7HL木脂素 5618.91N609.145 0609.146 72.723C27H30O16芦丁*609.145 8, 365.695 7, 300.027 1, 243.784 9, 151.002 0ZZ黄酮 5719.10N623.197 0623.198 42.107C29H36O15毛蕊花糖苷*623.201 7, 461.165 8, 179.035 3HQ黄酮 5819.10N345.060 5345.061 73.612C17H14O8粘毛黄芩素III345.062 4, 330.039 2, 315.016 0HQ黄酮 5919.20N547.144 6547.146 02.527C26H28O13白杨素-6-C-β-D-葡萄糖苷-8-C-β-L-阿拉伯糖苷547.146 5, 457.115 7, 427.104 6, 367.082 2, 337.071 4HQ黄酮 6019.40N461.071 5461.072 82.880C21H18O12野黄芩苷*461.072 6, 285.040 5HQ黄酮 6119.52P334.107 4334.106 9−1.360C20H15NO4甲基黄连碱*334.106 7HL生物碱 6219.80N547.144 6547.146 12.637C26H28O13白杨素-6-C-己糖- 8-C-五糖苷547.150 1, 457.114 7, 427.104 2, 367.082 6, 337.071 5HQ黄酮 6319.97P431.227 6431.227 5−0.183C21H34O9(1R,7R,8S,10R)-7,8, 11-三羟基愈创木- 4-烯-3-酮-8-β-D-吡喃葡萄糖苷[15]269.173 9, 251.163 6, 233.153 3, 163.111 5, 137.095 8ZZ环烯醚萜 6420.00N579.170 8579.172 62.966C27H32O146′-O-反式-芥子酰基栀子新苷[15]367.102 6, 325.092 2, 265.071 3, 223.060 4, 193.049 5ZZ环烯醚萜 6520.20N581.186 5581.188 53.541C27H34O142,4,6-三羟基二氢查耳酮-3-C-β-D-葡萄糖苷-6-O-β-D-葡萄糖苷581.188 0, 461.146 8, 329.105 6, 299.092 8, 167.035 8HQ黄酮 6620.33P352.154 3352.153 9−1.234C21H22NO4巴马汀*352.153 8, 337.130 0, 308.127 5, 254.886 6HB/HL生物碱 6720.59N593.150 1593.151 11.726C27H30O15山柰酚-3-O-葡萄糖苷-3′′-鼠李糖苷[15]593.148 4, 325.092 4, 284.032 4, 207.029 1, 163.038 7ZZ黄酮
续表1
续表1
*通过对照品确认 N-负离子模式[M-H]−N (II)-负离子模式[M+HCOO]−P-正离子模式[M+H]+P (II)-正离子模式[M+Na]+P (III)-正离子模式[M]+HB-黄柏 HL-黄连 HQ-黄芩 ZZ-栀子 M.H.-全部药材
*confirmed by comparison with the reference substances N-[M-H]−N (II)-[M+HCOO]−P-[M+H]+P (II)-[M+Na]+P (III)-[M]+HB-Schneid. HL-Franch. HQ-Georgi ZZ-Ellis M.H.-a variety of medicinal materials
3.1.1 有机酸类 从黄连解毒汤中鉴定的有机酸成分共15种,主要来源于4味药材,包括奎宁酸、绿原酸、新绿原酸、隐绿原酸、3(3-羟基-3-甲基)戊二酰基奎宁酸、4--(3-羟基-3-甲基)戊二酰基奎宁酸、5--(3-羟基-3-甲基)戊二酰基奎宁酸、原儿茶酸、原儿茶醛、咖啡酸、对香豆酸、4芥子酰基-5咖啡酰基奎宁酸以及阿魏酰奎宁酸异构体。
以奎宁酸和绿原酸(3-咖啡酰奎宁酸)二级质谱[M-H]−离子模式下裂解碎片推导过程为例,奎宁酸和绿原酸都在负离子模式下有较好的响应,一级质谱得到奎宁酸/191.018 5 [M-H]−准分子离子峰,经Xcalibur元素组成拟合化学式为 C7H11O6,在高能H-ESI质谱离子源碰撞离子作用下获得主要二级碎片离子信息为/173.008 1 [M-H-H2O]−和/146.937 0 [M-H-COOH]−2个离子碎片,/173.008 1 [M-H-H2O]−碎片进一步裂解得到/129.017 6 [M-H-H2O-CO2]−的离子碎片,/146.937 0 [M-H-COOH]−与/129.017 6 [M-H-H2O-CO2]−2个碎片分别失去-H3O2和H2O得到/111.007 1离子碎片。绿原酸一级质谱得到/353.088 1 [M-H]−准分子离子峰,经Xcalibur元素组成拟合化学式为C16H17O9,在高能H-ESI质谱离子源碰撞离子作用下获得/191.054 9 [M-H-C9H6O3]−和/179.033 7 [M-H-C7H10O5]−离子碎片,/179.033 7离子碎片进一步裂解为/135.043 5 [M-H-CO2]−。从裂解获得的一级、二级质谱离子碎片/值分析,奎宁酸和绿原酸化合物裂解途径符合有机酸的裂解规律,与文献报道裂解途径相似[19-20],同时通过对照品的一级、二级质谱裂解碎片和提取离子峰位置、相对保留时间比对,最终确定化合物分别为奎宁酸(C7H11O6)与绿原酸(C16H17O9),相应质谱裂解途径见图2。
3.1.2 生物碱类 从黄连解毒汤中鉴定出15种生物碱成分,主要来源于黄芩、黄连、黄柏3味药材,包括小檗碱、黄连碱、黄柏碱、白栝楼碱、4-甲氧基--甲基-2-羟基喹啉、去甲乌药碱、波尔定碱、降氧化北美黄莲次碱、小檗红碱、去亚甲基小檗碱、药根碱、甲基黄连碱、巴马汀、铁屎米酮、γ-崖椒碱。以小檗碱和黄连碱二级质谱[M]+离子模式下裂解碎片推导过程为例,小檗碱和黄连碱都在正离子模式下响应较好,一级质谱得到小檗碱[M]+准分子离子峰,经Xcalibur元素组成拟合化学式为C20H18NO4,在高能H-ESI质谱离子源碰撞离子作用下获得二级碎片离子/336.122 5 [M]+,依次裂解为/321.099 0 [M-CH3]+、/292.097 1 [M-CH3-CHO]+离子碎片;同样黄连碱一级质谱得到/320.091 2 [M]+准分子离子峰,经Xcalibur元素组成拟合化学式为C19H14NO4,在高能H-ESI质谱离子源碰撞离子作用下获得主要二级碎片离子信息为/292.096 6 [M-CO]+、/292.096 6 [M-CO]+可能进一步裂解为/264.099 5 [M-CO]+2种结构形式;由以上裂解/值可知小檗碱和黄连碱化合物裂解途径符合生物碱的裂解规律,与文献报道裂解途径相似[21],通过对照品的一级、二级质谱裂解碎片和提取离子峰位置、相对保留时间比对,最终确定化合物分别为小檗碱(C20H18NO4)与黄连碱(C19H14NO4),相应质谱裂解途径见图3。

图2 奎宁酸与绿原酸的质谱棒状图(A、B) 和裂解途径(C、D)
3.1.3 黄酮类 黄酮类化合物是植物中普遍存在的一类化合物,多与糖苷结合而成。此类化合物在裂解时,多先断裂糖苷或易掉羧基。本实验从黄连解毒汤中共鉴定出36种黄酮类成分,主要来源于黄芩药材,包括黄芩苷、汉黄芩苷、去甲汉黄芩素、黄芩素、芦丁、毛蕊花糖苷、粘毛黄芩素III、野黄芩苷、(2,3)-3,5,7,2′,6′-五羟基黄烷酮、熊竹素、草质素或3,5,7,2,6-五羟基黄烷酮、五羟基黄酮、白杨素-6-五糖-8-己糖苷、白杨素-6-α--阿拉伯糖苷-8-β葡萄糖苷、白杨素-6-β葡萄糖苷- 8-β--阿拉伯糖苷、白杨素-6-己糖-8-五糖苷、2,4,6-三羟基二氢查耳酮-3-β葡萄糖苷- 6β葡萄糖苷、山柰酚-3葡萄糖苷-3′′-鼠李糖苷、白杨素-6-β葡萄糖苷、汉黄芩素-7谷氨酸、5,7,2′-三羟基-6-甲氧基黄酮-7葡萄糖醛酸苷、粘毛黄芩素II-2′β葡萄糖苷、粘毛黄芩素II-2′β葡萄糖苷异构体、汉黄芩素-5β葡萄糖苷、蒙花苷、去甲汉黄芩素-7β葡糖苷酸、(2)-5,7-二羟基-6-甲氧基黄烷酮-7β葡萄糖醛酸苷、白杨素-7β葡萄糖醛酸苷、5,7,8-三羟基-6-甲氧基黄酮-7葡萄糖醛酸苷、去甲汉黄芩素-8β葡糖苷酸、木蝴蝶素-A-7葡萄糖苷、5,6,7-三羟基-8-甲氧基黄酮-7葡萄糖醛酸吡喃糖苷、山姜素、5,7-二羟基-8,2′-二甲氧基黄酮- 7β葡萄糖醛酸苷、熊竹素。
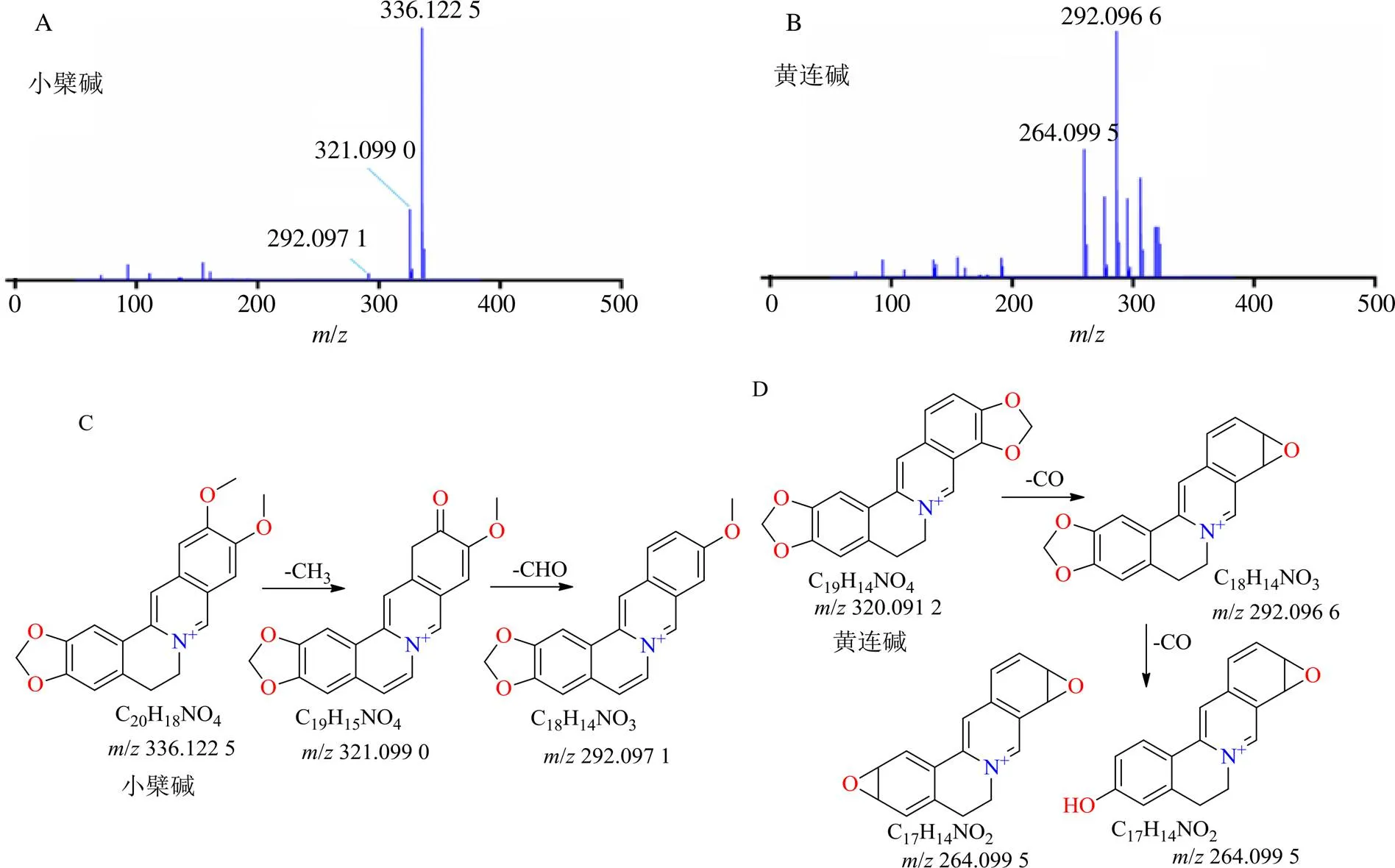
图3 小檗碱与黄连碱的质谱棒状图(A、B) 和裂解途径(C、D)
以黄芩苷二级质谱[M-H]−离子模式下裂解碎片推导过程为例,黄芩苷在负离子模式下有较好的响应,一级质谱获得黄芩苷[M-H]−准分子离子峰,经Xcalibur元素组成拟合化学式为C21H17O11,在高能H-ESI质谱离子源碰撞离子作用下获得主要二级碎片离子有/283.061 5 [M-H-C5H6O6]−、/269.045 2 [M-H-C6H8O6]−离子碎片;黄芩苷化合物裂解途径符合黄酮类化合物的裂解规律,与文献报道裂解途径相似[22],通过对照品的一级、二级质谱裂解碎片和提取离子峰位置、相对保留时间比对,最终确定化合物为黄芩苷(C21H17O11)、相应质谱裂解途径见图4。
3.1.4 环烯醚萜类 从黄连解毒汤中鉴定出环烯醚萜类成分共28种,主要来源于栀子药材,包括梓醇、栀子苷、栀子酸、栀子新苷、山栀子苷、去乙酰基车叶草苷酸甲酯、羟异栀子苷、苦藏红花酸、茉莉苷(A、B、E、G、T)、玉叶金花苷酸、鸡矢藤次苷甲酯、京尼平-1-β龙胆双糖苷、京尼平、茉莉醇、(1,7,8,10)-7,8,11-三羟基愈创木-4-烯-3-酮- 8-β吡喃葡萄糖苷、6′反式-芥子酰基栀子新苷、6反式-对香豆酰基京尼平龙胆双糖苷、6反式-芥子酰基京尼平龙胆双糖苷、6反式-阿魏酰基京尼平龙胆双糖苷、芥子苷L、6′- sinapoyljasminoside A、6反式芥子苷C、erubigenin。
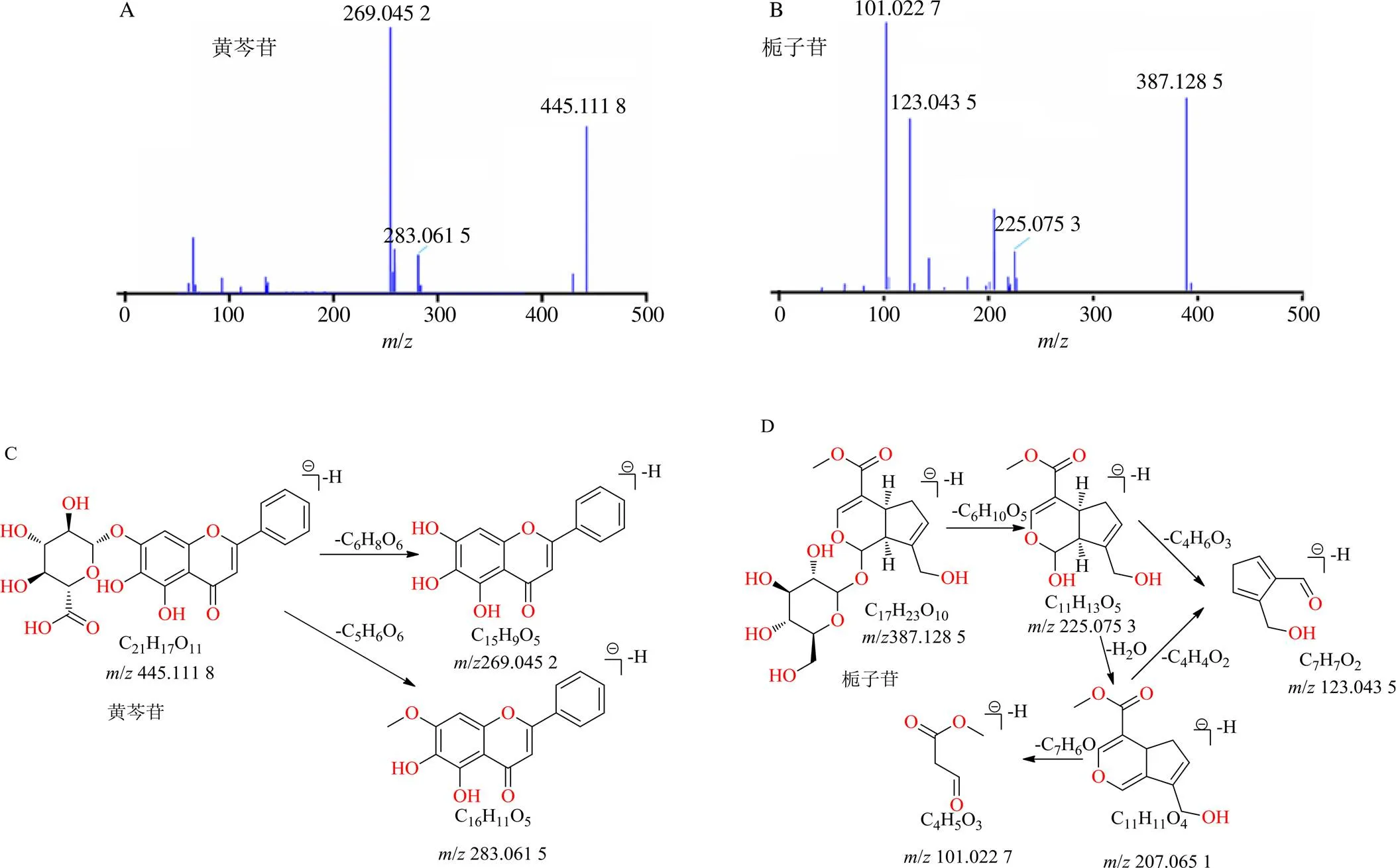
图4 黄芩苷与栀子苷的质谱棒状图(A、B) 和裂解途径(C、D)
以栀子苷的二级质谱[M-H]−离子模式下裂解碎片推导过程为例,栀子苷在一级质谱中获得准分子离子为/387.128 5 [M-H]−,经Xcalibur元素组成拟合化学式为C17H23O10,在高能H-ESI质谱离子源碰撞离子作用下首先获得二级碎片离子/225.075 3 [M-C6H10O5]−,该离子碎片进一步裂解为/207.065 1 [M-H-C6H10O5-H2O]−和/123.043 5 [M-H-C6H10O5-C4H6O3]−;同时/207.065 1继续裂解获得/123.043 5 [M-H-C6H10O5-H2O-C4H4O2]−和/101.022 7 [M-H-C6H10O5-H2O-C7H6O]−离子碎片;从裂解碎片/值推导可知,栀子苷化合物裂解途径符合环烯醚萜类的裂解规律,与文献报道裂解途径相似[22],同时通过对照品的一级、二级质谱裂解碎片和提取离子峰位置、相对保留时间比对,最终确定化合物为栀子苷(C17H23O10),相应质谱裂解途径见图4。
3.1.5 木脂素与其他类 从黄连解毒汤中鉴定出5种木脂素类成分与11种其他类成分,包括:松脂醇二葡萄糖苷、(−)-南烛木树脂酚-3-αβ葡萄糖苷、松脂醇葡萄糖苷、白花败酱醇苷或同分异构体、苯乙酮、黄柏内酯、黄柏酮、黄柏呈、13-顺式-西红花苷I、西红花苷(I、II、III)、西红花酸、芥子酰基葡萄糖苷以及全反式西红花酸二-β葡萄糖酯。
3.2 大鼠血清及各组织转移化学成分鉴定
基于“3.1”项下的鉴定结果,将提取物中鉴定的化学成分在黄连解毒汤组与空白组的生物样品中进行比较提取分析,结合保留时间及碎片离子信息,发现给予大鼠ig黄连解毒汤后,血清中检测到栀子新苷、栀子苷、茉莉苷(A、B、E)、3种阿魏酰奎宁酸异构体、黄柏碱、京尼平-1-β--龙胆双糖苷、对香豆酸、京尼平、苯乙酮、降氧化北美黄莲次碱、茉莉醇、小檗红碱、去亚甲基小檗碱、黄连碱、3种白杨素-6--五糖-8--己糖苷、白杨素-6--α--阿拉伯糖苷-8--β--葡萄糖苷、小檗碱、药根碱、白杨素-6--β--葡萄糖苷-8--β--阿拉伯糖苷、6′--反式-芥子酰基栀子新苷、巴马汀、白杨素- 6--β--葡萄糖苷、汉黄芩素-7--谷氨酸、去甲汉黄芩素、黄芩苷、(2)-5,7-二羟基-6-甲氧基黄烷酮- 7--β--葡萄糖醛酸苷、木蝴蝶素-A-7--葡萄糖苷、汉黄芩苷、5,6,7-三羟基-8-甲氧基黄酮-7--葡萄糖醛酸吡喃糖苷、5,7-二羟基-8,2′-二甲氧基黄酮- 7β葡萄糖醛酸苷、千层纸素A、熊竹素、西红花酸、erubigenin共40种成分,分别从心、肝、脾、肺、肾、脑、睾丸中鉴定出50、55、65、61、62、32、46种原型成分。血清、脑、肺、心、肝、肾组织中原型成分的提取离子峰图见图5~7,各组织成分的基本信息见表1。根据各原型成分在原方、血清及各组织中的均一化的峰面积,绘制了相应的热图(图8),由图可知栀子新苷、黄连碱、小檗碱、巴马汀、药根碱、黄柏碱等成分在肝、肾等组织中有较大的暴露量。
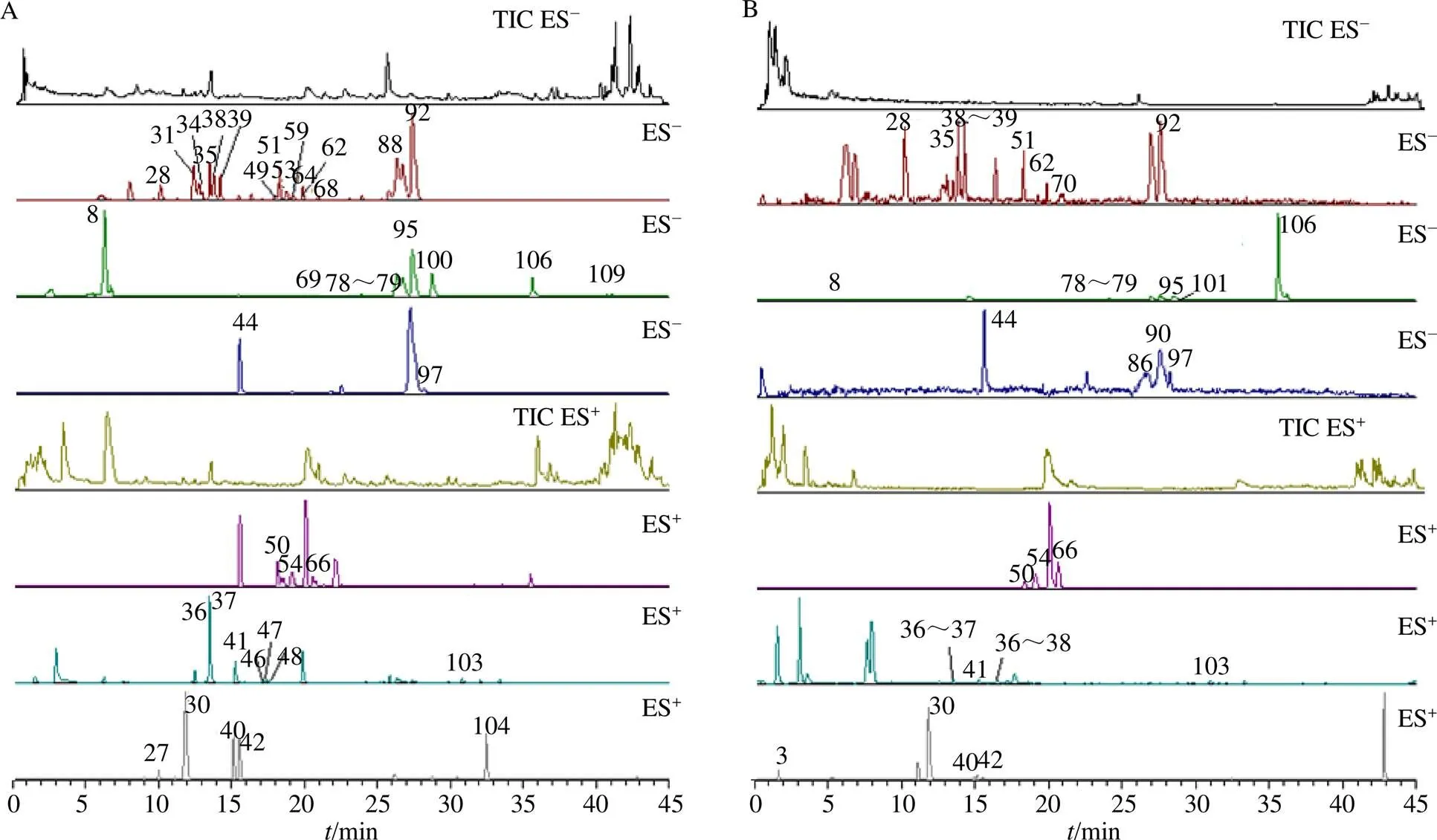
图5 大鼠口服黄连解毒汤后血清(A)和脑(B) 总离子流图与提取离子峰图
4 讨论
UHPLC-Q-Exactive Orbitrap HRMS联用技术,具有分离能力强、灵敏度高、稳定性好以及定性定量准确等优势特点,目前被广泛应用于中药或复杂基质中待测成分的筛选、鉴定及定量分析[13,20,23]。本实验借助于UHPLC-Q-Exactive Orbitrap HR-MS技术,选择0.1%甲酸水溶液-甲醇体系,梯度洗脱条件下系统、准确、快速地实现黄连解毒汤化学成分鉴定,通过比较黄连解毒汤中化合物在正、负离子模式下的总离子流图,发现所鉴定的化合物在2种模式下分离效果好、响应好。其中黄酮类、有机酸类以及糖类多在负离子模式下响应较好;生物碱、环烯醚萜类多在正离子模式下响应较好。在该条件下能较为全面的表征黄连解毒汤的化学组成,相较于孙健等[10]与黄涛阳等[24]利用液质联用技术仅鉴定出11种与15种化学成分,本研究共鉴定了110种化学成分,其中26种通过对照品比对确认,很大程度上增加了对黄连解毒汤所含化学成分的认识;并在此基础上近一步明晰了大鼠ig黄连解毒汤后主要成分的组织分布特征,发现大鼠口服黄连解毒汤提取物后在血清、心、肝、脾、肺、肾、脑、睾丸中检测到40、50、55、65、61、62、32、46种原型成分,其中肺、脾和肝检测到的成分种类较多。众所周知,中药复方极其复杂多样的化学成分与对疾病的综合调节作用,既是中医药的特色优势,也是明晰其效应基础的难点,明确复方主要化学成分、入血及组织分布特征,对于解析其药效物质具有较大的参考意义。例如本研究中发现黄连解毒汤口服后,有32种化学成分在脑组织中被检测到,其中小檗碱、黄连碱、黄柏碱等生物碱成分有较好的分布,提示在研究黄连解毒汤针对阿尔茨海默病、脑缺血等脑部疾病时可更多关注这些入脑的化学成分。此外,值得关注的是中药化学成分在体内可能会在肠道或肝脏中发生代谢转化,产生相应代谢产物,一些代谢产物被报道具有很好的药理活性,如小檗碱在肠道的变形杆菌属BM1和BM2作用下能够转化为小檗红碱、药根碱、非洲防己碱、唐松草酚定和2,3-去亚甲基小檗碱,其中小檗红碱与小檗碱在调血脂和降血糖具有相似的生物活性[25];黄芩苷在肠道中转化为黄芩素,吸收到体内后又可以代谢转化为黄芩苷,或者通过甲基化与葡萄糖醛酸化转化生成千层纸素-A-7葡萄醛酸,相关葡萄醛酸化物在抗凝血方面均表现出显著活性[26]。本研究仅对黄连解毒汤原型成分入血与组织分布进行了分析鉴定,缺少代谢产物的分析,后续有必要关注黄连解毒汤主要化学成分的体内药物代谢情况,明确黄连解毒汤体内代谢产物。中药复方具有成分复杂、作用机制复杂、提取复杂、多适应症以及多效应等特点,其对机体和疾病的调控作用通常是多通道、多靶点、全方位的整体协调效应,有利有弊。黄连解毒汤清热解毒剂,方中以黄连为君药能够泻心火,作用在中焦;黄芩为臣药能够清上焦火,黄柏和栀子共为佐药,清泻下焦之火,栀子通过导热下行而清泻三焦。四药齐用去除三焦之火邪而清热解毒,达到消除病症。近年来随着黄连解毒汤药理研究的深入,越来越多的药理被证实,新的适应症也在不断的发现。陆允等[27]和张建等[28]通过大鼠服用黄连解毒汤有效部位(总生物碱、总黄酮、总环烯醚萜)后对其脑缺血大鼠白质损伤研究表明,有效部位对大鼠轴突修复抑制信号勿动蛋白NogoA和勿动蛋白受体Nogo receptor有调控作用。能够抑制星形胶质细胞过度活化,干预Cx43表达,保护缺血半暗带神经细胞。崔晓娟等[29]初步证实小鼠服用黄连解毒汤后减轻DSS诱导的UC小鼠结肠黏膜炎症浸润和黏膜损伤,是黄柏内酯、巴马汀和小檗碱作用于MMP9,CASP3靶点进而调节多种经典炎症通路以控制结肠组织炎症。Liu等[30]采用网络药理学方法(化学-靶点-通路)研究栀子中环烯醚萜类的药理作用机制,筛选出栀子苷在内的6种环烯醚萜结合BCL2等36个靶标通路作用于中焦消除炎症。Qi等[31]研究证实黄连解毒汤中主要成分小檗碱、黄连碱等能够损坏细菌细胞壁,能使细胞表面凹陷,出现空洞,从而抑制致病菌。除此以为黄芩苷、黄连碱、黄柏碱的部分药理作用机制被证实,以上研究涉及黄连解毒汤中的化学成分十分有限,而复方中大量其他化学成分的在其药效发挥中的作用仍不够清晰,本研究系统开展了黄连解毒汤化学成分与组织分布研究,对于解析其药效活性物质具有促进作用,后续研究中可以更关注药效靶器官中暴露的化学成分。然而,即使本研究中已有26种化学成分是通过对照品比对确认,仍存在部分化学成分存在同分异构体,未能充分的识别,后续可结合多种不同分析技术或化学分离等手段予以明晰。有研究表明小檗碱可以抑制黄芩苷的吸收,而黄芩苷可以促进小檗碱的吸收[32],同时有研究报道了小檗碱在肝脏中主要被CYP2D6和CYP1A2代谢,分别生成去亚甲基小檗碱、唐松草酚定或小檗红碱,小檗碱对CYP2E1和CYP2D6具有抑制作用,对CYP3A4和CYP1A2有诱导作用[33],这些研究提示黄连解毒汤包含的化学成分之间可能存在有复杂的相互作用,这些相互作用最后体现为协同增效还是配伍减毒不得而知,后续十分也有必要开展相关研究,以增加对中药复方配伍的认识。此外,本研究中的组织分布仅为定性分析,且关注仅原型成分,对代谢产物未做鉴定,后续仍需要开展更为全面的体内代谢过程研究,并结合体内外药效评价模型,开展更为深入的药效物质基础及作用机制研究,以期最终阐明黄连解毒汤的药效物质基础,为该方的临床科学合理应用及相关的新药研发提供科学依据。

图6 大鼠口服黄连解毒汤后肺(A)和心(B) 总离子流图与提取离子峰图

图7 大鼠口服黄连解毒汤后肝(A)和肾(B) 总离子流图与提取离子峰图
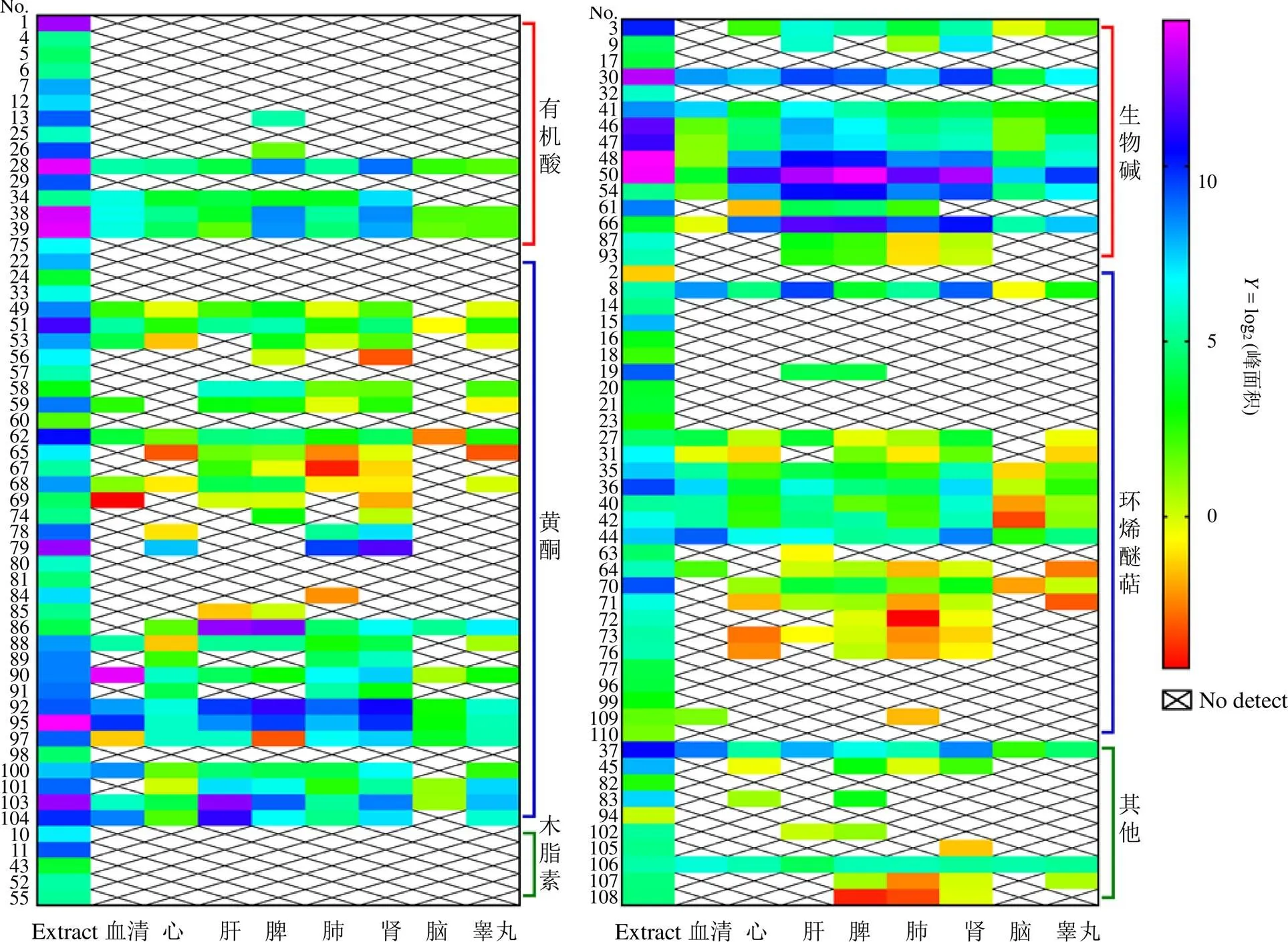
图8 黄连解毒汤原方成分与大鼠口服后血清及组织中转移成分峰面积的热图(均一化峰面积×10−6)
利益冲突 所有作者均声明不存在利益冲突
[1] 张婷, 宋厚盼, 林也, 等. 黄连解毒汤之“清热解毒”药效与作用机制研究进展 [J]. 中华中医药学刊, 2020, 38(11): 135-139.
[2] 魏玉芬. 黄连解毒汤对CLP诱导的脓毒症大鼠的保护作用及其代谢组学研究 [D]. 上海: 第二军医大学, 2014.
[3] 陈一君, 吴庆光, 刘颖, 等. 黄连解毒汤单独用药及联合用药对2型糖尿病治疗效果的Meta分析 [J]. 中国实验方剂学杂志, 2018, 24(10): 212-220.
[4] 孙莉敏, 刘丽芳, 朱华旭, 等. 基于网络药理学的黄连解毒汤治疗阿尔兹海默症的作用机制研究 [J]. 药学学报, 2017, 52(8): 1268-1275.
[5] 冯强, 吕凡芹. 黄连解毒汤合五味消毒饮治疗急性感染性心内膜炎的临床效果[J]. 世界中医药, 2020, 15(14): 2138-2141.
[6] 张晓囡, 张军平, 徐士欣, 等. 基于网络药理学的黄连解毒汤治疗高血压潜在机制研究 [J]. 中草药, 2018, 49(24): 5865-5875.
[7] 王宸罡, 齐新, 王丽, 等. 简述黄连解毒汤的药理作用及临床应用 [J]. 天津中医药大学学报, 2018, 37(5): 433-436.
[8] Yang S J, Li D, Yu Z L,. Multi-pharmacology of berberine in atherosclerosis and metabolic diseases: Potential contribution of gut microbiota [J]., 2021, 12: 709629.
[9] 陈桂荣, 荆婧, 刘雨浓, 等. 黄连解毒汤抗内毒素血症的体内活性研究 [J]. 中华中医药学刊, 2021, 39(4): 87-90.
[10] 杨丽宏. 黄连解毒汤中13种活性成分的HPLC检测及其有效部位筛选与物质组方安全性评价 [D]. 兰州: 甘肃农业大学, 2020.
[11] 孙健, 马吉胜, 金瑾, 等. 黄连解毒汤各成分的HPLC-UV/MS定性与定量测定方法研究 [J]. 药学学报, 2006, 41(4): 380-384.
[12] Peng C C, Wang S P, Jin H Z,. Bioanalysis and pharmacokinetics of eight active components from Huanglian Jiedu Decoction in rat plasma by LC-ESI-MS/MS method [J]., 2014, 6(3): 198-210.
[13] 刘伟, 葛广波, 王永丽, 等. 基于UHPLC-Q-Orbitrap HRMS技术研究清肺排毒汤化学成分及小鼠组织分布 [J]. 中草药, 2020, 51(8): 2035-2045.
[14] 崔杏, 陈瑞, 郑萍, 等. UPLC-Q-TOF MSE方法快速分析黄柏的化学成分 [J]. 广州化工, 2017, 45(16): 105-107.
[15] 陈梦倩, 王允吉, 冯芳. 基于UPLC-Q-Exactive Orbitrap-MS的栀子甘草豉汤化学成分分析 [J]. 广州化工, 2021, 49(8): 97-103.
[16] 张烨, 邓琦, 魏敏, 等. 黄连花薹化学成分的UPLC-Q-Orbitrap HRMS鉴定[J]. 中国实验方剂学杂志, 2021, 27(15): 91-99.
[17] 郝艺铭, 霍金海, 王涛, 等. UPLC-Q-TOF/MS技术分析黄连中非生物碱类成分 [J]. 中药材, 2020, 43(2): 354-358.
[18] 陈俊, 陈聪, 彭小芝, 等. 基于UPLC-Q/TOF-MS/MS的葛根黄芩黄连汤主要成分分析及鉴定 [J]. 中药材, 2019, 42(9): 2074-2078.
[19] 尹智慧. 咖啡酰奎宁酸类化合物ESI-ITMSn裂解的量子化学研究 [D]. 佳木斯: 佳木斯大学, 2017.
[20] 王永丽, 张聪聪, 张凤, 等. UHPLC-Q-Exactive Orbitrap HR-MS分析荆银颗粒的化学成分及其组织分布特征 [J]. 中国中药杂志, 2020, 45(22): 5537-5554.
[21] 李淑娇, 王宇卿, 庄果. 基于HPLC-DAD结合HPLC-Q-TOF/MS的黄连活性成分筛选 [J]. 中国医院药学杂志, 2019, 39(8): 781-785.
[22] 魏婷婷, 沈晨, 韩园园, 等. UPLC-Q-TOF-MS快速鉴定止动颗粒血浆及尿液中移行成分 [J]. 中草药, 2019, 50(17): 4244-4253.
[23] 刘亚涛, 刘芳, 贺晓立, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱测定五味子和醋五味子中8种木脂素成分含量 [J]. 中国医院药学杂志, 2020, 40(13): 1421-1427.
[24] 黄涛阳, 王晖, 翁燕君, 等. 电喷雾电离-串联质谱快速分析黄连解毒汤的化学成分 [J]. 中药材, 2017, 40(1): 119-121.
[25] 李梦. 小檗碱的肠道菌群生物转化研究 [D]. 上海: 上海交通大学, 2014.
[26] Liu W, Huang J, Zhang F,. Comprehensive profiling and characterization of the absorbed components and metabolites in mice serum and tissues following oral administration of Qing-Fei-Pai-Du Decoction by UHPLC-Q-Exactive-Orbitrap HRMS [J]., 2021, 19(4): 305-320.
[27] 陆允, 赵海誉, 杨乐, 等. 黄连解毒汤有效部位抑制NogoA/NgR表达对脑缺血大鼠白质损伤的影响 [J]. 国际中医中药杂志, 2021, 43(2): 142-149.
[28] 张建, 龙建飞, 邹海艳, 等. 黄连解毒汤有效部位对脑缺血半暗带区星形胶质细胞活化及Cx43表达的影响 [J]. 中草药, 2014, 45(13): 1876-1882.
[29] 崔晓娟, 卢卓, 肖思萌, 等. 黄连解毒汤对UC小鼠的抗炎作用、入血成分测定及其作用靶点的虚拟筛选 [J]. 中国中药杂志, 2021, 46(1): 206-213.
[30] Liu F Z, Li Y B, Li M,. Study on mechanism of iridoid glycosides derivatives from fructus gardeniae in Jiangxi Province by network pharmacology [J]., 2020, 2020: 4062813.
[31] Qi Y J, Zhang H, Wang D M,. Antibacterial efficacy and molecular docking analysis of Huang-Lian-Jie-Du Decoction against the phytopathogenic bacteria P. carotovorum PC1 [J]., 2021, 1234: 130141.
[32] 杜青青, 王战国, 刘芳, 等. 黄芩苷与盐酸小檗碱在大鼠小肠吸收的相互作用研究 [J]. 中国药房, 2010, 21(11): 965-967.
[33] 陈健龙. 小檗碱与肝药酶的相互作用及其代谢机制研究 [D]. 长春: 长春中医药大学, 2014.
Chemical profiling and tissue distribution study of Huanglian Jiedu Decoction in rats by UHPLC-Q-Exactive Orbitrap HRMS
WANG Yong-li1, HUANG Guang-jian3, LIU Cong-jin3, QI Sheng-lan1, LI Rong-sheng2, LIU Wei1, 2
1. Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;2. Institute of Liver Diseases, Key Laboratory of Liver and Kidney Diseases, Ministry of Education, Shanghai Key Clinical Laboratory of Traditional Chinese Medicine, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 3. Huashan Hospital, Fudan University, Shanghai 200040, China
The UHPLC-Q-Exactive Orbitrap HRMS technology was used to efficiently, quickly and accurately analyze and identify the chemical components of Huanglian Jiedu Decoction (HJD, 黄连解毒汤) and the distribution of its main components in different tissues after oral administration in rats.An Acquity UPLC BEH C18column (100 mm ×2.1 mm, 1.7 µm) was used for chromatographic separation, with 0.1% formic acid aqueous solution-methanol as mobile phase gradient elution. Chemical constituents in HJD were rapidly isolated and identified by HRMS in the positive and negative ion mode with both full scan and two stage threshold-triggered mass modes (Full MS/dd-MS2). On this basis, the transitional components in the blood and tissues of rats after oral administration of HJD were identified.A total of 110 chemical constituents were identified from Huanglian Decoction Soup, including 36 kinds of flavonoids, 28 kinds of iridoids, 15 kinds of alkaloids, 15 kinds of organic acids, 5 kinds of lignans, and 11 kinds of other compounds, by the primary and secondary mass spectrometry information of the compounds, combined with the confirmation of the retention times and MS/MS spectra of the standards by comparison and analysis of related literature. After oral administered HJD to rats, 40, 50, 55, 65, 61, 62, 32, 46 prototype compounds were detected in serum, heart, liver, spleen, lung, kidney, brain, and testicles, respectively. According to the homogenization peak area of each prototype component in the extract, serum and tissues, it can be known that gardoside, coptisine, berberine, palmatine, jatrorrhizine, phellodendrine have large exposure in liver, kidney, and other tissues.With the help of ,UHPLC-Q-Exactive Orbitrap HRMS method, the identification of the constituents in HJD was systematically, accurately and rapidly achieved, and the tissue distribution of main components were investigated in rats following oral administration of HJD. These findings provided key information and guidance for further studies on pharmacodynamic substances and clinical applications of HJD.
UHPLC-Q-Exactive Orbitrap HRMS; Huanglian Jiedu decoction; tissue distribution; pharmacodynamic substance;geniposide;coptisine; berberine; palmatine;jateorhizine; phellodendrine
R284.1
A
0253 - 2670(2022)22 - 6985 - 16
10.7501/j.issn.0253-2670.2022.22.002
2022-03-24
国家自然科学基金项目(81703681);中国科协青年托举工程项目(2020QNRC001);上海市教育委员会和上海市教育发展基金会“晨光计划”项目(20CG50);上海市科技创新行动计划项目(20S21902600);上海市科技创新行动计划项目(19401972700)
王永丽,硕士,实验师,从事中药药效物质基础及质量标准研究。E-mail: ylwang521@126.com
刘 伟,博士,副研究员,从事中药复方药效物质基础与体内过程研究。Tel: (021)20256526 E-mail: lwhzayl@163.com
李荣胜,工程师,从事药物分析及药物代谢动力学研究。Tel: (021)20256526 E-mail: rongsheng.li@shhhzy.com
[责任编辑 王文倩]

