外泌体对阿霉素诱导的心脏毒性治疗的研究及应用进展*
董香军,郝长来
067000 河北 承德, 承德医学院附属医院 血液内科
阿霉素(doxorubicin,DOX)是一种有效的化 疗药物,被广泛用于实体瘤和血液肿瘤的治 疗[1]。然而,由于潜在的心脏毒性,其临床应用在很大程度上受到限制。DOX诱导的心脏毒性(doxorubicin-induced cardiotoxicity,DIC)包括几种不同的潜在机制,包括心肌细胞自噬、DNA损伤、拓扑异构酶II的抑制、氧化应激、线粒体功能障碍、细胞内钙超载,以及炎症反应的发生,进而导致心肌细胞凋亡、衰老及心肌纤维化[2]。
迄今为止,DOX心肌病本身尚无治疗方法。目前DIC的治疗选择相当有限,根据2021年最新发布的《肿瘤治疗相关心血管毒性防治指南》,右拉唑烷是FDA批准的唯一用于预防DIC的心脏保护药物[3]。由于DOX仍然是许多癌症治疗的一线药物,因此需要开发出更多安全有效的药物来减轻DOX诱导的心肌损伤。
最新的研究发现外泌体[4]是一种有潜力的化疗药物递送载体。已有研究[5]证明外泌体可以提高DOX递送到肿瘤细胞的效率,同时降低对非靶器官的毒性。基于外泌体的制剂可以为DOX的应用提供新型高效的药物递送系统,并可能更大程度地改善患者预后。
1 外泌体的定义、主要成分和功能
外泌体是天然存在的细胞外囊泡(extracellular vesicles, EVs)[6],直径为50~150 nm,可由多种类型细胞在不同生理条件下分泌。外泌体由双层磷脂膜结构和多种生物活性物质如蛋白质、脂质、微RNA(miRNA)、信使RNA(mRNA)、DNA片段、转录因子等组成。外泌体与许多疾病的发生和发展密切相关,例如癌症和心血管疾病[7]。
蛋白质是外泌体的重要组成部分,参与调节细胞间通讯的信号转导,例如四泛素家族(CD9、CD63、CD81、CD82)、肿瘤抑制基因101、热休克蛋白等。外泌体的脂质双层膜可以保护外泌体内容物免于降解,使它们能够牢固地携带和传递来自其起源细胞的重要生物信号,并通过体液(血液,尿液)将其内容物运输到受体细胞中,因而可有效介导细胞之间的信息通讯[8]。此外,目前的研究显示[9],循环 miRNA 存在于外泌体中,在细胞间传递从而发挥调节作用。外泌体保护循环 miRNA 免受降解,保证其稳定性并在血液中循环。
2 外泌体在DIC中的作用
外泌体是小的内源性EVs,可将生物活性物质从一个细胞转移到另一个细胞,并且由于其天然来源而被认为是有前途的药物递送载体[10]。近几年,关于外泌体药物递送或者外泌体治疗的报道越来越多,外泌体治疗逐渐从研究进入到应用的阶段,药物递送已经迎来了外泌体的时代[11]。大量的证据[12]证实,外泌体可能在DIC的发生、诊断和治疗中起核心作用,为建立有效的临床诊断和治疗策略提供了新的方法。与DOX的其他递送方法相比,外泌体递送可以减少心肌细胞对DOX的摄取和心肌细胞中DOX的分布,从而直接降低心脏毒性。来自各种干细胞的外泌体增强了心肌活力,并改变了病理环境下的不良心脏重塑。研究发现,来自干细胞的外泌体在DOX诱导的心肌病中显示出治疗效果 (表1)。

表1 不同细胞来源的外泌体在DIC中发挥着不同的作用 Table 1.Different Roles of Exosomes from Different Sources in DIC
2.1 胚胎干细胞(embryonic stem cell,ESC)衍生的外泌体(ESC-Exos)
干细胞,尤其是ESC,已被广泛接受为许多疾病(包括心血管疾病)的有效治疗方法[13]。但是,由于ESC治疗可能致畸胎瘤形成,导致其临床使用受限;此外,在ESC移植后,只有有限数量的细胞可以植入并分化成心脏细胞或参与抑制不良心脏重塑。因此,最近的研究[14]发现将ESC-Exos作为ESC治疗的更安全的替代方法,能够避免上述致畸副作用的发生。Tavakoli等[15]的研究表明,ESC-Exos可显著抑制DOX诱发的心肌细胞中的炎症和焦亡,降低了DOX的心脏毒性。Singla等[16]研究发现在接受DOX处理的小鼠心脏组织中,炎症小体标志物[Toll样受体4(toll-like receptor 4,TLR4)、含NLR家族Pyrin域蛋白3(NLRP3)]和细胞焦亡标记物[半胱天冬酶-1(caspase-1)、白介素1(IL1-β、IL-18)]的表达显著增加,而ESC-Exos抑制了这些标志物的增加,减少了炎症诱发的细胞焦亡。总之,ESC-Exos可以减轻DOX诱导的心肌损伤进而改善心脏功能,为DIC的治疗提供了一种新的选择。
2.2 滋养层干细胞(trophoblast stem cell,TSC)衍 生的外泌体 (TSC-Exos)
TSC[17]是胎盘滋养层细胞的前体,具有在体外分化成各种滋养层亚型的潜力。作为干细胞家族的主要成员,被广泛用于人类各种疾病的研究和治疗。TSC已被证实在心血管疾病中发挥心脏保护作用。此外,TSC分泌大量外泌体并在许多生物过程中发挥有益作用。有研究证实[18]TSC-Exos可以在DOX诱导的心肌病中发挥重要的保护作用。
2.3 心脏祖细胞(cardiac progenitor cell,CPC)来源的外泌体(CPC-Exos)
人类CPC分泌EVs,包括纳米大小的外泌体,在心血管疾病中起着关键作用[19]。Milano等[20]使用大鼠模型研究了CPC来源的外泌体在DIC发生、发展中起的作用。结果显示DOX显著诱导了心肌细胞中的氧化应激。此外,DOX还诱导心肌纤维化、炎性细胞浸润等,最终导致心室功能不全甚至心脏衰竭。然而,在静脉注射CPC来源的外泌体之后,DOX对心脏的这些有害副作用得到很大程度的改善,可以起到增强心脏功能、加速血管形成并预防纤维化的重要作用。因此,来自人CPC-Exos可以通过抑制氧化应激,减少心肌纤维化、炎症反应等,减弱DOX诱导的心脏毒性。
2.4 间充质干细胞(mesenchymal stem cell,MSC) 衍生的外泌体(MSC-Exos)
MSC是一种具有临床转化应用前景的干细胞,拥有强大的免疫调节功能、抗炎和组织修复潜能。间充质干细胞已被广泛接受为心血管疾病的有效治疗方法[21]。然而,在MSCs移植后,只有有限数量的细胞可以分化成心脏细胞或参与心脏修复。因此,最近的研究[22]将MSC-Exos作为MSCs治疗的更安全的替代方法。目前研究[23]表明,MSC-Exos具有与MSCs相似的组织修复特性,通过携带功能性蛋白质、RNA,或脂质,并将其递送到靶细胞以实现其功能,同时MSC-Exos安全性、稳定性强,可以进行修饰及工程化,因此可以作为一种非细胞治疗生物药物,从长远来看,可能是一种替代间充质干细胞治疗的新方法。Ebrahim等[24]报道了在DOX介导的心脏毒性模型中研究MSCs衍生外泌体的心脏保护作用,阐明了MSC-Exos通过抑制DOX诱导的心脏组织中的氧化应激、DNA损伤和细胞凋亡,减轻了心脏损伤。因此,MSC-Exos被认为是防止化疗期间心脏毒性的一种有利的治疗策略。
2.5 骨髓间充质干细胞(bone mesenchymal stem cell,BMSC)衍生的的外泌体(BMSC-Exos)
BMSC[25]是治疗心脏损伤的新兴且有前途的方法。然而,移植干细胞的存活率非常低,阻碍了移植效率,从而导致治疗效果受损。近年来,在临床前和临床试验中用于治疗的BMSC-Exos在病理条件下显示出相当大的保护特性[26]。有证据表明[27],BMSC-Exos在DOX诱导的心肌损伤中起着关键作用。Lei等[28]将BMSC-Exos注射到DOX治疗的大鼠中,发现BMSC-Exos抑制DOX诱导的心肌细胞中的氧化应激和心肌炎症反应,改善了大鼠的心脏收缩和舒张功能,从而减弱DOX造成的心脏损伤。目前看来,BMSC-Exos在降低DOX化疗产生的相关心脏风险方面具有较好的前景。
3 外泌体作为递送载体在DIC中的作用
近年来,药物递送领域在提高从小分子到大分子生物制剂(如核酸,蛋白质等)的各种候选药物的治疗潜力方面取得了巨大进步。化疗相关的心脏毒性现在正成为癌症患者预后的最大障碍之一。治疗性递送保护性微RNA和长链非编码RNA有望预防和治疗心脏毒性。有研究表明[29],DOX的外泌体递送可实现快速细胞进入并增强体外效力。外泌体可以将各种货物(如蛋白质,miRNA、lncRNA和mRNA)携带到受体细胞,以调节靶细胞的基因表达和功能,正在成为药物递送载体和细胞间信号转导的新型介质(图1)。
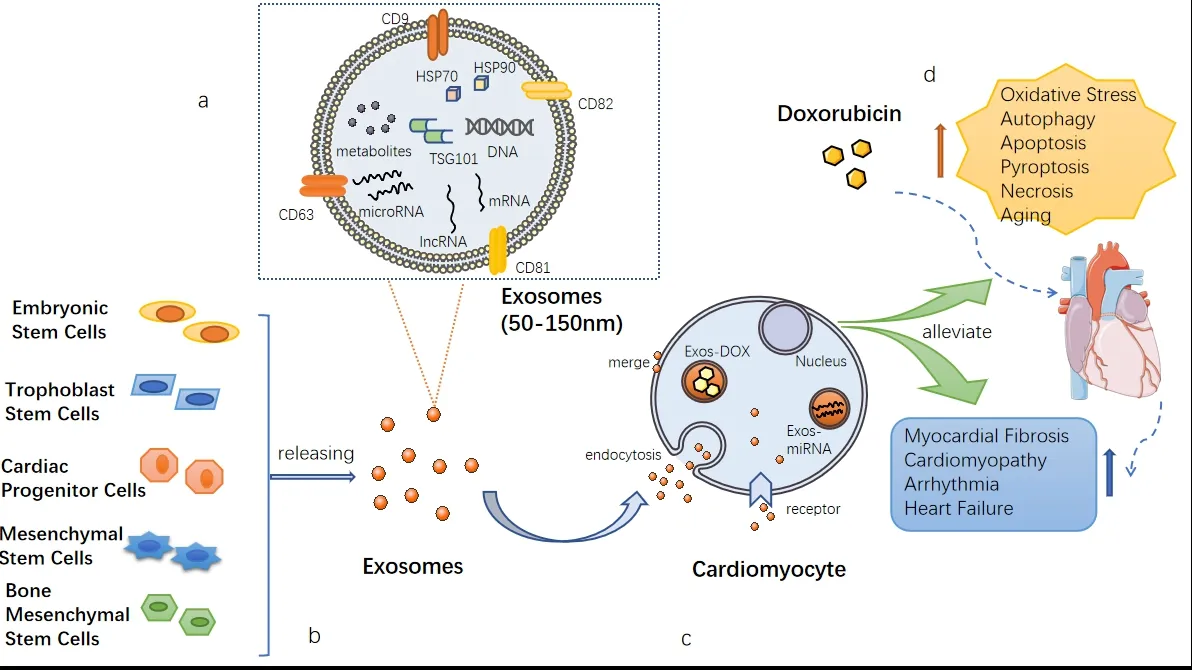
图 1 外泌体的来源、功能以及在减轻DIC中的应用Figure 1.Sources and Functions of Exosomes and Their Application in Reducing DIC
3.1 外泌体作为载体递送DOX以减轻药物毒性
近些年来,外泌体在药物递送和肿瘤靶向治疗方面的巨大潜力日益突出[30]。越来越多的研究证明[31],可以构建外泌体来提供DOX以治疗癌症,并且与传统形式的DOX(如脂质体或游离药物)相比,外泌体具有递送功效强、免疫原性低、靶向效果好等优势,显示出更好的负载能力和出色的功效[32],因此可以获得比游离DOX更好的治疗效果和更少的副作用,这也为肿瘤的精确靶向和治疗提供了新的 方向。
3.2 外泌体相关miRNA与DIC
据报道[33],抗肿瘤药物DOX可以通过诱导某些miRNA的表达而引起心脏损伤。目前的研究显示,外泌体能够保护循环miRNA避免其降解,维持其稳定性,从而在细胞间传递过程中发挥调节作 用[34]。近年来,研究表明,将miRNA装载入外泌体递送到心脏组织,可以减轻DOX的心脏毒副作用。此外,外泌体负载的miRNA还具有良好的抗肿瘤作用[35]。由此可知,通过外泌体递送miRNA到心肌细胞能够在不影响DOX的抗癌效果的同时减弱其副作用。来自干细胞的外泌体显示出对DOX诱导的心肌病的治疗效果(表2)。
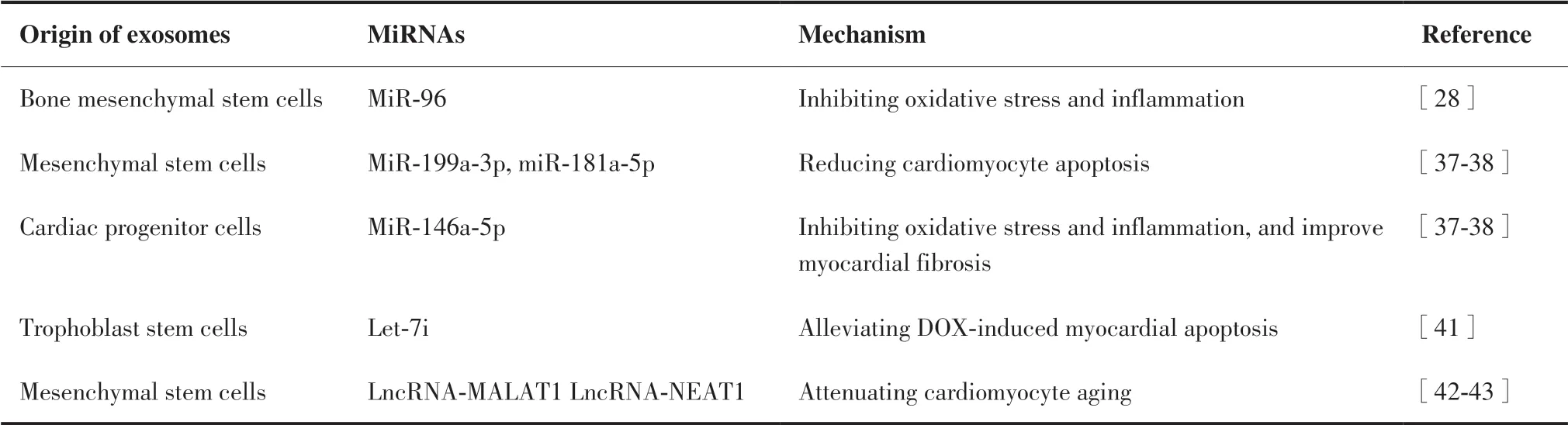
表2 不同细胞来源的外泌体递送miRNA/lncRNA以减轻DICTable 2.Different Cell-Derived Exosomes Deliver miRNA/lncRNA to Mitigate DIC
3.2.1 MSC-Exos递送miRNA以改善DIC MSC-Exos在传递miRNA、mRNA等物质以促进细胞间通讯方面起着关键作用[36]。MSC-Exos通过向病变部位输送各种miRNA对各种疾病具有保护作用。在DIC发生机制中,心肌细胞凋亡起的作用至关重要。Lee等[37]的研究结果显示,MSC-Exos通过递送miR-199a-3p来上调细胞凋亡蛋白抑制剂Survivin和抗凋亡因子Bcl2的含量,减弱了DOX诱导的心肌细胞凋亡,因此在一定程度上改善了DOX造成的心脏损伤。最近一项研究[38]证明了对于DIC,MSC-Exos中封装的miR-181a-5p通过抑制内质网应激诱导的心肌凋亡发挥了关键作用。
3.2.2 BMSC-Exos递送miRNA抑制DIC 大量研 究[39]表明,氧化应激和炎症反应是DIC的重要机制。最近的一项研究[28]发现,在DOX用药后心肌细胞内miR-96水平出现下调,miR-96通过靶向抑制Rac1可以改善心肌细胞中DOX诱导的氧化应激和炎症反应,减弱DOX的心脏毒性。Lei等[28]将BMSC-Exos注射到DOX治疗的大鼠体内,研究结果显示来自BMSC-Exos的miR-96减轻了DOX引起的心肌损伤。miR-96通过抑制Rac1和下游NF-kB信号传导来发挥心脏保护作用。这为BMSCs-Exos用作DIC治疗中miRNA的载体提供了依据。
3.2.3 CPC-Exos递送miRNA以改善DIC CPC-Exos miRNA可通过靶向下游的mRNA来调节心脏功能,介导心肌修复和修复后的细胞间通讯。Milano等[38]报道在经DOX处理后的心肌细胞中,CPC-Exos能够通过抑制miR-146a-5p的靶基因(Traf6、Mpo)的表达,减轻DOX诱导的活性氧生成增多、炎性细胞浸润和心肌纤维化等。
3.2.4 TSC-Exos递送miRNA以改善DIC 近年的研究表明TSC-Exos可携带miRNA参与疾病的发生与发展过程[40]。Ni等[41]通过使用小鼠和AC16心肌细胞构建DIC模型得出结论,TSC-Exos可以将let-7i转移到心肌细胞中,并沉默Hippo-YAP信号通路,进而缓解DOX诱导的心脏损伤,为TSC-Exos作为DIC潜在治疗工具的应用提供了新的视角。
3.2.5 外泌体递送长非编码RNA(long-noncoding RNA,lncRNA)以减轻DIC DOX的心脏毒性通常归因于线粒体损伤和心肌细胞衰老诱导。此外,DOX诱导的细胞衰老导致心血管功能障碍[42]。Xia等[43]报 道 了MSC-EXOs-lncRNA-MALAT1可 能通过调节miR-92a-3p / ATG4a轴来减弱DOX诱导的心脏衰老,表明外泌体可用于递送lncRNA MALAT1以改变DOX诱导的衰老,这可能具有临床意义。Zhuang等[44]的研究证明了外泌体通过lncRNANEAT1转移能够抑制miR-221-3p,从而作为一种有前途的抗衰老效应剂来对抗DOX诱导的心脏毒性。最新一项研究[45]表明,BMSC-EXOs-lncRNA通过抑制炎症来缓解DOX诱导的心脏毒性。综上可知,外泌体-lncRNA可能在减轻DOX诱导的心脏毒性的调节过程中起着重要作用。
4 总结与展望
随着化疗的广泛应用,化疗药物(如DOX)引起的心脏毒性成为人们关注的重点。已有研究证明外泌体能够作为药物或miRNA的载体来减轻使用DOX造成的心脏损害。
与传统的治疗方案相比,外泌体为治疗DIC提供了新的角度。不管是外泌体自身的治疗作用还是其递送药物或miRNA的作用,均能为接受化疗的肿瘤患者带来更好的效果和更少的副作用。这种新型治疗策略具有多方面的优势,如:低免疫原性、良好的生物相容性、高稳定性以及精准的靶向性。因此,外泌体在DIC的治疗中起着不可或缺的作用。
虽然,外泌体递送药物已成为目前研究的热点,但仍存在临床应用限制。外泌体研发起步晚,临床应用仍然处于初级阶段,面临很多的挑战,如:外泌体的分离和纯化、外泌体载药效率低下、如何对载药效果进行准确评估等。
总而言之,在当前精准医疗的大环境下,外泌体的发现和研究为肿瘤心脏病学提供了崭新的方向。不过,外泌体距离成为“理想的载体”,还有一系列的技术挑战有待克服,需要研究人员继续进行探索,对这种新型疗法进行生物或工程方法的改进,以进一步发挥临床治疗潜力,将有助于推动该领域向前发展。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

