阿伐曲泊帕治疗化疗相关性血小板减少症1例*
刘晨晨,刘春燕,刘鸿,付蓉,卲宗鸿
300052 天津,天津医科大学总医院 血液科
肿瘤化疗相关性血小板减少症(chemotherapyinduced thrombocytopenia,CIT)指化疗药物抑制骨髓中的巨核细胞,导致外周血中血小板计数低于正常值(PLT < 100×109/L)[1]。CIT可能导致患者原有治疗中断,且面临着巨大的出血风险。一般临床推荐患者PLT < 75×109/L或出现出血症状时及时处理,如输注血小板或药物治疗[2]。目前,仅白细胞介素-11(interleukin-11,IL-11)和重组人促血小板生 成 素(recombinant human thrombopoietin, rhTPO)获国家药品监督管理局 (National Medical Products Administration,NMPA)批准用于治疗CIT。艾曲波帕是国内首个获批的口服血小板生成素受体激动剂 类(thrombopoietin receptor agonists, TPO-RAs)药物,适用于治疗免疫性血小板减少症、重度再生障碍性贫血,但艾曲波帕可能导致肝毒性,主要表现为转氨酶升高[3],影响患者的病程及疗效。因此,寻找其他同类药物替代治疗就变得尤为重要。现报道 1例CIT患者口服艾曲波帕致肝毒性,应用阿伐曲泊帕后转氨酶、血小板水平恢复正常。阿伐曲泊帕对于CIT患者可能是有效且安全的,希望通过本案例为临床医生处理CIT提供一个有利的选择。
1 病例资料
患者,女性,66岁,因“发现血小板减少9月,加重2月”于2021年5月7日入住我院。患者2020年7月20日因卵巢癌于外院行双侧卵巢及子宫切除术,2020年8月24日开始接受6周期TC方案化疗:紫杉醇 300 mg d1+卡铂 0.45 g d1, q3w。患者第1周期化疗后第2周出现4度骨髓抑制,PLT 最低67×109/L,予重组人白细胞介素11(recombinant human interleukin 11,rhIL-11)和rhTPO等治疗,2020年10月7日患者血小板恢复至100×109/L。第2周期后以rhIL-11和rhTPO预防性升血小板治疗,血小板维持在100×109/L。患者第6周期TC方案化疗后3周血小板计数再次下降(PLT 36×109/L),继续接受IL-11、rhTPO治疗,血小板计数波动在10×109/L ~ 40×109/L。2021年3月25日加用艾曲波帕50 mg/d口服治疗,间断输注血小板支持治疗,血小板计数仍波动在10×109/L ~ 20×109/L。患者为求进一步诊治入住我院。查体:贫血貌,皮肤黏膜未见瘀点、瘀斑,全身浅表淋巴结未触及肿大,肝脾肋缘下未触及。既往无高血压、糖尿病、免疫疾病等病史。
入 院 检 查:血 常 规:WBC 7.76×109/L,RBC 2.99×1012/L,HGB 104 g/L,PLT 14×109/L,中 性 粒细胞绝对值3.15×109/L,网织红细胞计数94.80× 109/L,网织红细胞百分比3.17%。肝功能:TBIL 19.1 mmol/L,AST 16 U/L,ALT 20 U/L,ALKP 68 U/L,GGT 27 U/L;贫血四项:血清铁蛋白356.06 ng/mL,叶酸10.14 ng/mL,维 生素B12 > 2 000.00 pg/mL,EPO 79.70 mIU/mL。病毒检测:EB病毒、肝炎病毒、艾滋病、梅毒阴性;免疫全项+风湿抗体阴性。肿瘤标志物、甲状腺功能未见异常。PET/CT:(1)“卵巢癌术后”改变;(2)体部显像未见恶性肿瘤征象,结合病史,符合肿瘤治疗后图像改变。骨髓像:胸骨粒红巨三系增生,髂骨粒系增生,红系减低,未见巨核。MDS表型、淋巴表型、MDS-FISH、GPI锚蛋白、血小板抗体、游离血红蛋白、结合珠蛋白及膜抗体检查均阴性。染色体核型正常。骨髓活检:骨髓增生极度低下,仅见少许偏成熟粒红细胞,全片检见巨核细胞一个。
患者多次查外周血PLT < 100×109/L,发病前应用卵巢癌化疗药物,存在可能引起血小板减少的因素。结合化验检查,除外其他因素致血小板减少(如骨髓增生异常综合征、免疫性血小板减少等血液病、感染、凝血功能异常)以及假性血小板减少等。患者诊断为肿瘤化疗相关性4级血小板减少症。
2021年5月9日继续予艾曲波帕(50 mg/d)促造血,叶酸、甲钴铵等补充造血原料,辅以保肝治疗,酚磺乙胺(2 g/d)预防出血,并在血小板 < 20×109/L 时予配型血小板输注。2021年5月17日监测到患者转氨酶明显升高,ALT升高大于3倍(ALT 131 U/L),AST升高大于2倍(AST 73 U/L),考虑艾曲波帕引起肝毒性。此时,患者已口服艾曲波帕1月,血小板水平仍在20×109/L左右。患者及家属拒绝继续艾曲波帕治疗,故以阿伐曲泊帕(40 mg/d)替代艾曲波帕治疗,其他治疗方案不变。患者外周血象明显改善,并逐渐完全脱离血制品输注,且没有出现出血症状。患者门诊随访至2021年8月22日(阿伐曲泊帕治疗第14周),转氨酶水平恢复正常(ALT 15 U/L,AST 23 U/L),血小板计数恢复正常水平(PLT 249×109/L)。患者治疗过程中主要时间节点及血小板计数见图1。
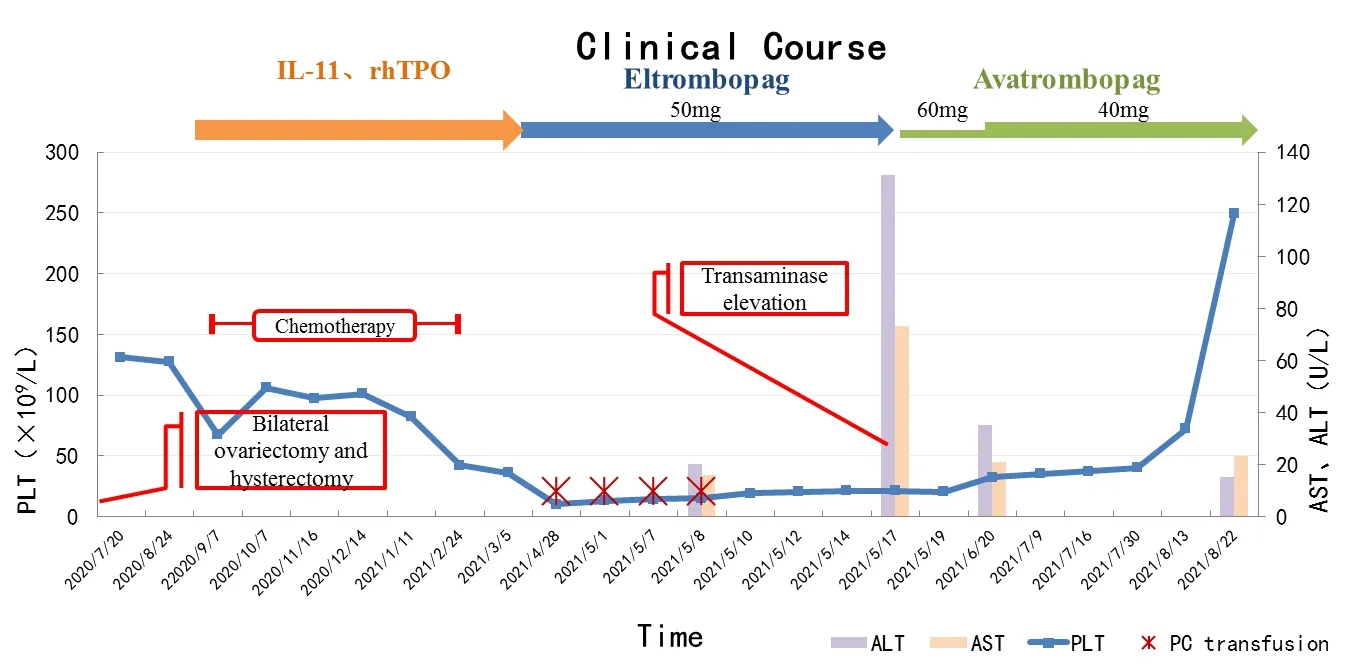
图1 患者治疗过程中血小板、转氨酶变化Figure 1.Changes in Platelets and Transaminase during Treatment
2 讨 论
CIT是非血液系统恶性肿瘤治疗的常见并发症,化疗药物在清除肿瘤细胞的同时,对正常骨髓造血功能产生抑制作用,破坏骨髓微环境,从而导致外周血血小板水平降低[4]。血小板的正常寿命为8 ~ 10天,经过多种类型的化疗后,血小板计数一般在第7天开始下降,在第14天达到最低点,并在第28天逐渐返回基线。许多与患者相关的变量决定了CIT的程度,如患者年龄、肿瘤类型、既往化疗周期数、骨髓肿瘤受累程度。
本例卵巢癌患者术后接受紫杉醇、卡铂方案化学治疗,多次外周血PLT < 100×109/L,首先考虑化疗引起的血小板减少。在鉴别诊断方面,首先应该考虑该例患者是否存在转移?转移性肿瘤细胞对骨髓的浸润可导致骨髓衰竭和血液学异常,大多数表现为全血细胞减少,骨髓浸润通常超过80%。而本例患者仅有血小板减少,提示骨髓浸润不是其血小板计数下降的原因。在排除肿瘤浸润后,须排除其他继发性血小板减少症。患者肝肾功能、凝血功能、游离甲功、免疫、病毒等化验未发现明显异常,排除了继发性血小板减少,如自身免疫性疾病、甲状腺疾病、慢性肝病、脾功能亢进、感染、凝血功能异常等。骨穿流式及活检排除了骨髓增生异常综合征、再生障碍性贫血、恶性血液病等。综上,结合患者既往病史及相关检查,诊断为CIT。
血小板减少不仅增加患者出血风险,由此导致患者化疗剂量减少或者延迟,改变化疗方案,影响病情控制。所以,如何安全且高效地治疗CIT是临床实践中的重要挑战。临床处理策略通常是患者出现出血症状或者血小板计数低于75× 109/L时采取干预措施,包括血小板输注或使用促血 小 板 生 长 药 物,如IL-11、rhTPO、TPO-RAs等[5](表1)。患者需多次输血支持治疗,以及进行评估出血风险的相关检查,既增加医疗费用,又降低化疗疗效和生存质量。目前仅rhIL-11和rhTPO获NMPA批准用于治疗CIT。
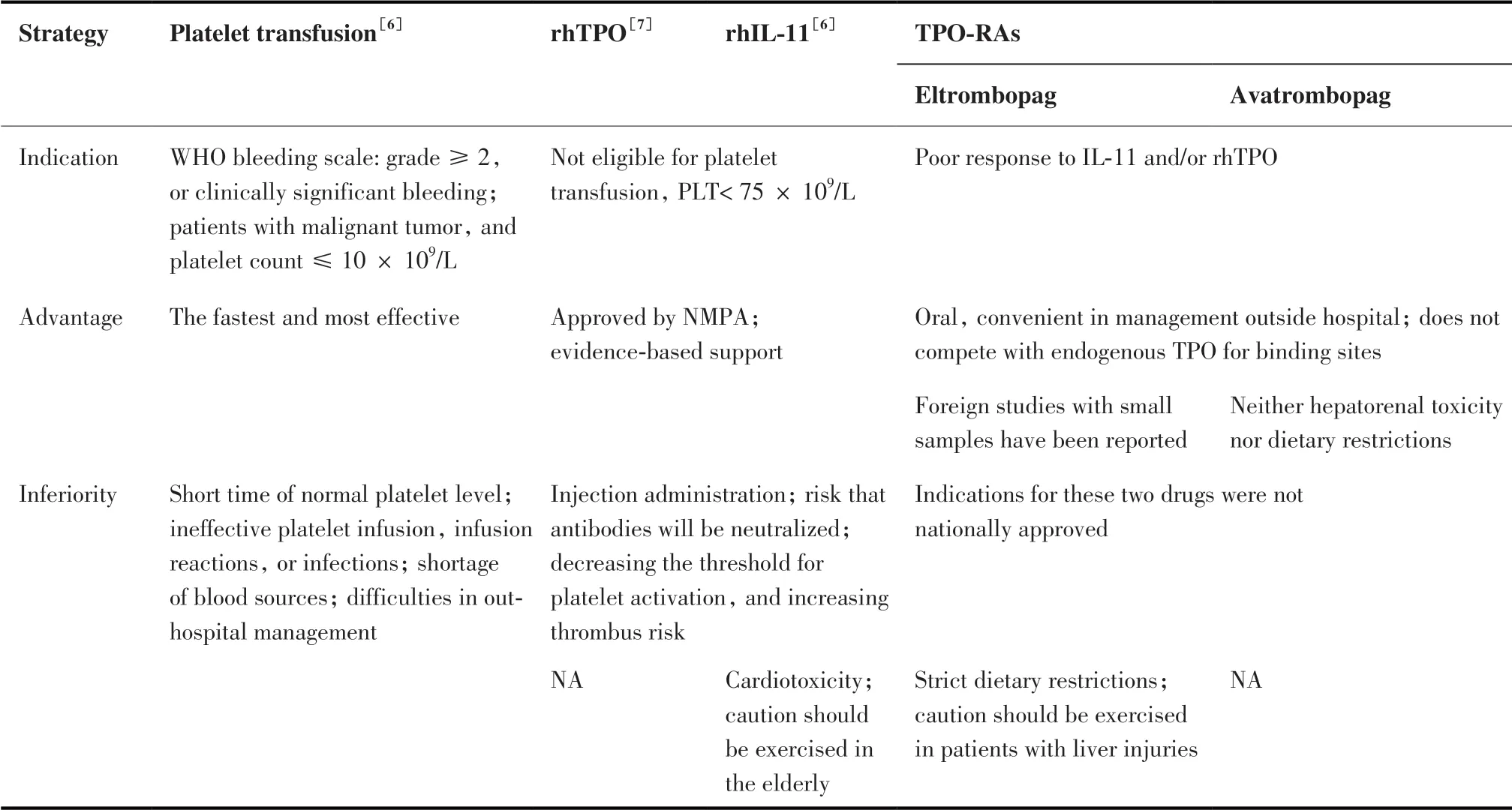
表1 CIT的4大应对措施。Table 1.Four Strategies for Managing CIT
TPO-RAs模拟内源性促血小板生成素,调节骨髓中巨核细胞增殖成熟,增加血小板产量[8-10]。国内上市的 TPO-RAs有艾曲波帕、海曲泊帕、阿伐曲泊帕和罗米司亭,但均未获批用于治疗CIT。已发表的评估TPO-RAs在CIT中疗效的临床研究较少,国外小样本研究报道罗米司亭[11-13]和艾曲波 帕[14-16]对于 CIT 有治疗作用,罗米司亭与内源性TPO竞争结合TPO受体的胞外段;艾曲波帕和阿伐曲泊帕则与内源性TPO非竞争结合,具有潜在叠加升血小板效应[17],但尚无有关于阿伐曲泊帕应用于CIT的临床研究数据。艾曲波帕是国内首个获批的口服TPO-RAs药物,适用于对糖皮质激素、免疫球蛋白或脾切除疗效不佳的免疫性血小板减少症,后被批准一线治疗重度再生障碍性贫血。专家认为对IL-11和/或rhTPO反应不佳的CIT患者可以考虑使用艾曲波帕,应用艾曲波帕1 ~ 2周即可观察到血小板计数明显提升。然而,已有充分的证据表明艾曲波帕会导致肝脏毒性,最常见的表现为转氨酶升高[3]。
阿伐曲泊帕是第二代 TPO-RAs 受体激动剂,通过激活细胞内信号系统增加血小板生成,并促进造血前体细胞产生血小板和巨核细胞[18]。它不与TPO竞争与TPO受体的结合,但与TPO在血小板生成上有叠加效应。2020年4月15日阿伐曲泊帕片在国内获批,适应症为择期行诊断性操作或者手术的成年慢性肝病患者相关的血小板减少症,但其在实体肿瘤CIT的应用较少。与艾曲波帕相比,阿伐曲泊帕优势明显。首先,阿伐曲泊帕使用期间不需要定期监测肝功能。迄今为止,在任何已发表临床研究中,都未提及接受阿伐曲泊帕治疗与肝脏毒性相关。而且,阿伐曲泊帕可以与钙、镁和铁等多价阳离子结合使用,不存在食物-药物相互作用[19]。其次,已有研究表明阿伐曲泊帕药理作用可能比艾曲波帕更强[20]。虽然二者均为口服TPO-RAs药物,目前尚无明确的机制解释二者上述差异。
本例CIT患者系卵巢癌化疗后多次血小板减少,予rhTPO、IL-11治疗后效果不佳,考虑到患者血小板水平极度低下,出血风险较高,服用艾曲波帕后转氨酶升高,在综合考虑利弊后,予改用阿伐曲泊帕治疗,血小板逐渐升至正常。且阿伐曲泊帕用药期间未出现不良反应。一直以来CIT缺乏特异、有效的治疗药物,TPO-RAs将会是重要治疗手段,避免了血小板输注面临的潜在风险,并可缓解血液制品供应紧缺问题。当一种 TPO-RAs药物产生毒性或疗效减弱时,可考虑转换到另一种TPO-RAs。本例患者可为临床医生处理实体肿瘤CIT提供一定的借鉴。
综上,阿伐曲泊帕为CIT患者提供了新的治疗选择,阿伐曲泊帕不良反应小、无肝毒性,方便口服使用,可与食物同服[19]。我们期待进一步扩大样本,完成阿伐曲泊帕治疗CIT的临床试验。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

