单侧双通道内镜术后类脊髓高压综合征1例
鲍剑航,高文硕,张良平,许锦超,张伟,潘浩
(浙江中医药大学附属杭州市中医院,浙江 杭州 310007)
单侧双通道内镜(unilateral biportal endoscopy,UBE)技术是近年来兴起的一种微创脊柱内镜技术。UBE技术与传统的脊柱微创技术相比,手术视野更加清晰、开阔,操作更加精准灵活,器械使用限制更少,可以解决单通道内镜技术在治疗中央型腰椎管狭窄症或游离型腰椎间盘突出症等复杂腰椎疾病时所面临的问题[1-2]。但随着UBE技术的推广应用,相关手术并发症也不断被报道,如硬脊膜撕裂、硬脊膜外血肿、神经根损伤等[3],但目前尚无UBE术后并发类脊髓高压综合征的报道。2021年9月,我们采用UBE技术治疗1例腰椎退行性疾病患者,术中发生硬脊膜撕裂,术后出现类脊髓高压综合征,现总结报告如下。
患者存在手术指征、无明显手术禁忌证,于全身麻醉下应用UBE行髓核摘除和椎管减压术。术中应用肌肉松弛药,控制收缩压为100 mmHg左右(1 mmHg=0.133 kPa)。采用自然重力悬吊灌注,2个3000 mL生理盐水袋以Y型管连接悬吊于手术平面上方60 cm处。C形臂X线机定位L5左侧椎弓根内缘线,并经L4棘突与椎板交接部位作水平线,以两线的交点为中心、上下相距2~3 cm分别做2个长约7 mm的切口建立观察及操作通道,依次进行软组织清理、骨性减压、黄韧带摘除、髓核摘除。在髓核摘除过程中,术者发现患者硬脊膜背侧不断渗血,影响镜下视野,仔细观察后发现硬脊膜外侧有一长约3 mm的破口[图1(4)],考虑为操作不慎造成硬脊膜撕裂,随即以明胶海绵覆盖破口止血。手术顺利完成,手术时间180 min,术中出血量约100 mL,硬脊膜撕裂后灌注时间约30 min。术中患者未出现明显的血压升高、心率和呼吸增快现象。
术后麻醉复苏过程中,患者诉头枕部疼痛,感觉昏沉、烦躁,并出现心率增快、血压升高及双下肢过伸现象;体温38.0 ℃、心率125~136次·min-1、呼吸19次·min-1、血压154/101 mmHg;双侧瞳孔等大等圆,对光反射灵敏;心肺听诊无异常;双上肢肌力Ⅳ级,双下肢肌张力增高、肌力Ⅱ级,病理反射阴性。考虑患者出现类脊髓高压综合征,随即转入ICU,给予降颅压、抗感染、消炎镇痛等对症处理。术后2 h,患者上述症状明显缓解;术后12 h,上述症状消失,肌力、肌张力恢复正常;术后2 d,患者自觉腰部疼痛及左下肢疼痛麻木情况较术前明显改善,腰椎CT[图1(5)]及MRI[图1(6)、图1(7)]未见明显异常,指导患者开始佩戴腰围下地活动,术后第6天出院;术后1个月随访,腰痛VAS评分3分、腿痛VAS评分2分,ODI 24.5%;术后3个月随访,患者腰痛和下肢麻木症状消失,腰椎MRI未见异常[图1(8)、图1(9)]。
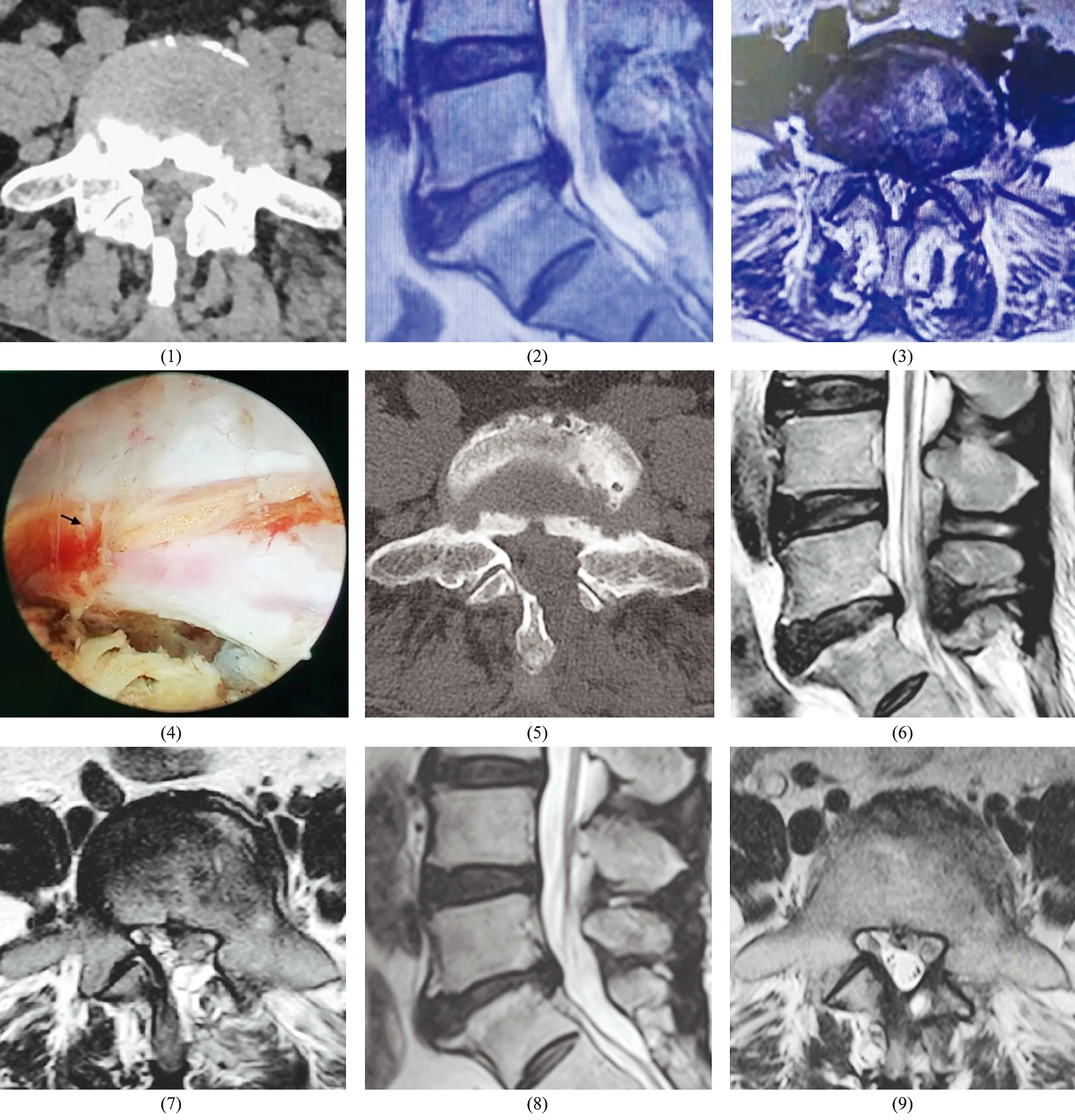
图1 L5S1椎间盘突出和椎管狭窄患者手术前后影像资料
讨 论
类脊髓高压综合征又称为类脊髓高压症,是水介质下脊柱内镜手术特有的并发症,首先由国内学者在单通道脊柱内镜手术并发症的研究中提出,但尚无明确定义[4]。通过总结文献中的相关内容,我们将类脊髓高压综合征定义为:微创脊柱内镜手术中,由于持续的水流灌注引起颅内压升高,进而引发的以颈部疼痛、僵硬为前驱症状,后续可表现为头痛、耳鸣、视觉障碍、烦躁、濒死感、癫痫等一系列神经功能障碍的综合征。
颈部疼痛、僵硬被认为是类脊髓高压综合征的前驱症状[5]。由于单通道内镜手术多在局部麻醉下进行,类脊髓高压综合征在术中即可被发现。Sairyo等[6]回顾了100例采用经皮内窥镜下腰椎间盘摘除术(percutaneous endoscopic lumbar discectomy,PELD)治疗的病例,其中2例术中出现颈部疼痛。刘雅普等[7]报道了5例PELD并发类脊髓高压综合征的病例,其中3例术中出现颈部疼痛,其余病例出现烦躁、濒死感、血压升高、肢体感觉异常和运动障碍等表现。研究表明,PELD术中出现的颈痛与硬脊膜外高压有关,是颅内压升高的一种表现,进一步发展则会出现更为严重的类脊髓高压综合征表现[5]。Choi等[8]报道了4例PELD术后发生癫痫的患者,均以术中颈部疼痛、僵硬为首发症状,其中1例出现了视觉障碍及短暂的意识丧失。Yoshinari等[9]指出,PELD时术者需重视术中发生的颈痛情况,应通过及时降低灌注压力或暂停手术来防止癫痫的发生。但UBE手术多在全身麻醉下进行,术中不能得到患者的反馈,因此类脊髓高压综合征多在术后发现。Hwa等[10]报道了58例行UBE手术的病例,3例术后出现头颈部疼痛,采取卧床休息、止痛、降颅压等方式治疗。我们发现的这1例患者,术中生命体征并未出现明显异常,麻醉复苏过程中才开始出现血压升高、心率增快等表现,考虑是由于术中全身麻醉及血压控制掩盖了患者的相关表现。
以往的研究表明,大量的灌注液进入硬脊膜外间隙,压迫硬脊膜囊,将脊髓脑脊液挤向颅内,颅内压升高是发生类脊髓高压综合征的主要原因[11-12]。Choi等[8]在手术结束后即刻对发生类脊髓高压综合征的患者行腰椎MRI检查,发现其硬脊膜囊受压迫呈“Y”形。Joh等[5]测量了28例PELD患者术中的颈部硬脊膜外压力,8例出现类脊髓高压综合征表现的患者,颈痛发生时的颈部硬脊膜外压力远高于其余患者全手术过程中的最高硬脊膜外压力。类脊髓高压综合征多发生在手术开始30 min后,其发生与以下因素有关:①灌注的时间与速度。灌注时间过长、速度过快被认为是类脊髓高压综合征的一个重要危险因素。一项动物实验表明,兔硬脊膜外压力和颅内压峰值与灌注速度呈正相关,而灌注液在兔硬脊膜外腔内的高度则与灌注时间呈正比[13]。韩鹏远等[14]研究表明,在PELD术中,当灌注液悬吊高度超过1.9 m时,类脊髓高压综合征的发生率较高,降低灌注液悬吊高度后多数不适症状可得到及时缓解。②灌注液蓄积。灌注液流出不畅导致蓄积,大量灌注液迅速充满硬脊膜外间隙,极易引发类脊髓高压综合征。Kang等[15]测量了UBE手术各个阶段的颈部硬脊膜外压力,人为堵塞出水通道后,硬脊膜外压力明显增高。Hong等[16]在UBE术中使用半套管辅助灌注液流出,测量发现使用半套管患者的平均硬脊膜外压力低于不使用半套管的患者。③硬脊膜撕裂。硬脊膜撕裂是脊柱内镜手术最常见的并发症[17],除可导致假性硬脊膜膨出和脑脊液漏外,也有引发类脊髓高压综合征的风险。多项研究发现,类脊髓高压综合征常继发于术中硬脊膜撕裂,考虑是由于灌注液经硬脊膜破口逆向灌注,导致脊髓圆锥直接受压所致[4,14,18-19]。我们认为,硬脊膜撕裂在UBE类脊髓高压综合征的发生中尤为重要。与PELD相比,UBE类脊髓高压综合征的报道较少,除麻醉方式不同的影响外,UBE独立的出水口及辅助工具的应用,使其在保持灌注通畅方面独具优势;在保持灌注液流出通畅的前提下,采用 30 mmHg 灌注泵灌注或50~60 cm悬吊自然重力灌注是相对安全的[15,20]。但当硬脊膜损伤未能及时发现或处理时,UBE术后类脊髓高压综合征的发生率便会增高。④脊柱退变程度。Choi等[8,14]认为,脊柱退变会影响颅内的顺应性。硬脊膜外空间是一个可渗漏、有流入阻力的空间,灌注液向周围组织的渗漏与椎间孔大小、周围脂肪组织密度、组织粘连有关[5]。年龄越大、脊柱退变程度越高的患者,椎管内容积相对较小,术中灌注液向周围组织的渗漏也较少,颅内顺应性较差,容易出现类脊髓高压综合征。⑤手术入路。辛志军等[21]的研究指出,相较于经椎间孔入路,经脊柱后路手术发生类脊髓高压综合征的风险更高,这可能与硬脊膜囊受压的方向有关;经脊柱后路手术时,灌注液经后方直接施压于硬脊膜囊,更易引起颅内压升高。
不严重的类脊髓高压综合征的症状多能在24 h内缓解[4,14]。UBE术中难以观察到类脊髓高压综合征的发生情况,因此采取相应手段进行预防是必要的:①完善术前筛查。患有颅内疾病的患者不适合UBE治疗。②在保持视野清晰的前提下,尽可能降低灌注压力。③提高手术操作的熟练度,积极控制术中出血,尽量缩短手术时间。④保持灌注液流出顺畅。对于肥胖或肌肉丰厚的患者,可横向切开深筋膜或应用半套管,以促进灌注液流出;避免通过堵塞出口来控制出血,以免引起颅内压升高后的代偿性血压升高,进而导致出血更甚的恶性循环。⑤术中谨慎操作,避免硬脊膜撕裂。术中一旦发生硬脊膜撕裂,应注意降低灌注压,并及时处理破口,尽快完成手术,缩短灌注时间。
总而言之,类脊髓高压综合征的发生可影响UBE技术的安全开展,尽管较为罕见但仍需引起重视。术中硬脊膜撕裂在UBE类脊髓高压综合征的发生中扮演着重要角色,早期预防、及时处理是防止出现更为严重症状的关键。目前UBE技术已在国内广泛开展,有关UBE技术灌注特点及类脊髓高压综合征发生机制的研究对UBE技术的安全开展与进一步推广具有重要价值。

