糖尿病足坏疽伴软组织感染的多学科团队协作诊疗一例
郭文城 黄加张 朱小明 张馨赟 何 敏 余 波 史伟浩
1 临床资料
患者男,78岁,因“发现血糖升高15年,右足趾破溃3个月余”入院。患者15年前被诊断为2型糖尿病,但血糖控制不理想。3个月前,患者右足第5趾于无明显诱因下出现绿豆样大小破溃伴疼痛,外院诊断为右下肢动脉粥样硬化闭塞症,行右下肢股动脉球囊扩张成形术。术后予阿司匹林肠溶片0.1 g、硫酸氢氯吡格雷片75 mg、瑞舒伐他汀钙片10 mg口服,每晚1次;替格瑞洛片90 mg口服,每日2次;贝前列腺素钠20 μg口服,每日3次。治疗后患者右足第5趾仍疼痛,破溃向趾尖延伸直至完全发黑,同时右足第3、4趾及趾间皮肤破溃,有脓性渗出液,伴右足足背红肿。外院予控制血糖,静脉注射头孢唑肟抗感染治疗,患者上述症状均无好转,且血肌酐水平升高至169 μmol/L。为求进一步诊治,于2021年4月6日就诊于复旦大学附属华山医院,门诊诊断为糖尿病足坏疽伴感染收入院。患者既往有高血压病史30年,吸烟史40余年。入院后体格检查:体温37 ℃,心率74次/min,血压128/72 mmHg(1 mmHg=0.133 kPa);身高173 cm,体重74 kg。右足背中段至远端皮肤红肿、皮温升高,左足皮温降低;双下肢胫前无水肿,双侧股动脉、腘动脉扪及搏动,双侧足背动脉及胫后动脉未扪及搏动;右足第3、4、5趾趾间皮肤破溃,见脓性渗出液,第5足趾发黑、干燥、无渗出液(图1);双足针刺痛觉减退,温度觉及震动觉缺失;双足10 g尼龙丝检查均为(+),双侧踝反射未引出。糖尿病足Wagnar分级4级。实验室检查:白细胞计数12.6×109/L,中性粒细胞百分比0.811,ESR 91 mm/h,CRP 44.17 mg/L,降钙素原0.12 ng/mL;血小板计数399×109/L,纤维蛋白原7.4 g/L、D-二聚体3.6 FEUmg/L;FBG 8.4 mmol/L,餐后2 h血糖7.7 mmol/L,HbAlc10.4%,餐后2h胰岛素6.54 mU/L,餐后2h C肽2.89 μg/L;血肌酐122 μmol/L,尿素氮12.9 mmol/L,估算肾小球滤过率(MDRD公式)53 mL/(min·1.73 m2);白蛋白35 g/L,前白蛋白167 mg/L。外周血管评估检查:踝肱指数左侧0.97,右侧0.69;下肢动脉超声示双下肢动脉硬化伴多发斑块形成,右侧胫前动脉、左侧胫后动脉闭塞可能;下肢CTA示双侧髂内动脉及股动脉管壁钙化,管腔欠规则,动脉硬化改变(图2)。骨关节评估检查:足正斜位X线摄片示右足第3远端趾间关节半脱位,双足退行性改变;右足MRI示第2至5跖趾关节周围及远端软组织肿胀,相应跖骨头水肿,考虑感染性病变(图3)。外周神经病变评估检查:肌电图示多发周围神经损害电生理表现,运动感觉神经轴索损害表现。
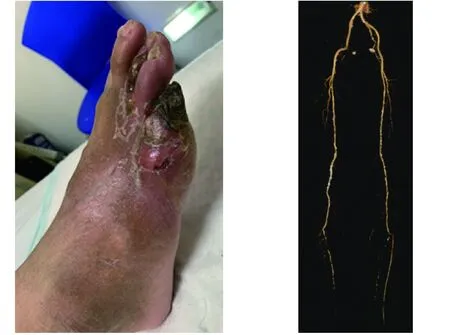
图1 患者入院当日右足外观 图2 患者下肢CTA图像
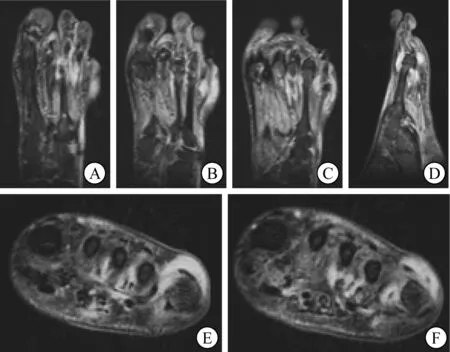
A~C 右足短反转时间反转恢复序列(STIR)示,右足第2至5跖趾关节周围及远端软组织肿胀,组织高信号,边界不清 D 右足T2脂肪抑制序列(矢状位) E、F 右足T2脂肪抑制序列(横断面)示,右足第2至5跖趾关节周围及远端软组织条索状长T2信号影,边界不清图3 右足MRI平扫图像
2 诊疗过程
2.1 第1阶段(2021年4月8日—5月16日)
2.1.1 血糖控制 糖尿病饮食,予门冬胰岛素(初始用法为7 U,三顿餐前5 min)联合甘精胰岛素(初始用法为20 U,晚9点)皮下注射。予甲钴胺0.5 mg肌内注射(1次/d)、硫辛酸600 mg静脉滴注(1次/d)、普瑞巴林75 mg口服(2次/d)治疗糖尿病周围神经病变。
2.1.2 抗血小板治疗 阿司匹林肠溶片100 mg、氯吡格雷50 mg口服,1次/d。
2.1.3 扩血管治疗 前列地尔20 mg静脉推注,1次/d。
2.1.4 抗感染治疗 经验性使用哌拉西林他唑巴坦4.5 g静脉滴注,1次/8 h。
2.1.5 创面处理 2021年4月20日由足踝外科医师对患者行清创、经跖骨截趾术,但创面愈合不佳(图4)。遂组织内分泌科、感染科、血管外科、足踝外科、营养科医师进行病例讨论,结合患者的临床症状、体征、实验室和影像学检查结果制订治疗方案。
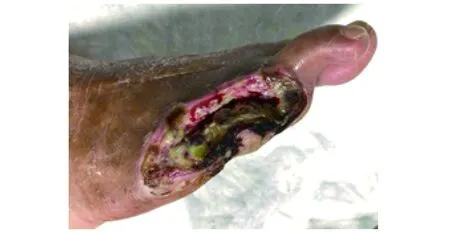
图4 第1次清创术后创面愈合不佳
2.2 MDT病例讨论
2.2.1 内分泌科 血糖控制目标:空腹或餐前血糖6.1~7.8 mmol/L,餐后2 h或随机血糖7.8~10.0 mmol/L,围手术期血糖≤12.0 mmol/L。考虑患者为肾功能不全,急性肾损伤可能,CKD 3期可能;BMI 24.73 kg/m2,糖尿病足伴软组织感染。建议予超短效结合长效胰岛素治疗,该方案起效快、调整灵活,血糖控制效果好。
2.2.2 感染科 先予经验性用药,遵循足量、足疗程、广谱的原则,在完善病原学检查后,尽快予以抗感染治疗。青霉素皮试阴性,选择可同时覆盖革兰阳性菌与革兰阴性菌的哌拉西林他唑巴坦静脉注射抗感染治疗(初始剂量为4.5 g/8 h)。期间,反复留取病原学标本,行药物敏感(简称药敏)试验,根据病原学检查结果及抗感染药物的疗效、不良反应,动态调整抗感染治疗方案。患者的尿常规、肺部CT、心脏超声检查均未提示其他合并感染,无发热、寒战,降钙素原水平升高不明显,无血行感染征象,可暂缓行血培养。患者首次创面细菌培养提示耐甲氧西林金黄色葡萄球菌(MRSA,+)、铜绿假单胞菌(+++)。入院当天估算肾小球滤过率为53 mL/(min·1.73m2),提示肾功能异常且存在继续加重可能,入院后第3天估算肾小球滤过率为48.9 mL/(min·1.73m2),选择利奈唑胺600 mg/12 h静脉注射抗感染治疗,减少哌拉西林他唑巴坦用量至4.5 g/12 h。利奈唑胺治疗后21 d,患者血小板计数、血红蛋白水平进行性下降,考虑为药物导致的骨髓抑制可能,术中创面培养未见MRSA,故停用利奈唑胺。予哌拉西林他唑巴坦4.5 g/8 h静脉注射抗感染治疗。尽早对组织感染区域进行清创。
2.2.3 血管外科 患者右下肢股动脉成形术后12周,缺血症状进行性加重,右第5足趾呈缺血性坏死,右第3、4足趾静息痛。下肢CTA见右侧股动脉基本通畅伴多发硬化斑块,胫前动脉、胫后动脉、腓动脉均闭塞。左下肢踝肱指数正常,右下肢为0.69。对于慢性下肢缺血的患者需开通至少1根膝下动脉作为流出道血管,以促进缺血性溃疡创面愈合。根据Angiosome理论,膝下血管分支中胫前动脉、胫后动脉的血流直达足部;而腓动脉的血流直接供应足跟及外踝,对足趾的血供少[1]。因此,首选开通胫前动脉或胫后动脉作为直接流出道血管。
2.2.4 足踝外科 患者MRI示第3至5跖趾关节周围感染,第5跖骨头骨髓炎不除外,第5足趾坏疽。予全身抗感染及局部创面处理后11 d,右足感染症状明显改善,但右足第3、4、5趾趾间皮肤破溃伴渗出液,第5足趾坏疽,故行右足第3、4、5趾清创、经跖骨截趾术的指征明确。术中见创面血供差,术后创面恢复不佳,肉芽组织缺乏血供。术后第21天,右下肢膝上、膝下经皮氧分压分别为36、2 mmHg,提示膝下血供差,需先改善膝下血流,以提高再次清创后踝上保肢术的成功率,促进创面愈合。
2.2.5 营养科 患者身高173 cm,半年前体重80 kg,现74 kg。入院后,予糖尿病饮食,每日摄入热量5 857.6 kJ,诉治疗餐中除蔬菜剩余量约1/3,主食及荤菜全部吃完。询问饮食史,诉家中进餐规律,早餐以麦片和粥为主,偶有蛋类和奶类;午餐及晚餐荤菜较多,烹调油较多,主食量较住院期间少。体格检查可见双下肢无水肿,右下肢肌肉消耗明显。诊断为蛋白质营养不良。建议增加蛋白质摄入。
2.3 第2阶段(2021年5月17日—6月3日)
2.3.1 血管外科行下肢动脉腔内开通术 患者于2021年5月17日行右下肢动脉腔内开通术。采用Seldinger法穿刺左侧股动脉,置入6F短鞘。行右下肢动脉造影示:右侧股浅动脉、腘动脉多发硬化斑块,管腔轻度狭窄;右侧胫前动脉、胫腓干、胫后动脉及腓动脉长段闭塞;侧支供血胫前动脉中下段,并向腓动脉、胫后动脉形成侧支,为右足供血;右足血供差(图5A、5B)。以普通肝素5 000 U肝素化,术中每小时追加1 000 U。应用MPA导管,配合Super Stiff导丝、V18导丝、Treasure12导丝、Astato 30导丝,顺向递进,开通右侧胫前动脉至足背动脉,先后以2~150、2.5~150 mm Pacific球囊导管扩张成形。尝试开通右侧腓动脉或胫后动脉未成功。复查右下肢动脉造影示:右侧胫前动脉至足背动脉成形良好,右足血供改善明显(图5C、5D)。手术时长130 min。术后予阿司匹林肠溶片100 mg口服(1次/d)联合那屈肝素钙4 100 U/12 h皮下注射。
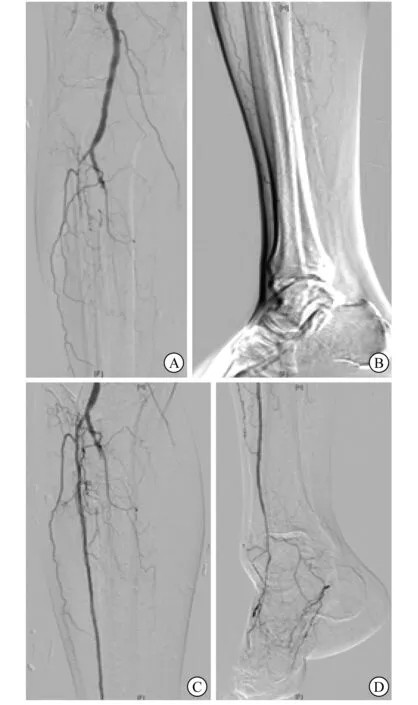
A、B 右侧胫前动脉﹑胫腓干、胫后动脉及腓动脉长段闭塞;侧支供血胫前动脉中下段,并向腓动脉、胫后动脉形成侧支,供应右足;右足血供差 C、D 右侧胫前动脉至足背动脉成形良好,右足血供改善明显图5 术中动脉造影图像
2.3.2 足踝外科再行清创术 患者于2021年5月25日再行清创术。取平卧位,全身麻醉后以咬骨钳及摆锯在第1次清创后的创面上去除部分第3、4、5跖骨干,清理周围坏死筋膜,填塞碘仿纱条(图6),间断缝合后加压包扎。手术时长30 min。
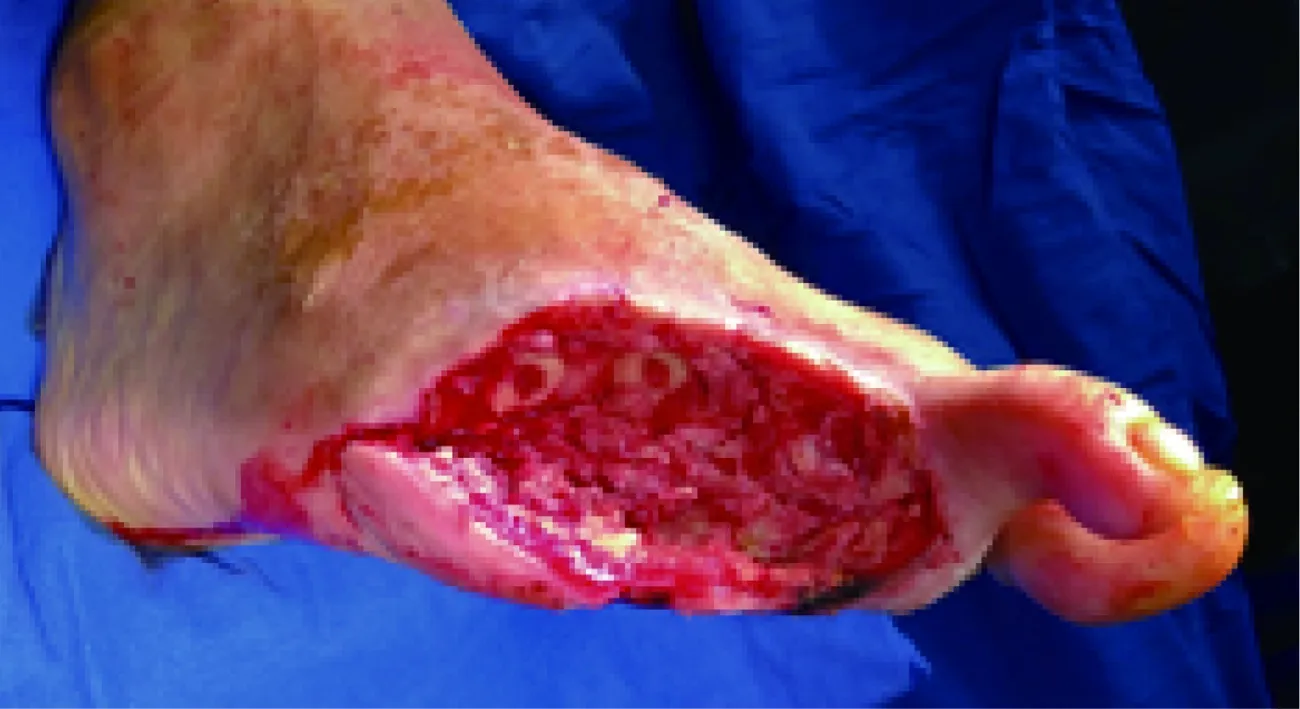
图6 第2次清创术后即刻创面
2.3.3 抗感染治疗 根据病原学检查结果及肾功能情况调整抗感染药物的剂量。2021年5月10日创面培养结果示铜绿假单胞菌(+),药敏试验对哌拉西林他唑巴坦敏感,继续使用直至感染症状缓解,治疗过程中密切监测,无药物不良反应发生。
2.3.4 控制血糖 继续监测血糖4次/d。予门冬胰岛素三餐前5 min(早餐前12 U、中餐前16 U、晚餐前12 U)皮下注射,甘精胰岛素晚9点20 U皮下注射,并根据指末血糖水平,调整胰岛素剂量。
2.3.5 改善营养 给予低盐糖尿病饮食,每日摄入热量为5 020.8 kJ。增加口服营养强化优质蛋白质摄入:口服20%糖尿病型肠内营养液200 mL,2次/d(该营养液每500 mL的总热量为1 774.0 kJ,其中蛋白质21.2 g、脂肪15.4 g、碳水化合物55.9 g);尽量吃完发放餐食中的蔬菜;根据患者肾功能情况,控制蛋白质摄入量≤45 g/d、盐摄入量4 g/d。
2.3.6 围手术期肾功能的监测及保护 患者右下肢动脉腔内开通术前后,均予以水化及碱化尿液保护肾脏。右下肢动脉腔内开通术后3 d,患者血肌酐下降至106 μmol/L,估算肾小球滤过率(MDRD公式)62.3 mL/(min·1.73m2)。
2.3.7 住院期间镇痛 患者因右足夜间疼痛加重,影响睡眠,于入院当天起予艾司唑仑1 mg每晚口服,若自我疼痛评分(NRS评分)≥5分,给予依托考昔60 mg口服镇痛。两次清创术后当日及第2天,均予氟比洛芬100 mg(1次/d)静脉注射镇痛。经上述治疗后患者疼痛缓解,不影响夜间睡眠。
3 术后转归
患者术后创面无感染征象及创面培养阳性病原学依据,血肌酐71 μmol/L,无需服用镇痛药物及助眠药物,于2021年6月3日(第2次清创术后的第9日)出院,共住院55 d,住院总费用为168 180.12元。出院后门诊定期随访,由专职护士负责换药;第2次右足清创术后第235天,患者右足创面已完全愈合,痂皮基本脱落(图7)。
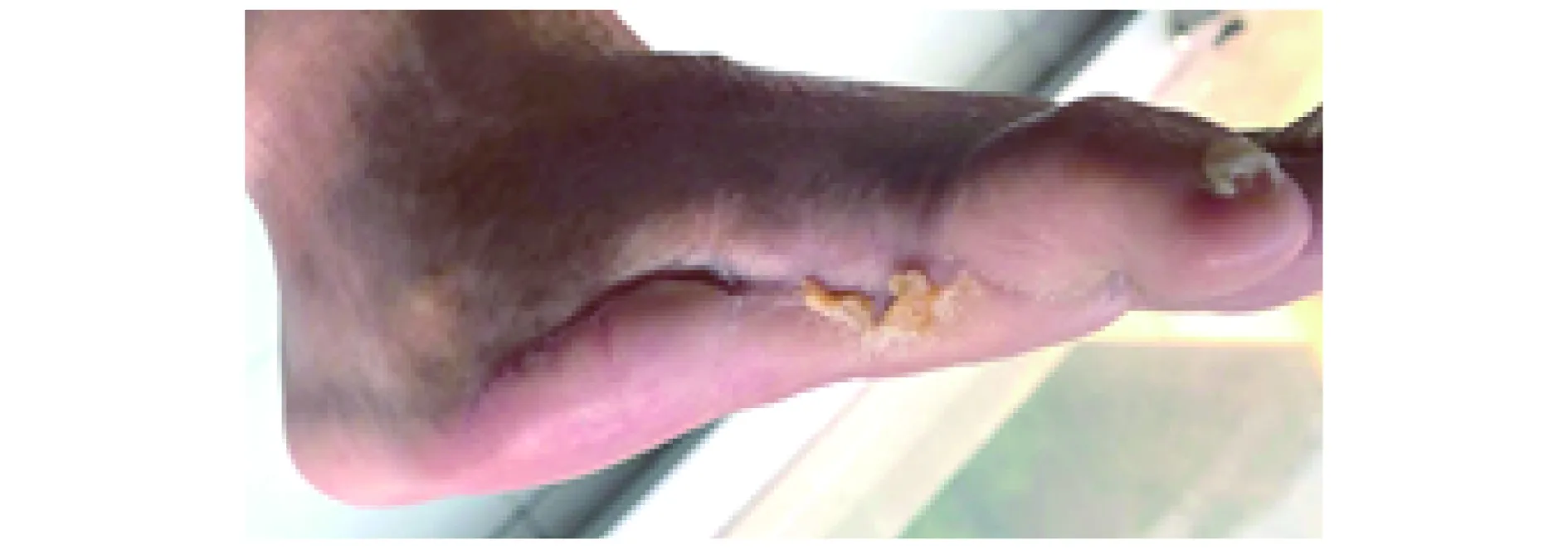
图7 第2次清创术后第235天创面愈合
4 讨 论
本例患者病情复杂,住院时间长,经2个阶段的多学科共同诊疗,期间共经历3次手术。第1阶段治疗时间38 d,清创前抗感染期11 d,第1次清创后创面缺血未愈合住院等待27 d;第2阶段治疗时间17 d,其中右下肢动脉腔内开通术后至第2次清创间隔时间8 d,第2次清创术后至出院历时9 d。复旦大学附属华山医院有MDT诊疗团队及糖尿病足专科病房,可予以足够的空间和条件进行连续的病情观察和治疗。患者自足趾溃疡发病至最后行清创、截趾术,以及创面愈合的治疗过程曲折,可见我国糖尿病足静息痛甚至肢体坏死患者的治疗中存在一些难点。
4.1 抗感染药物的选择 患者入院前已有右第5足趾溃疡,周围足背红肿,第2、3、4趾趾间皮肤破溃伴脓性渗出,外院予头孢唑肟静脉注射后无明显好转。根据《热病-桑福德抗微生物治疗指南(第48版)》(简称《指南》),引起糖尿病溃疡感染的常见病原体以金黄色葡萄球菌(应假定为MRSA)、无乳链球菌(B族)和化脓性链球菌为主;引起中度感染致骨髓炎的病原体可能包括大肠杆菌类、厌氧菌类等。应当根据感染严重程度来选择抗感染药物,在留取病原学标本后尽早给予经验性用药。头孢唑肟为第3代头孢菌素,可覆盖革兰阴性菌及革兰阳性菌,对革兰阴性菌的抗感染作用强,但对革兰阳性菌的抗感染作用不如第1代和部分第2代头孢菌素,且对粪链球菌、MRSA无效。因此,本例患者经头孢唑肟抗感染治疗后效果欠佳。患者入院时无病原学检查结果,MRI提示可能合并骨髓炎,根据《指南》推荐,应予以氨苄西林-舒巴坦或哌拉西林他唑巴坦或厄他培南及其他碳青霉烯类药物治疗,同时联合万古霉素或达托霉素或利奈唑胺抗MRSA治疗。因此,在完善病原学检查后,先予患者哌拉西林他唑巴坦静脉注射抗感染治疗;当病原学检查结果提示MRSA及铜绿假单胞菌阳性后,加用利奈唑胺静脉注射抗感染治疗。《指南》也指出,除非病情紧急应避免经验性使用抗MRSA药物,建议细菌培养结果以骨活组织检查(简称活检)为准,因其结果往往与溃疡拭子培养结果不符。本例患者第1次清创术中发现深部软组织感染,诊断骨髓炎的依据不足,且术中病原学检查未发现MRSA,仅铜绿假单胞菌(+);术后患者发生利奈唑胺相关骨髓抑制,故停用利奈唑胺,且未再继续抗MRSA治疗。铜绿假单胞菌是糖尿病足溃疡感染最常见的革兰阴性菌之一,近5年来假单胞菌属对于氨苄西林、头孢曲松、头孢西丁、替加环素等高度耐药,对环丙沙星及亚胺培南的耐药率亦逐渐上升,对哌拉西林、头孢吡肟、哌拉西林他唑巴坦、丁胺卡那霉素的敏感性较高[2]。因此,在完善病原学检查后,应尽早经验性使用针对糖尿病引起感染的常见病原体的广谱抗感染药物,积极监测全身感染相关指标(如血常规、CRP、降钙素原等),并行深部组织或骨活检细菌培养及药敏试验,以利于给予患者早期、准确、有效的抗感染治疗,避免脓毒血症发生,降低死亡率。
4.2 膝下流出道动脉直接开通的必要性及干预方案的选择 患者于外院诊断为右下肢动脉粥样硬化闭塞症,行右下肢股动脉球囊扩张成形术,手术具体情况不详,故无法了解术中治疗方案的合理性及可行性。术后同时予阿司匹林、氯吡格雷、替格瑞洛抗血小板治疗,在确保药物治疗充分的情况下,右下肢缺血仍进一步加重并致足趾缺血、坏死,继发感染。因此,此次入院的首要治疗目标为尽可能地改善缺血区域的血供,挽救肢体,避免大截肢。
根据Angiosome理论,第3至5足趾由胫前动脉发出的足背动脉和足底动脉弓供应足背面血流,由胫后动脉发出的足底外侧动脉供应足底面血流[1]。对于糖尿病足重度缺血但无感染的患者,靶血管区血流的直接开通与间接开通后保肢率和死亡等主要不良事件发生率的差异均无统计学意义[3];但对于糖尿病足合并溃疡的患者,行靶血管区直接开通术后创面愈合时间和保肢率均优于存在侧支的间接开通术和无侧支的间接开通术[4]。当糖尿病足创面感染且CRP>30 mg/L的患者,靶血管区血流的间接开通,通常无法降低大截肢及再行血管腔内开通术的概率,风险比高达2.17(95%CI为1.54~3.06),而靶血管区域血流的直接开通可将风险比降至0.88(95%CI为0.67~1.15)[4]。本例患者入院时CRP为44.17 mg/L,因此靶血管区血流的直接开通,重建胫前动脉、胫后动脉对其预后尤为关键。由于膝下动脉开通,球囊扩张术后3个月再狭窄率为70%,1年内再干预率为40%[5],缺血区域血供可能在腔内开通术后3个月后再次逐渐减少,故应尽可能增加靶血管区直接供血的动脉数量,更有利于创面的愈合。因此,本例患者在足趾未坏死前,仅改善其近心端股动脉流入道的血流是不够的,膝下3支动脉的开通,尤其是踝下足背动脉和胫后动脉分支的开通,才是确保术后短期内不再发生缺血的关键,从而避免大截肢。
开通膝下流出道动脉的手术方式有血管腔内治疗及动脉旁路移植术。动脉旁路移植术可改善流入道血流,但无法同期评估和改善流出道血流;血管腔内治疗则通过各类不同的操作技巧及不断革新的器械,使其保肢率与动脉旁路移植术基本相同,且手术微创,是目前首选的膝下动脉治疗方案[6]。
由于膝下动脉病变的病理不同于膝上动脉,75%的重度狭窄由致密的钙化斑块引起[7],应用普通球囊扩张膝下动脉后,15 min弹性回缩率高达97%,且严重钙化斑块会导致球囊扩张术中血管破裂,影响载药球囊的药物吸收[8]。有研究[9]结果表明,严重钙化病变使患者死亡率增高1.5倍,截肢率增高5倍。目前临床常用的膝下动脉减容装置,如定向斑块旋切系统、震波系统可更好地去除严重钙化的病变,改善血管顺应性,减少夹层形成,并利于载药系统的药物吸收。随着医疗技术的发展,对于术后弹性回缩尚无持续可控径向力支撑的治疗方法,用于膝下短病变的载药支架和可降解支架正在临床试验中。载药支架、裸支架植入联合单纯球囊扩张、载药支架植入联合载药球囊扩张的对照研究[10]结果显示,载药支架植入术后12个月的通畅率约为80%,裸支架植入联合单纯球囊扩张术后仅约50%;对于短段病变的治疗,载药支架植入术后再狭窄率(28%)低于单纯载药球囊(58%)。
膝下动脉病变往往为长段、多节段病变,开通的技术难度高,失败率高。本例患者膝下3支流出道动脉虽未见严重的钙化病变,但均为长段闭塞性改变,且踝部、足部的血管床不显影,无法从足背动脉或远端侧支动脉逆行穿刺,只能采取顺行逐步递进的方法,方才成功开通胫前动脉。为避免形成动脉夹层,术中选用直径为2.0 mm的Pacific球囊进行血管开通。普通球囊扩张术后动脉内膜增生,开通血管的短期内再狭窄率高;经典的血管内膜增生抑制剂紫杉醇,以及他克莫司、西罗莫司等具有免疫抑制作用的新型大环内酯类衍生物,可通过与不同的载药微球结合,在载药球囊扩张时渗入管壁,从而起到抑制动脉内膜增生的作用,延缓动脉再狭窄发生。已有临床研究[11-12]结果表明,使用载药球囊扩张的患者膝下动脉的血管通畅率、再狭窄率均低于不使用载药球囊扩张患者,而载药支架植入的效果较载药球囊扩张更好。本例患者术中仅使用普通球囊扩张膝下动脉,势必引起管壁内膜增生,术后发生血管再狭窄在所难免,影响了术后创面的血供,导致创面愈合延迟。
因此,联合血管腔内治疗的各类手术技巧和新型器械,提高了糖尿病膝下动脉开通的成功率及通畅率,对于糖尿病足群体的保肢意义重大。
4.3 糖尿病足骨科干预的多样性及瓶颈 综合本例患者的心理、足趾坏疽周围组织感染控制情况,以及血管外科手术评定等结果,对其进行两次足趾清创、经跖骨截趾术。由于第1次清创术前患者感染得到充分控制,且术中完整切除感染的关节周围组织,创面相对较小,无需持续引流,故未使用抗生素骨水泥和负压吸引装置。近年来,国内逐渐开展的胫骨横向骨膜搬运技术,通过骨搬运,予以活体组织稳定且持续的牵拉力,刺激病灶部位的细胞活跃生长,改善膝下侧支血管网,达到间接增加血供的目的[13]。由于胫骨横向骨膜搬运技术存在创伤性,可增加感染发生风险,并存在骨不连等致残风险,住院时间较长,故复旦大学附属华山医院暂未尝试开展此项技术。目前,临床使用的新型骨膜牵张可吸收装置已见报道[14],该技术在尝试刺激膝下侧支血供丰富的同时,减少骨创伤,并避免了行二次取出装置手术。血运重建包括流入道血流改善和流出道血流改善,单一的骨科手术无法同时满足,故不能根本性改变糖尿病足的疾病进展,以及骨科手术本身因血运不佳导致的并发症发生。本例患者经历两次清创及经跖骨截趾手术,清除感染组织,缩小了缺血区域,为足部创面的愈合提供条件,同时尽可能地保留了肢体功能。
4.4 糖尿病足的营养不良亟须改善 本例患者身高173 cm,体重74 kg、BMI 24.73 kg/m2、腰围75 cm,白蛋白(35 g/L)和前白蛋白(165 mg/L)接近或低于正常值下限。Lauwers等[15]的综述提示,大量糖尿病足溃疡患者存在营养不良的风险(49%~70%)或营养不良状态(15%~62%),其中营养状况与糖尿病足的严重程度相关。在亚洲人群的报道中,营养状态是膝上截肢率、死亡率的独立影响因素[16]。因此,临床医师应注意糖尿病足患者的营养状况。由于较多糖尿病足营养不良患者的BMI正常或提示超重,故BMI并不能准确反映其营养状况。此外,白蛋白水平也不是一种可靠的营养不良筛查方法,更多的是作为反映预后的标志。较为可靠的营养不良评估方案是主观营养评估及国际糖尿病联合会推荐的微型营养评价,而2018年的全球领导人营养不良倡议(GLIM)的标准中,增加了评估肌肉量的减少,以避免仅参考BMI造成的偏差。因此,当患者发生糖尿病足溃疡后,应联合营养科进行准确的营养状况评估,制订饮食摄入方案,并根据合并症情况调整,为患者的康复奠定营养基础。
4.6 糖尿病足医疗效益 糖尿病足具有住院时间长、治疗难、费用高等特点。发达国家糖尿病足的治疗占用12%~15%糖尿病医疗卫生资源,发展中国家更是达到40%[18]。2017年全球糖尿病治疗费用已达7 270亿美元,我国为1 100亿美元[18]。我国2004年多中心调查提示,糖尿病足溃疡患者的平均住院天数为25 d,均次总费用为14 906元;2012年日均住院费用增至955元,平均住院天数缩短至18 d。林钊钒[19]报道,患者Wagnar分级增高伴随住院费用增多,行二次及多次截肢及死亡患者的住院时间延长及住院费用增多。但较多报道无法涵盖该类人群多次出入同一医院不同科室,或辗转于不同医院的实际全疗程的住院时间及住院费用。黄燕[20]报道,糖尿病足溃疡患者出院时创面愈合率仅24.3%,有超过75%的患者出院后仍需继续就医。虽然本例患者住院时间长、治疗总费用高及诊疗人力消耗大,但根据模型推测,MDT诊疗对糖尿病足患者有益,5年内截肢率可降低24.2%[20]。因此,MDT的诊疗模式有利于对患者进行全方位安全、有效地治疗,提高其生存质量,减轻其家庭及社会的各方面负担。
综上所述,以充分的营养指导管理为基石,加强血糖等相关的代谢管理,围手术期加强心、肾等重要脏器的合并症监测和治疗,并持续配备专业的创面管理团队对糖尿病足溃疡进行观察及换药,予规范、充分的抗感染治疗及局部清创,尽可能改善溃疡区域血供,合理并规范镇痛,将是我国糖尿病足溃疡较为理想的管理模式。而多学科综合诊治糖尿病足也将为患者更快、更好地恢复,做出最大的贡献。

