CTP介导的EGFRvⅢ肽疫苗诱导特异性免疫应答抑制脑胶质瘤的研究①
许琼冠 欧阳一彬 谢镇明(海南医学院第二附属医院神经外科二区,海口 571103)
胶质瘤是脑内最常见原发性肿瘤,占中枢神经系统恶性肿瘤的81%[1-2]。根据世界卫生组织分类,胶质瘤分为4级,其中1级和2级为低级别胶质瘤,3级和4级为高级别胶质瘤,通常分级越高,预后越差。低级别胶质瘤的十年生存率为47%,中位生存期为11.6年。对于高级别胶质瘤,3级胶质瘤患者中位总生存期(overall survival,OS)约为3年,而4级胶质瘤患者中位OS时间仅为15个月[3-5]。尽管过去几十年已开发了多种癌症疗法,但很少有药物被批准用于胶质瘤治疗。
EGFRvⅢ(EGFR variantⅢ)是过表达的EGFR基因最常见选择性剪接形式之一,在胶质母细胞瘤中表达率为15%~40%[6-7]。EGFRvⅢ突变是从外显子2到7的选择性剪接,导致胞外区6~273个氨基酸残基缺失,并在融合连接处插入了1个新的甘氨酸,形成1个新的表位[8]。KLH与EGFRvⅢ新抗原的偶联物命名为Rindopepimut(CDX-110),已进入Ⅲ期临床试验,作为晚期多形性胶质母细胞瘤的治疗性疫苗[9]。因此,直接基于新抗原表位的多肽疫苗是治疗胶质瘤的一种有吸引力的方案。但有研究报道,单肽免疫可能导致免疫耐受,而非激活抗肿瘤免疫应答[10]。为克服多肽疫苗免疫耐受,增强其免疫原性,在临床前和临床试验中已对多种新抗原负载工具(如脂质体和纳米载体)进行了评估[11-12]。但这些尝试均基于内吞依赖途径,限制了抗原提呈细胞对新抗原的交叉呈递作用[13]。胞浆转导肽(cytosolic transduction peptide,CTP)是一种11肽,可直接定位于胞浆[14]。研究表明,CTP-β-GAL融合蛋白在脾脏和淋巴结等免疫器官中有较高聚集趋势,特异性分布于脾脏滤泡和边缘区,提示CTP融合蛋白可能对包括抗原提呈细胞在内的血细胞具有较高亲和性[15]。本研究拟探索CTP修饰的EGFRvⅢ多肽疫苗是否可激活体内抗肿瘤免疫应答,从而抑制胶质瘤生长。
1 材料与方法
1.1 材料
1.1.1 组织来源16例脑胶质瘤患者癌旁组织及35例肿瘤组织取自海南医学院第二附属医院,所有组织获取经海南医学院第二附属医院伦理委员会批准,患者知情同意。患者生存数据由海南医学院第二附属医院对患者进行跟踪随访获得。
1.1.2 主要试剂GL261-Luc细胞系购自北京科瑞思搏生物科技有限公司;脾淋巴细胞分离试剂盒购自TBD公司;CD8+T淋巴细胞分离试剂盒购自德国Miltenyi公司;GM-CSF、IL-4、IL-2购自美国R&D Systems;β-巯基乙醇购自美国Sigma公司;TRIzol试剂购自生工生物工程有限公司;SYBR1 Green PCR kits购自日本TaKaRa公司;TUNEL凋亡试剂盒购自上海翌圣生物科技有限公司;抗CD8抗体购自美国eBioscience公司;抗CD-69流式抗体购自美国Biolegend公司;抗CD3免疫组化抗体购自美国Abcam公司;CFSE染色试剂购自美国Thermo Fisher公司。
1.1.3 实验动物8周龄雌性BALB/c小鼠购自海南医学院实验动物中心,动物合格证号:20200501 BZX300108。所有动物实验经海南医学院第二附属医院伦理委员会批准。
1.2 方法
1.2.1 细胞培养GL261-Luc细胞系采用含10%FBS的DMEM培养基于37℃、5%CO2培养;6~8周龄雄性BALB/c小鼠骨髓细胞加入GM-CSF(10 ng/ml)和IL-4(5 ng/ml)使其培养分化为树突状细胞(dendritic cells,DCs),脾淋巴细胞分离试剂盒分离淋巴细胞,按照说明书采用CD8+T淋巴细胞分离试剂盒对CD8+T淋巴细胞进行磁分离。分离的CD8+T淋巴细胞在添加10%FBS、IL-2(10 ng/ml)和β-巯基乙醇(50µmol/L)的RPMI1640培养液中培养。
1.2.2 qPCR检测胶质瘤患者肿瘤和癌旁组织EGFR表达TRIzol试剂提取患者组织总RNA,逆转录试剂盒合成cDNA,并以此为模板进行qPCR检测。PCR引物序列为EGFR F:5'-TCCTTGGGAATTTGGAAATT-3',R:5'-GGCATAGGAATTTTCGTAGTACAT-3';EGFRvⅢF:5'-GTATTGATCGGGAGAGCCG-3',R:5'-GTGGAGATCGCCACTGATG-3';β-actin F:5'-CAAGAGATGGCCACGGCTGCT-3',R:5'-TCCTTCTGCATCCTGTCGGCA-3'。反应条件为94℃预变性1 min,95℃变性5 s,60℃复性30 s,72℃延伸60 s,共38个 循 环。2-ΔΔCt计 算EGFR和EGFRvⅢmRNA相对表达。
1.2.3 多肽疫苗制备CTP原始序列为YGRRARRRRRR。为提高CTP溶解度,采用G代替最初的Y,CTP最终序列为GGRRARRRRRRRK。EGFRvⅢ突变肽V2序列为LEEKKGNYVVTDH。FITC通过ACP接头置于偶联肽N-末端。所有肽由上海吉尔多肽有限公司合成,经高效液相色谱柱纯化得到纯度>95%的多肽。
1.2.4 荧光显微镜观察CTP-V2胞质定位情况提前12 h在24孔板中接种5×104个DCs,用不同浓度FITC标记的多肽处理DCs,孵育时间分别为15 min、30 min和60 min。孵育结束后,PBS缓冲液冲洗3次,荧光显微镜观察。
1.2.5 流式细胞术检测负载多肽疫苗的DCs对CD8+T细胞的激活T细胞增殖实验:采用1µmol/L CFSE与CD8+T细胞37℃孵育15 min,标记CD8+T细胞。将负载多肽疫苗的DCs作为靶细胞,与CFSE标记的CD8+T细胞按2∶1效靶比孵育3 d,收集细胞,抗CD8抗体染色,流式细胞仪检测CFSE稀释度。T细胞激活标志物CD69检测:将负载多肽疫苗的DCs作为靶细胞,与CD8+T细胞按2∶1效靶比孵育24 h,收集细胞,抗CD8及抗CD69抗体染色,流式细胞仪检测CD69表达。
1.2.6 多肽疫苗的体内抑瘤实验 小鼠皮下注射1×105个GL261-Luc细胞,待肿瘤长至80 mm3时随机分为4组进行实验,每组5只。每7 d瘤周注射20 mg/kg多肽疫苗,每5 d测量肿瘤体积,第25天对小鼠肿瘤进行活体成像,处死小鼠后称量肿瘤质量。小鼠肿瘤体积=1/2长×宽2。
1.2.7 免疫组织化学检测肿瘤组织CD3+T细胞浸润 小鼠肿瘤组织经甲醛固定,梯度乙醇脱水及石蜡包埋后,切片(5µm),脱蜡水合,柠檬酸钠缓冲液进行抗原修复,5%山羊血清室温封闭1 h,加入抗CD3抗体(1∶100)4℃孵育过夜,加入山羊抗兔二抗(1∶1 000)室温孵育1 h,DAB显色5 min,苏木精复染,显微镜下观察,Image Pro Plus软件对阳性细胞数进行定量分析。
1.3 统计学分析 采用SPSS19.0软件进行统计学处理。计量数据采用±s表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 EGFRvⅢ是脑胶质瘤的肿瘤标志物及预后指标qRT-PCR检测脑胶质瘤患者肿瘤和癌旁组织总EGFR mRNA表达,结果表明:肿瘤组织EGFR mRNA水平显著高于癌旁组织(图1A,P<0.001)。此外,EGFRvⅢ和野生型EGFR在脑胶质瘤组织中的表达呈正相关(R=0.58,图1B)。脑胶质瘤患者生存分析表明,EGFRvⅢ过表达或EGFR和EGFRvⅢ同时过表达显示不良预后(图1C)。
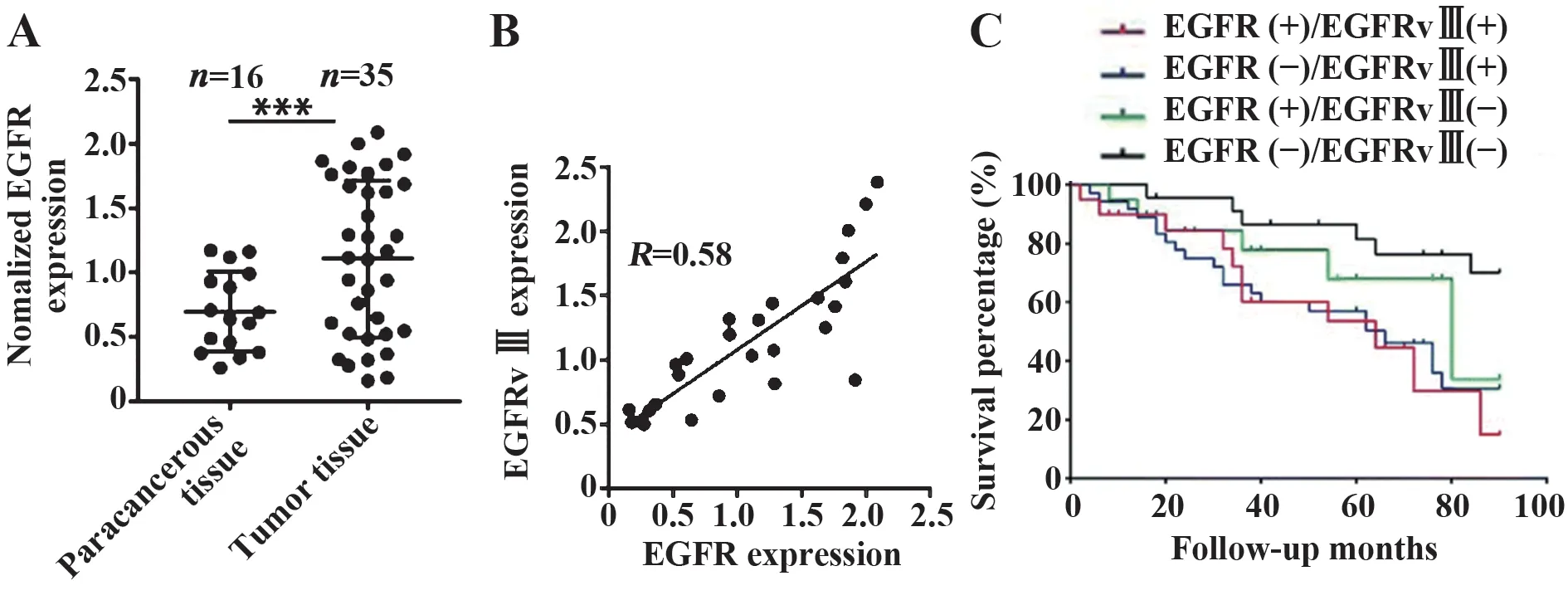
图1 EGFRvⅢ是胶质瘤的肿瘤标志物和预后指标Fig.1 EGFRvⅢis a tumor marker and prognostic indicator of glioma
2.2 CTP融合多肽可有效定位于DCs细胞质EGFRvⅢ是EGFR胞外区缺失突变体,在N端6~273个氨基酸处形成1个新的LEEKKGNYVVTDH(V2)表位(图2A)。将CTP与突变肽V2进行偶联,分析CTP-V2偶联肽是否具有胞质定位功能,倒置荧光显微镜结果表明,以10 mol/L CTP-V2与DCs共孵育30 min,转导效率最高(图2D)。
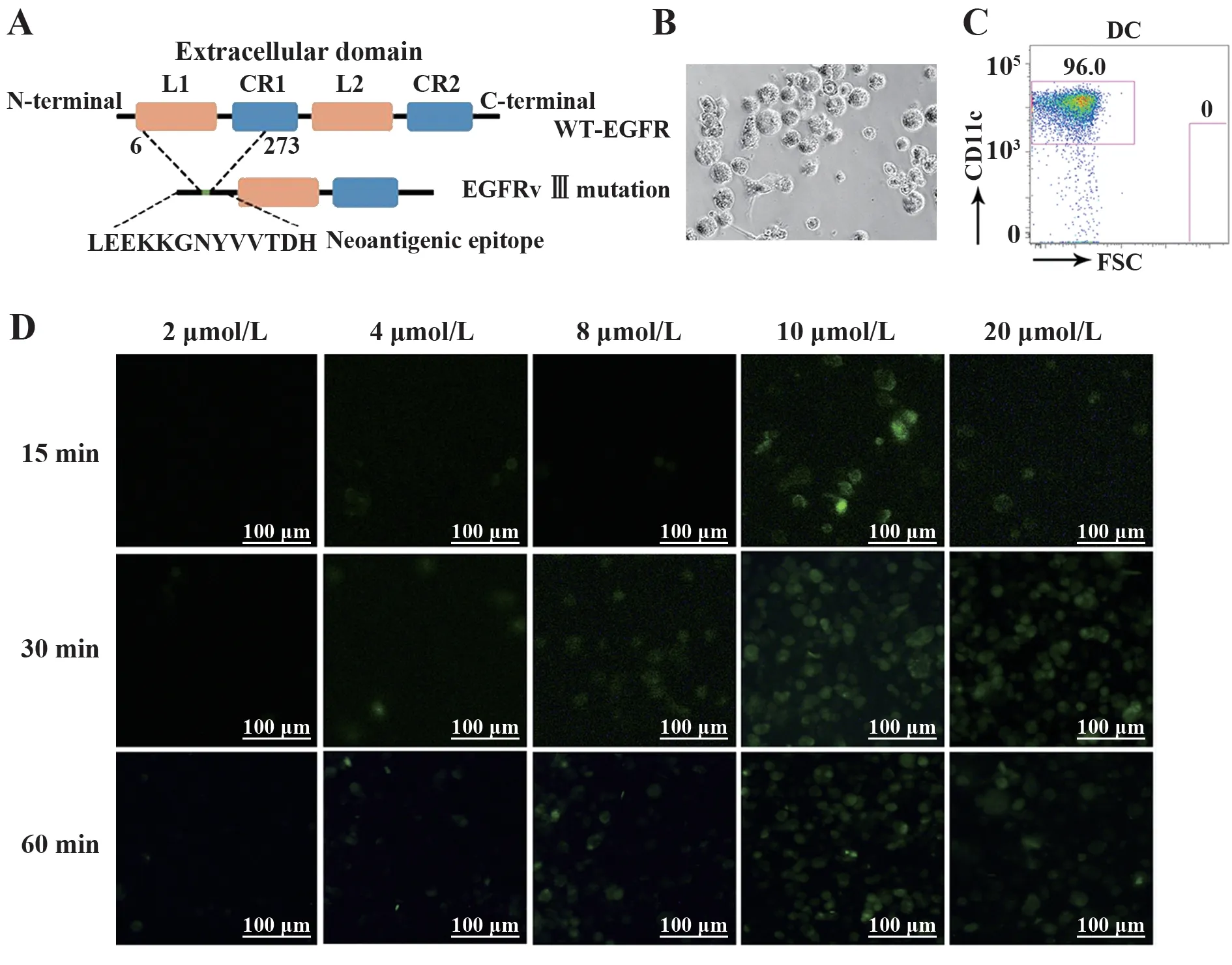
图2 DCs体外摄取CTP-V2的能力Fig.2 Validating uptake capability of CTP-V2 by DCs in vitro
2.3 负载CTP-V2的DCs可显著激活CD8+T细胞将负载CTP-V2的DCs与CD8+T细胞共孵育(图3A),CFSE稀释实验表明,负载CTP-V2的DCs较负载V2的DCs可显著增强CD8+T细胞增殖(P<0.000 1,图3B、C)。此外,流式细胞术检测CD8+T细胞表面激活标志物CD69表达结果显示,CTP-V2组CD8+T细胞表面CD69表达显著高于V2组(P<0.000 1,图3D、E)。
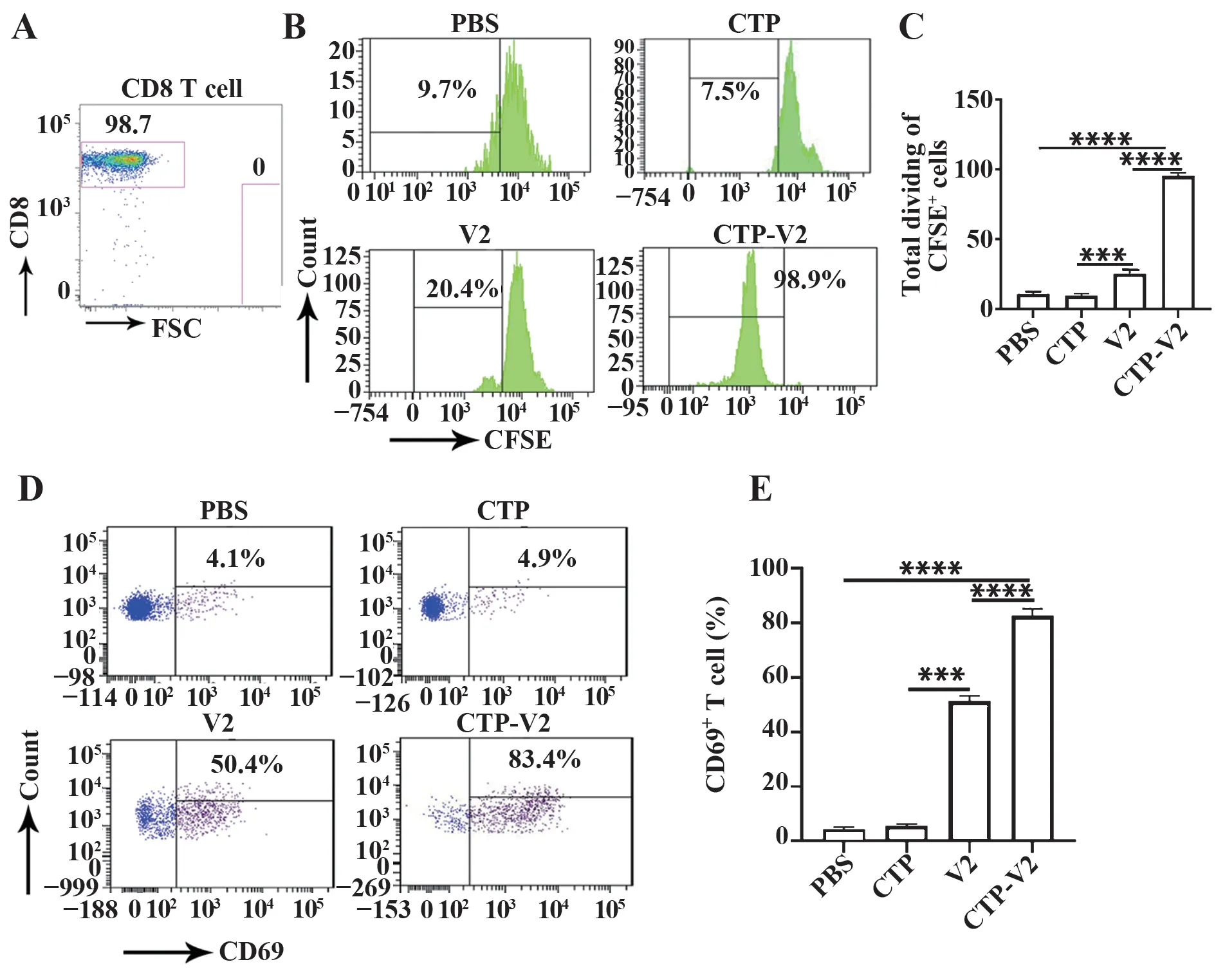
图3 负载CTP-V2的DCs刺激后CD8+T细胞激活能力Fig.3 Activated capacity of CD8+T cells after stimulated with DCs loaded with CTP-V2
2.4 CTP-V2显著抑制小鼠脑胶质移植瘤体内增殖 建立小鼠脑胶质瘤细胞皮下移植瘤模型评估CTP-V2对脑胶质瘤的抗肿瘤活性,活体成像结果显示,CTP-V2治疗组小鼠肿瘤显著小于V2治疗组(图4A)。瘤体积监测结果也显示,CTP-V2治疗组肿瘤生长速度显著低于V2治疗组(P<0.01,图4B)。此外,瘤重结果也表明,CTP-V2治疗组肿瘤质量较V2治疗组更小(P<0.01,图4C)。
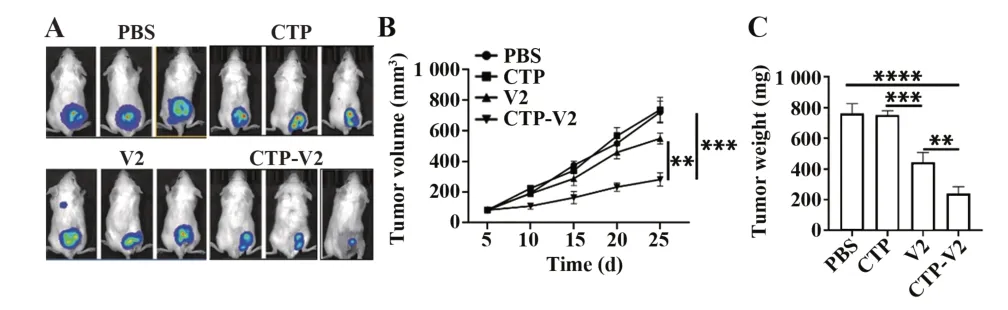
图4 CTP-V2体内抗肿瘤活性Fig.4 Anti-tumor activity of CTP-V2 in vivo
2.5 CTP-V2显著增强T细胞浸润与肿瘤细胞凋亡 免疫组化结果显示,CTP-V2治疗组CD3+T细胞显著多于V2治疗组(P<0.001,图5A、B),说明CTPV2治疗组肿瘤组织较V2治疗组出现明显淋巴细胞浸润。此外,TUNEL法检测肿瘤细胞凋亡水平,结果显示:CTP-V2治疗组TUNEL阳性染色细胞数明显多于V2治疗组(P<0.000 1,图5C、D)。
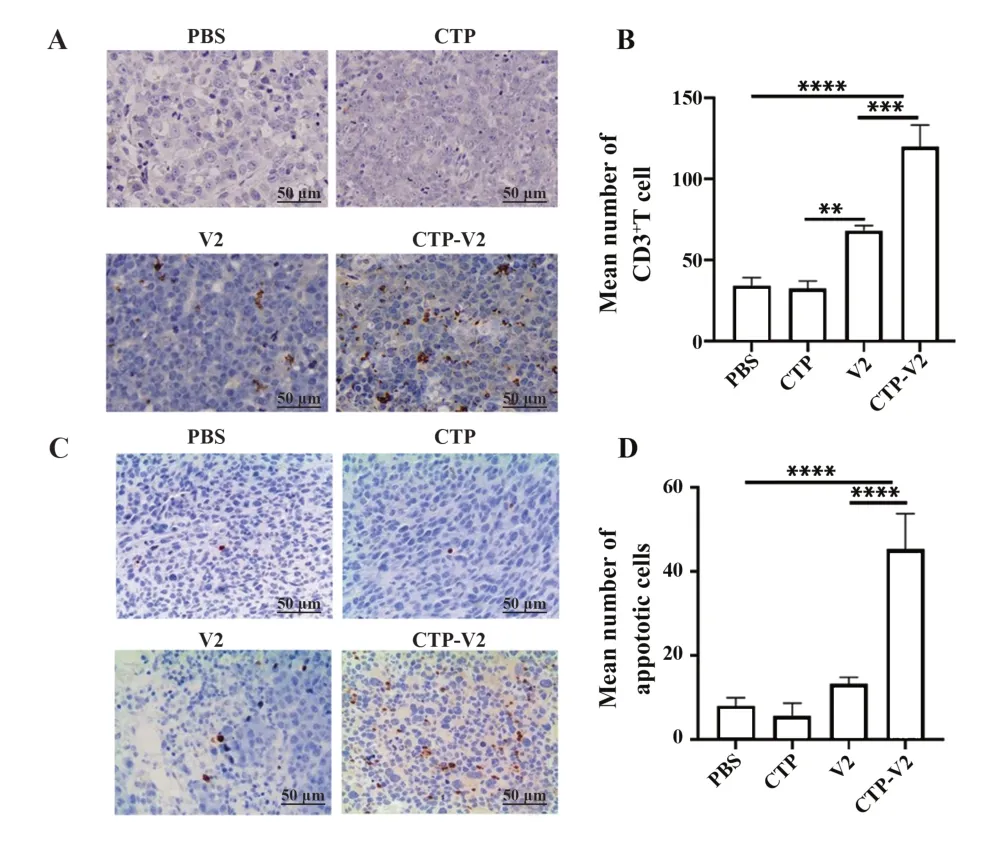
图5 肿瘤免疫浸润和细胞凋亡Fig.5 Tumor immune infiltration and apoptosis
3 讨论
近年多肽疫苗被用于刺激宿主免疫系统,激活对感染性或非感染性疾病的适应性免疫应答,其中新抗原疫苗在癌症治疗领域的潜力逐渐凸显。哈佛大学的CATHERINE WU团队采用新抗原疫苗治疗6例高复发风险的黑色素瘤患者,其中4例治疗后2年内未复发,重新引起了研究者对肿瘤疫苗的兴趣[16]。
EGFRvⅢ是典型的新抗原,编码EGFRvⅢ的肽链是一种理想的多肽疫苗,但单一的EGFRvⅢ无法引起显著的抗肿瘤免疫应答,需联合佐剂或对其进行修饰[17-18]。近期研究表明,胞浆转导肽修饰可能是增强治疗性或预防性多肽疫苗免疫原性的有效策略,因为这种策略可介导多肽疫苗定位于抗原提呈细胞的胞浆中,利用交叉递呈优势诱导细胞免疫应答[19]。
本研究中,EGFRvⅢ编码的多肽疫苗与胞浆转导肽融合,体外实验中,为研究抗原提呈细胞(如DCs)对疫苗的摄取,采用FITC标记的疫苗示踪DCs摄取抗原的效率,观察到CTP-V2能有效被DCs摄取,且定位于胞质。这种能够直接定位于DCs细胞质的性质可更好地诱导交叉递呈过程。课题组发现DC/CTP-V2组与CD8+T细胞共孵育后,T细胞增殖能力显著增强,CD69表达显著升高,提示存在交叉递呈。体内研究中,CTP介导的多肽疫苗可显著激活小鼠抗肿瘤免疫应答,抑制胶质瘤生长。
为达到临床应用效果,有研究采用患者DCs负载抗原,形成DCs疫苗,对患者进行治疗。与传统的抗原负载工具,如PTDS和纳米颗粒相比,CTP可将抗原肽直接携带到DCs胞浆,是一种安全的外源抗原递送工具[20]。因此未来研究中,课题组将继续探索DCs体外负载CTP-V2后对胶质瘤的治疗作用。
综上,本研究报道了一种采用CTP介导的多肽疫苗诱导胶质瘤特异性抗肿瘤免疫应答,这种方法基于CTP强大的细胞质定位能力,使外源抗原内源化,从而诱导特异性和持久的细胞免疫应答。EGFRvⅢ-GL261移植瘤模型中,CTP-V2可有效诱导细胞免疫以及表现出较强的抗肿瘤能力,显著增强T细胞向肿瘤组织浸润的能力。因此,CTP-V2可能是治疗胶质瘤的一种新策略。

