三酶两步水解法对杂粮代餐粉的品质特性改善
陈悦,高路
(沈阳师范大学粮食学院,辽宁 沈阳 110034)
代餐粉是一种单一或综合性冲调粉剂产品,其原料由谷物、豆类、薯类等制作而成[1],具有方便、易于携带和储藏等优点。近年来,人们对饮食的要求越来越趋于多样化和均衡化,作为功能性膳食的杂粮备受关注[2]。杂粮指除大米、小麦外的其他谷物,是一种具有营养和药理价值的功能食物[3]。杂粮富含蛋白质、膳食纤维、矿物质等营养物质,同时含有大量的植物化学物质,其对人体具有抗氧化和调节激素等作用,有益于人体健康[4]。研究表明,杂粮中的酚酸、花青素、黄酮等植物化学素可与小麦等主要谷物相媲美[5],用杂粮制备的杂粮代餐粉(coarse cereals meal replacement powder,CCMRP)深受消费者的喜爱。杂粮富含各类营养物质,但本研究所选用的杂粮与其它杂粮相比,淀粉含量较高,在储藏过程中易老化,货架期不稳定,且杂粮中富含的膳食纤维使加工后的产品口感粗糙、适口性和风味变差、冲调性下降[6-9]。
生物酶水解技术自然温和、催化效率高、绿色环保,既可以保留杂粮中天然的营养物质、促进人体对营养成分高效地吸收,又可明显改善产品的冲调性[10],也可提高产品稳定性、改善代餐粉的口感、增加风味[11]。纤维素酶是常见的细胞壁消化酶,可改变细胞壁、细胞膜的通透性,加速细胞内物质溢出,有利于细胞壁中酚类物质的释放,既增加了产品中总酚的含量,也提高了产品的抗氧化能力。α-淀粉酶和糖化酶显著影响淀粉水解过程[12],α-淀粉酶是一种内切淀粉酶,它可以裂解淀粉内部的α-1,4糖苷键,进行水解反应生成葡萄糖、麦芽糖和糊精;糖化酶水解淀粉链的外部葡萄糖残基,主要作用于长链多糖分子[13]。采用α-淀粉酶与糖化酶组成的复合酶水解底物,具有操作简单、周期短、水解产物对酶的抑制作用小等优点[14]。
本试验以紫薯为主要原料,辅以黄豆、花生仁、芝麻籽、玉米、小米、糙米、藜麦、薏米、青稞,制备CCMRP,并利用酶解技术对其冲调性和感官品质进行改善,使CCMRP中的营养成分更易于人体吸收。
1 材料与方法
1.1 材料与试剂
紫薯、黄豆、花生仁、芝麻籽、玉米、小米、糙米、藜麦、薏米、青稞:市售。纤维素酶(4×105U/g):上海瑞永生物科技有限公司;α-淀粉酶(4×103U/g)、糖化酶(1×105U/g)、葡萄糖:大连美仑生物技术有限公司;DNS试剂:北京酷来搏科技有限公司。
1.2 仪器与设备
JTM60胶体磨:沈阳市香洋机械厂;Scientz-150高压均质机:宁波新芝生物科技股份有限公司;SD-1500喷雾干燥机:上海沃迪科技有限公司;UV-5100型紫外分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 工艺流程
原料→胶体磨→50目筛过滤→纤维素酶水解→第一次灭活→复合酶水解→第二次灭活→高压均质→喷雾干燥→CCMRP。
1.3.2 操作要点
将紫薯清洗、去皮、护色(质量分数0.25%柠檬酸、0.35%植酸、0.30%L-半胱氨酸,质量比为 1.0∶2.8∶3.6的复合护色剂中处理20 min),黄豆和花生除杂、清洗、浸泡、去皮,芝麻籽、玉米、小米、糙米、藜麦、薏米、青稞除杂、清洗、浸泡;用胶体磨(驱动功率1.5 kW,研磨3次)将处理后的10种原料混合打浆 [料液比为1∶6(g/mL)],并用50目筛过滤;经过酶解处理后,对混合浆液进行高压均质(40 MPa,2 min~5 min)处理,最后经喷雾干燥(喷雾压力0.20 MPa、进料流量400 mL/h、进风温度160℃、热风流量45 m3/h)得CCMRP。
1.3.3 纤维素酶和复合酶添加顺序试验
酶解处理按照先复合酶、后纤维素酶和先纤维素酶、后复合酶的顺序分别进行试验。通过预试验得出,在酶解时间110 min、酶解温度55℃、纤维素酶添加量0.75%的条件时,纤维素酶效果最佳;复合酶水解条件取各因素的单因素试验中间水平。以不进行酶解处理为空白对照组。
1.3.4 单因素试验
选取复合酶水解条件(α-淀粉酶∶糖化酶、酶解时间、酶解温度、复合酶添加量)为考察因素。复合酶体积比 3∶1、2∶1、1∶1、1∶2、1∶3,酶解时间 70、90、110、130、150 min,酶解温度 45、50、55、60、65 ℃,复合酶添加量0.25%、0.50%、0.75%、1.00%、1.25%,并以葡萄糖当量(dextrose equivalent value,DE值)为指标。每组单因素试验做3组平行。
1.3.5 正交试验优化
根据单因素试验结果,进行四因素三水平正交试验,确定CCMRP的最佳酶解条件,如表1所示。
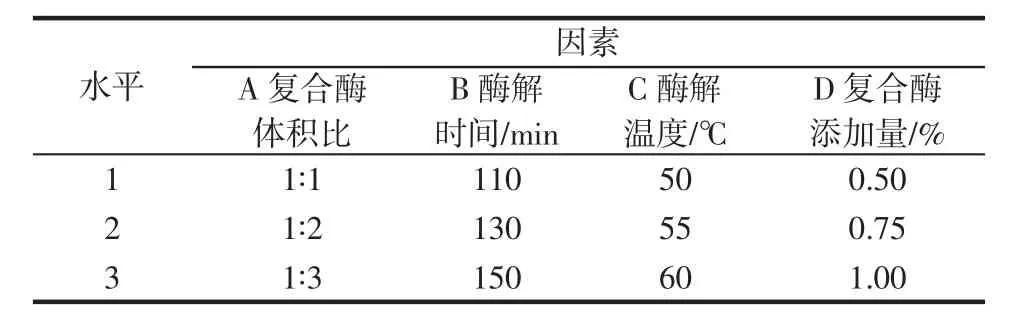
表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
1.3.6 DE值测定
参考王丽丽[15]、王章桃[16]的方法并加以改动,DE值指淀粉的转化程度,以葡萄糖值表示。
1.3.6.1 固形物含量的测定
固形物含量参考文献[15]的方法进行测定。
1.3.6.2 葡萄糖值的测定
称取0.1 g干燥样品于4.9 mL去离子水中,充分溶解后冷却至室温,取0.1 mL于离心管中,再加入1.5 mL DNS溶液和0.4 mL去离子水,沸水浴5 min,冷却。于540 nm处测定吸光值,绘制曲线得到回归方程:Y=0.248 9X-0.084 5(R2=0.999 6),DE 值计算公式如下。

1.3.7 感官评价
由12名评估人员组成感官评价小组,评估人员需具有食品感官评价方面的专业知识。将经酶解处理和未作处理的CCMRP随机分发给评估人员,两个样品评估时间间隔3 min[17],评定标准见表2。

表2 CCMRP感官评定标准Table 2 Criteria for sensory assessment of CCMRP
1.3.8 水合特性测定
准确称取0.5 g样品与20 mL蒸馏水混合,在25℃和100℃条件下水浴30min,不断搅拌,然后10000r/min离心30 min。将上清液倾倒于铝盒中,105℃烘干至恒重[18],水合特性计算公式如下。

式中:m为样品质量,g;m1为离心管中沉淀的质量,g;m2为干燥至恒重的上清液质量,g。
1.3.9 冲调性测定
用分散性和润湿性定量的表征冲调性[19]。
1.3.9.1 分散性的测定
参考苟小菊等[20]的方法。取1.0 g样品于25 mL蒸馏水中,以300 r/min的转速进行磁力搅拌,直至样品充分溶解,记录样品溶解所需时间。
1.3.9.2 润湿性的测定
参考张妍等[19]的方法。取1.0 g样品置于50 mL 50℃蒸馏水中,记录样品全部润湿的时间。
1.3.10 吸湿性测定
参考Caparino等[21]的方法并加以改动。准确称取1.0 g样品放入盛有饱和氯化钠溶液的干燥器中,25℃保存7 d。吸湿性(hygroscopicity,HG)计算公式如下。
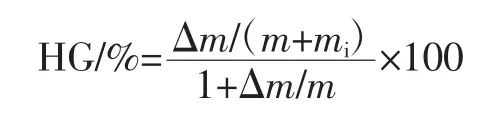
式中:Δm为样品质量的增加量,g;m为样品的初始质量,g;mi为样品放入干燥器前的水分含量,g。
1.3.11 填充性和流动性测定
1.3.11.1 松密度、轻敲密度的测定
取1个内径为25 mm的50 mL量筒,匀速注入20 mL样品至标记处,准确称量注入样品前后量筒的质量[22],松密度(ρB)公式如下。

式中:m1为量筒的质量,g;m2为样品与量筒的总质量,g;VB为注入样品的体积,mL。
然后用手敲击上述量筒,重复300次,记录敲击后样品的体积,轻敲密度(ρT)的计算公式如下。
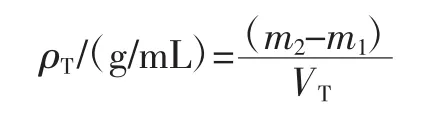
式中:VT为敲击后样品的体积,mL。
1.3.11.2 休止角、滑角[23]、卡氏指数和霍斯纳比值的测定[22]
在一张方格纸上方固定一个漏斗,使漏斗底端出口与纸张垂直距离(H)为3 cm,然后将样品倒入漏斗,流下的样品在方格纸上形成圆锥体,直至锥体上部接触到漏斗下部,测量锥体直径(2R),休止角θ为锥体与水平面夹角,计算公式如下。
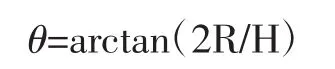
准确称量5.0 g样品于光滑平板上,缓慢抬起平板(长L为130 mm)一端直到样品表面开始滑动,测量斜面顶部与水平面的垂直距离(H),平板与水平面的夹角即为滑角α,计算公式如下。
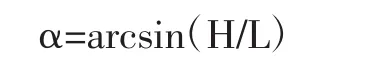
根据上式计算卡氏(Carr)指数、霍斯纳(Hausner)比值,计算公式如下。

1.3.11.3 川北方程
参考陈盛君等[24]的方法并把压力改成轻敲次数。取样品缓慢注入量筒中至体积100 mL,在量筒距手面1 cm处轻敲,记录轻敲次数和对应体积,直至样品体积不再改变,川北方程如下。
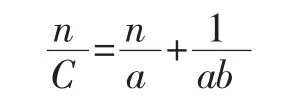
式中:n为轻敲次数;a为轻敲次数无穷大时体积减少数;b为填充速度常数;C为样品相对体积减小数。
轻敲次数无穷大时,a、b公式如下。以n为横坐标,n/C为纵坐标作图,通过方程斜率和截距计算a和1/b。

式中:V0为初始体积,mL;Vn为轻敲n次后样品体积,mL;V∞为轻敲无穷次后样品体积,mL。
1.4 数据处理
每组试验进行3次独立重复试验,试验数据以平均值±标准差表示,使用Origin软件作图,数据统计分析采用SPSS软件。
2 结果与分析
2.1 单因素试验结果
2.1.1 复合酶体积比对CCMRP的DE值影响
复合酶体积比(α-淀粉酶∶糖化酶)对CCMRP的DE值影响,如图1所示。
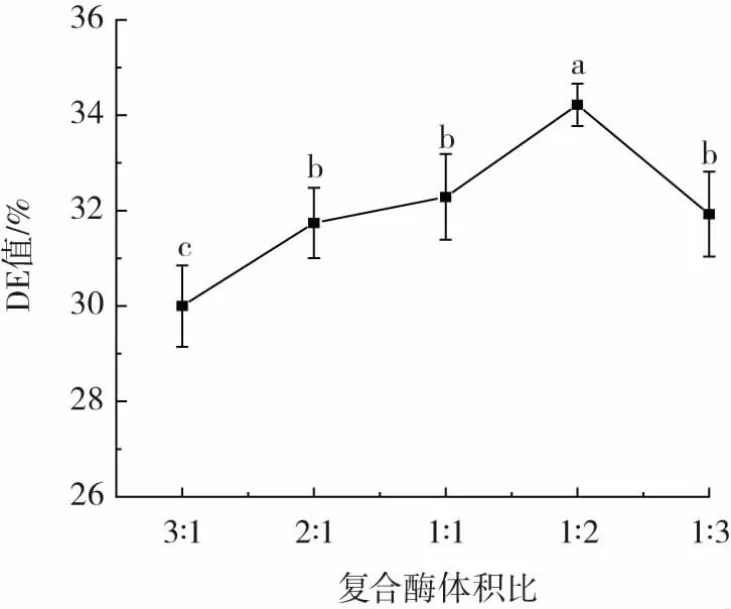
图1 复合酶体积比对CCMRP的DE值影响Fig.1 Effect of enzyme volume ratio on DE value of CCMRP
DE值与淀粉的水解、糖化程度有关,以DE值来判断酶解程度,DE值越高,酶解程度越大[25]。由图1可知,α-淀粉酶与糖化酶体积比对CCMRP的DE值有较大影响,随α-淀粉酶的添加量减少,糖化酶添加量增加,DE值呈先增大后减小趋势,α-淀粉酶与糖化酶的体积比为1∶2时,DE值达到最大。这可能是由于随着糖化酶的增多促进了α-淀粉酶与糖化酶的协同作用,使DE值变大,但糖化酶的比例过高,会影响α-淀粉酶的对底物的反应,使其酶解效率降低,从而使DE值减小。试验结果与姚芳等[26]研究的α-淀粉酶与糖化酶体积比对可溶性糖类物质水解程度的影响趋势一致。确定α-淀粉酶与糖化酶最佳体积比为1∶2,选择复合酶体积比 1∶1、1∶2、1∶3 进行后续正交试验。
2.1.2 酶解时间对CCMRP的DE值影响
酶解时间对CCMRP的DE值影响如图2所示。
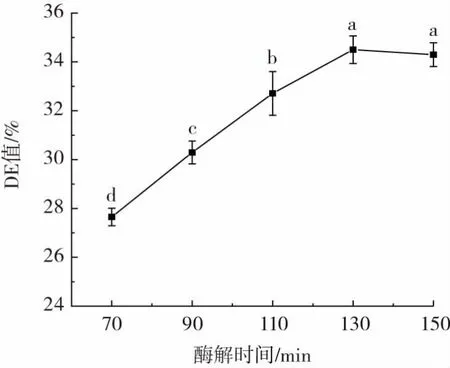
图2 酶解时间对CCMRP的DE值影响Fig.2 Effect of enzymolysis time on DE value of CCMRP
从图2可以看出,随着酶解时间增加,DE值增大,130 min后,DE值趋于平缓状态,稍有降低。原因可能是酶解的进行使底物中的葡萄糖和短链淀粉分子数量逐渐增多,导致酶解速度变缓。当130 min后,因酶与底物间作用使分子细胞壁已经分解完全[27]。所以选择酶解时间110、130、150 min进行后续正交试验。
2.1.3 酶解温度对CCMRP的DE值影响
酶解温度对CCMRP的DE值影响如图3所示。
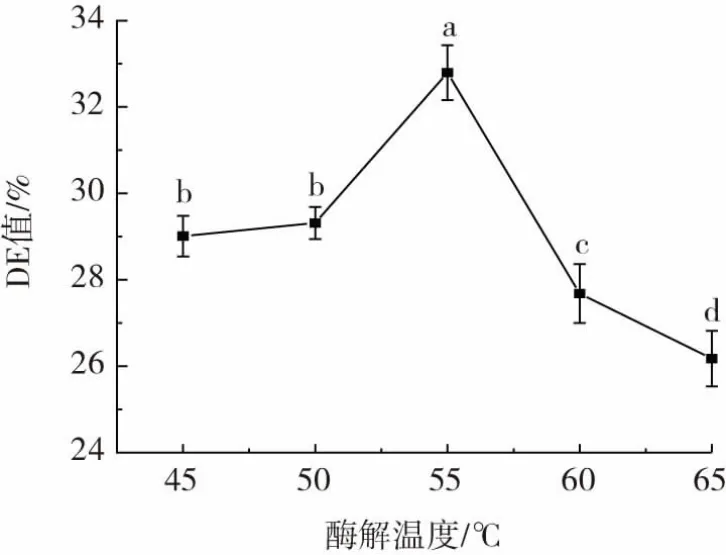
图3 酶解温度对CCMRP的DE值影响Fig.3 Effect of enzymolysis temperature on DE value of CCMRP
如图3所示,随酶解温度升高,DE值先上升后下降,当酶解温度小于55℃时,温度升高,DE增加,特别是50℃~55℃时DE值增加更为显著。当温度超过55℃后,DE值显著下降。这主要是因为温度低于复合酶的最适温度影响酶解效果,但高于最适温度又抑制了酶的活性,使酶的活性降低甚至失活,延缓了酶解进程[28-29]。所以选择酶解温度50、55、60℃进行后续正交试验。
2.1.4 复合酶添加量对CCMRP的DE值影响
复合酶添加量对CCMRP的DE值影响如图4所示。
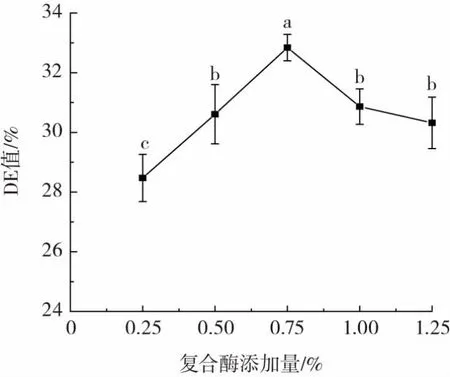
图4 复合酶添加量对CCMRP的DE值影响Fig.4 Effect of enzyme addition amount on DE value of CCMRP
如图4所示,当复合酶添加量增加时,CCMRP的DE值变化趋势呈先增大后减小,复合酶添加量在0.75%时,DE值出现转折点。这可能是因为当底物到达一定浓度时,酶解较彻底,根据分子络合学说,酶分子与底物之间存在某个平衡点,在此平衡点酶解底物到达饱和状态,酶活性趋于稳定,酶添加量增加,而单位酶的作用底物减小,水解程度降低[8,30]。因此选择复合酶添加量0.50%、0.75%、1.00%进行后续正交试验。
2.2 正交试验结果
正交试验中,在分析DE值基础上进一步讨论CCMRP的冲调性(以分散性、润湿性进行定量表征),依据各指标对CCMRP品质特性的影响,赋予各指标权重分别为DE值占40%,冲调性占60%(其中分散性30%、润湿性30%)。再用隶属度表示3个指标,隶属度是对受多种因素影响的事物做出全面评价的一种多因素决策方法[31]。利用隶属度表达分值,最后计算综合分即可得出最优组合。隶属度计算公式[16]如下。

CCMRP的正交试验设计与结果如表3所示。
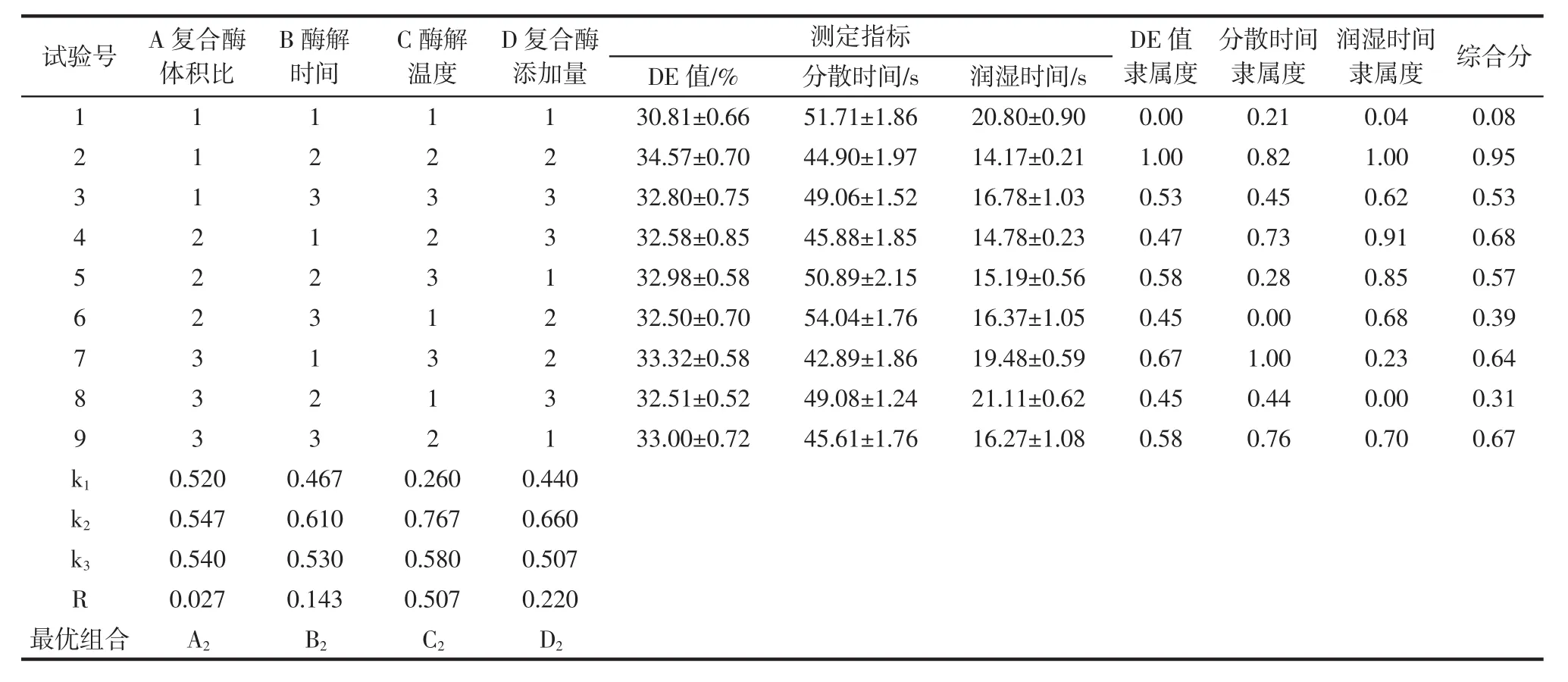
表3 正交试验设计与结果Table 3 Design and results of orthogonal test
由表3可知,各因素对CCMRP的DE值影响主次为C>D>B>A。取综合分最大时的组合A2B2C2D2为最优组合,即复合酶体积比1∶2、酶解时间130 min、酶解温度55℃、复合酶添加量0.75%。
2.3 验证试验结果
2.3.1 纤维素酶和复合酶添加顺序验证试验
加酶顺序对CCMRP的DE值影响,如表4所示。

表4 不同加酶顺序测得CCMRP的DE值Table 4 DE values of CCMRP samples prepared with enzymes added in different sequences
由表4可知,在酶解条件优化前,先加纤维素酶后加复合酶所测得CCMRP的DE值高于先加复合酶后加纤维素酶的DE值;经过正交试验后,不同加酶顺序测得CCMRP的DE值大小与酶解条件优化前一致,即先加纤维素酶后加复合酶的DE值较大。
傅超英[32]以木薯为研究对象,探索了多酶水解木薯的过程,研究表明增加α-淀粉酶和糖化酶用量,反应体系中葡萄糖逐渐积累,从而使葡萄糖浓度增大。所以本试验中先加纤维素酶后加复合酶的DE值更大可能由于复合酶对纤维素酶有抑制作用,随着α-淀粉酶和糖化酶添加量的增多,大分子物质随之被分解为糊精、葡萄糖等小分子物质,从而使体系中固形物的浓度和黏度变大,高浓度不利于底物与纤维素酶的吸附与作用,进而降低了纤维素酶的水解效率。
2.3.2 正交验证试验
在最佳工艺条件下测得CCMRP的DE值为(35.38±0.90)%,分散时间为(34.12±1.41)s,润湿时间为(15.03±0.61)s,根据3个指标的隶属度计算出的综合分为0.96,高于正交试验分值,故确定A2B2C2D2为最佳工艺。
2.4 CCMRP的感官评价结果
酶解对CCMRP色泽、风味、口感、整体认可度以及冲调性的影响如图5所示。
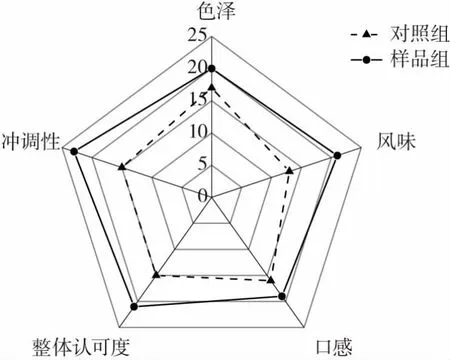
图5 酶解对CCMRP感官品质的影响Fig.5 Effect of enzymolysis on the sensory quality of CCMRP
由图5可知,样品组在色泽、风味、口感、整体认可度以及冲调性方面都比对照组的感官评分高,样品组相比对照组感官品质更好,特别是样品组的风味和冲调性比对照组明显偏高。
2.5 CCMRP的理化性质结果
酶解对CCMRP吸水指数、水溶性、膨胀势、分散时间及吸湿性的影响如表5所示。

表5 酶解对CCMRP理化性质的影响Table 5 Effect of enzymolysis on the physicochemical properties of CCMRP
从表5可以看出,样品酶解后吸水性增加,25℃时,吸水指数从1.53±0.02升高到2.11±0.04,100℃时从1.76±0.06升高到2.21±0.03。吸水性与细胞吸水能力以及暴露的亲水基团数量有关,由于酶解使CCMPR粒度降低,细胞裂解,亲水基团数量增加,导致吸水指数升高[33];样品组的水溶性增加,25℃和100℃分别增加了37.54%和38.48%,水溶性与分子结构的完整度有关,酶解使CCMPR表面积增加,表面活性提高,打破分子之间的团聚现象,继而使分散性增加[34],分散时间缩短了23.16 s。溶解度和膨胀势反映了淀粉分子在水中加热过程中,结晶区与无定型区结构中淀粉链之间相互作用的大小[35]。经过酶解处理后,样品在25℃和100℃条件下膨胀势均增大。样品组的吸湿性从(23.82±0.29)%降低到(15.03±0.22)%,吸湿性的降低有助于提高产品的货架期稳定性。
2.6 CCMRP的填充性和流动性结果
CCMRP的填充性和流动性评价结果如表6所示。

表6 CCMRP的填充性和流动性评价结果Table 6 Filling property and flowability of CCMRP
ρB和ρT是反映粉体填充性的重要指标之一,密度越大,填充性越好[36]。如表6所示,样品组的ρB和ρT与对照组相比明显升高。ρB升高了21.74%,ρT升高了10.00%,表明样品组的填充性好,易于压缩、成形。
θ和α与粉体流动性有关[37],θ用于表示物料颗粒间的聚集能力和团聚能力,α表示物料颗粒在接触面上的附着能力[38]。一般来说,θ、α越小,粉体流动性越好[39]。从表6中可以看出,样品组θ减小了18.42%,α减小16.15%。
Carr指数、Hausner比值表示压缩粉体时其流动的难易程度,Carr指数和Hausner比值与粉体的流动性呈负相关[40]。样品组的 Carr指数为(17.04±1.92)%,与对照组(24.95±1.61)%相比明显减小;同样,样品组的 Hausner比值(1.21±0.03)低于对照组的 Hausner比值(1.33±0.03)。一般来说,Carr指数在18%~21%之间时,说明粉体流动性处于中间水平,大于21%粉体流动性变差,小于18%流动性逐渐变好。Hausner比值接近1.2或者更小时,说明粉体具有良好的流动性,可以投入生产。而当Hausner比值逐渐趋于2.0时,粉体的流动性变差,导致很难流出容器甚至不流动[41]。上述结果表明,样品组的流动性远好于对照组。
2.7 川北方程解析粉体的填充性与流动性
川北方程拟合参数结果如表7所示。
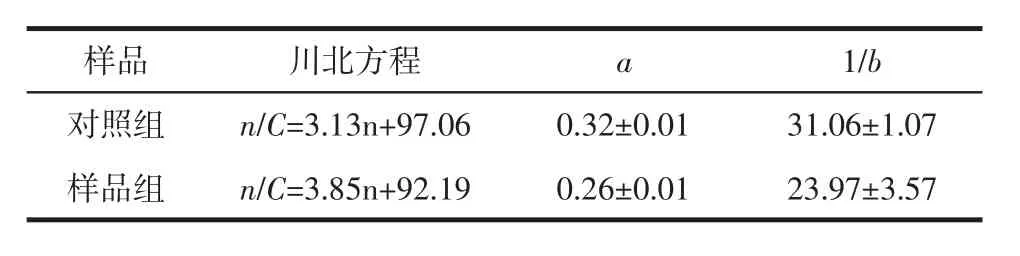
表7 川北方程拟合参数结果Table 7 Fitting parameters of Kawakita's equation
一般认为,a值越小,粉体的流动性越好;1/b值越小,粉体的填充速度越大,填充更易于进行[42]。由表7可知,样品组的a值为0.26±0.01,小于对照组(0.32±0.01),这与Carr指数和Hausner比值计算出的粉体流动性趋势一致。且通过1/b值可以看出,样品组的填充性比对照组好。
3 结论
本试验考察了纤维素酶与复合酶添加顺序对CCMRP的DE值影响,并通过单因素、正交试验对复合酶水解条件进行优化,研究了酶解前后CCMRP的吸水指数、水溶性、膨胀势、分散性、吸湿性和粉体特性的变化。结果表明,先加纤维素酶后加复合酶所测得CCMRP的DE值高于先加复合酶后加纤维素酶的DE值,且复合酶最佳酶解条件:复合酶体积比(α-淀粉酶∶糖化酶)1∶2,酶解时间 130 min,酶解温度 55 ℃,复合酶添加量0.75%,在此条件下产品的DE值和冲调性的综合分最高。可见,经过酶解处理的CCMRP感官品质得到改善,吸水指数、水溶性、膨胀势和分散性增大,吸湿性降低。粉体的填充性和流动性增强,更易于投入生产、包装。制得的代餐粉风味、口感、冲调性俱佳。
——以利盖蒂的部分音乐作品为例

