α-地中海贫血和β-地中海贫血基因突变异尾双链荧光探针杂交法的建立及应用评价
李仁强, 罗俊峰, 陈云弟
(上海阅尔基因技术有限公司技术研发部,上海 200433)
地中海贫血(简称地贫)是由于珠蛋白基因发生缺陷,导致1种或几种珠蛋白肽链不能合成或合成减少,链结构正常但比例失衡的遗传性溶血性血红蛋白病。地贫是常见的遗传病,主要分布于地中海、中东、印度、东南亚和非洲地区,全球地贫基因携带者近2亿[1-2]。地贫也是我国南方地区常见的、危害较大的遗传病之一,其临床异质性较大,从无临床表现到严重贫血,甚至死亡;尤其是β-地贫,患儿一般不会在出生时或出生后很快出现贫血等临床表现。准确、有效的基因检测技术对于地贫的及时诊断至关重要。本研究拟建立一种基于异尾双链荧光探针技术的新的检测方法,通过3管反应即可检测常见的3种α-地贫非缺失突变和8种β-地贫点突变,同时对该方法的检测性能进行评价。
1 材料和方法
1.1 样本制备
从UCSC数据库(http://genome.ucsc.edu/)获取α-地贫基因簇和β-地贫基因簇序列[3],从人类血红蛋白数据库(https://globin.bx.psu.edu/hbvar/)[4]获取α-地贫点突变和β-地贫点突变序列,并据此设计突变型质粒,将质粒干粉[生工生物工程(上海)股份有限公司]进行离心处理后,用TE缓冲液梯度稀释至2 000拷贝/μL。将正常样本基因组DNA(上海阅尔基因技术有限公司)稀释至7 ng/μL(约2 000拷贝/μL)。将突变型质粒与正常样本基因组DNA按1∶1(V∶V)混合,获得模拟杂合突变样本。
每套地贫核酸检测国家参考品(货号360014-201701,中国食品药品检定研究院)为32份,其中29份为点突变、缺失突变参考品,3份为无突变正常参考品。
在上海阅尔基因技术有限公司样本库中选取已知地贫基因型的临床样本200份,采用核酸提取试剂盒[天根生化科技(北京)有限公司]提取样本DNA,用NanoDrop 2000分光光度计(美国ThermoFisher Scientific公司)测定DNA浓度和纯度,严格按试剂盒说明书要求操作。
1.2 异尾双链荧光探针法的实验设计
1.2.1 异尾双链荧光探针构建 本研究使用的异尾双链荧光探针由荧光探针链和淬灭探针链组成[5],荧光探针链5'端标记荧光基团,3'端标记阻止延伸的基团,荧光探针链由5'端非同源序列区域和3'端模板互补区域组成;淬灭探针链序列和荧光探针链序列完全反向互补,在3'端标记荧光淬灭基团。
1.2.2 基本原理 当反应体系中不存在模板DNA时,荧光探针链与淬灭探针链碱基互补配对结合,荧光基团与淬灭基团之间形成非荧光复合物,二者通过氢键以质子偶联的电子转移相互作用,荧光基团由此被淬灭。检测样本时,首先通过不对称聚合酶链反应(polymerase chain reaction,PCR)扩增产生大量单链DNA片段;然后将反应体系升温至95 ℃,荧光探针链与淬灭探针链受热分离,成为单链游离状态;随后降温至40 ℃,荧光探针链与单链DNA模板特异性杂交,荧光基团与淬灭基团脱离接触发出荧光。见图1。
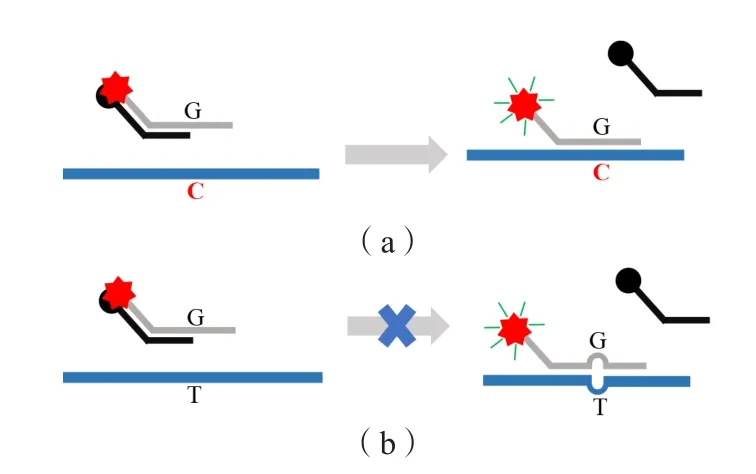
图1 异尾双链荧光探针法点突变检测原理示意图
1.3 方法
采用Primer Premier软件设计PCR引物和异尾双链荧光探针,由生工生物工程(上海)股份有限公司合成并纯化。荧光探针、淬灭探针序列及多重PCR分管见表1。PCR反应体系:总体积为25 μL,5×GoldStar PCR Master Mix(江苏康为世纪生物科技股份有限公司)5 μL,荧光探针或淬灭探针各0.1 μL,引物各0.2 μL,模板DNA 2 μL,用无酶水补足反应体积。根据荧光探针或淬灭探针的浓度(10、20、50 nmol/L)和引物的浓度(50、200、1 000 mol/L)构建不同的反应体系。反应条件:40 ℃保温8 min,采集各荧光通道信号值;95 ℃预变性10 min;95 ℃变性30 s,64 ℃退火30 s,72 ℃延伸2 min,50个循环;95 ℃变性5 min,40 ℃保温20 min,每分钟检测各通道荧光信号值。检测仪器为ABI 7500荧光定量PCR仪(美国ABI公司)。

表1 引物探针序列和多重PCR的分管
1.4 数据分析
1.4.1 孔间校正 每份样本分别进行3管反应,记录最后1个循环各通道荧光强度(F)和对应通道空白对照的荧光强度(F0),FAM/VIC/NED/CY5通道荧光强度和ROX通道荧光强度的商即为校正的样本荧光强度(Fn)和空白对照的荧光强度(Fn0)。
1.4.2 荧光背景校正 以Fn0作为荧光背景,计算样本荧光强度净增量(ΔFn),计算公式为:ΔFn=Fn-Fn0。
1.4.3 荧光强度净增量计算 计算待测样本与对应通道野生型的荧光强度净增量差值ΔΔFn,ΔΔFn=ΔFn样本-ΔFn野生型。
1.4.4 阈值设置 检测突变位点阳性临床样本,计算突变位点目标荧光净增量差值ΔΔFn的均值ΔΔF,荧光阈值=ΔFn野生型+ΔΔF/2。
1.4.5 结果判定 实际检测时将待测样本与野生型样本、空白对照同时检测,待测样本扣除野生型样本得到ΔΔFn值,比较ΔΔFn值与荧光阈值判定点突变。
1.5 方法性能评价
1.5.1 准确性和特异性 将全套地贫核酸检测国家参考品按说明书要求进行检测。(1)准确性:本方法检测范围内的国家阳性参考品的结果应为相应基因型别;(2)特异性:国家阴性参考品和本方法检测范围外的国家阳性参考品的结果应为未检出突变。
1.5.2 灵敏度 选择常见的非缺失α-地贫突变型与β-地贫基因点突变型(Hb CS、CD41/42、IVS-II-654)参考品梯度稀释至1.0、2.5、5.0、10.0 ng/μL,每份样本检测3次。
1.5.3 方法比较 将异尾双链荧光探针法与PCR-反向点杂交法[试剂盒购自亚能生物技术(深圳)有限公司]同时检测200份已知地贫基因型的临床样本,评估临床标本检测的准确性与特异性。2种方法结果不一致的样本采用测序法确认。
2 结果
2.1 异尾双链荧光探针法的建立与评估
按照设计方案(图2),建立多重不对称PCR及异尾双链荧光探针杂交的反应体系和反应条件并进行评估、优化。检测过程:首先通过多重不对称PCR产生大量单链DNA片段;PCR反应结束后,荧光标记探针与单链DNA杂交,通过荧光信号值判定点突变的有无及具体类型。
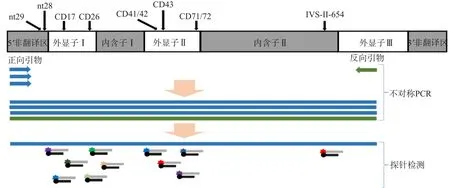
图2 地贫基因点突变检测方案
2.1.1 PCR反应体系 使用基因组DNA样本评估不对称PCR扩增的特异性。使用人工合成单链DNA与异尾双链荧光探针杂交,获得可区分野生型与突变型模板的探针对。使用优化的不对称PCR与探针杂交体系检测模拟杂合样本,确定反应体系与反应条件。PCR反应产物见图3。
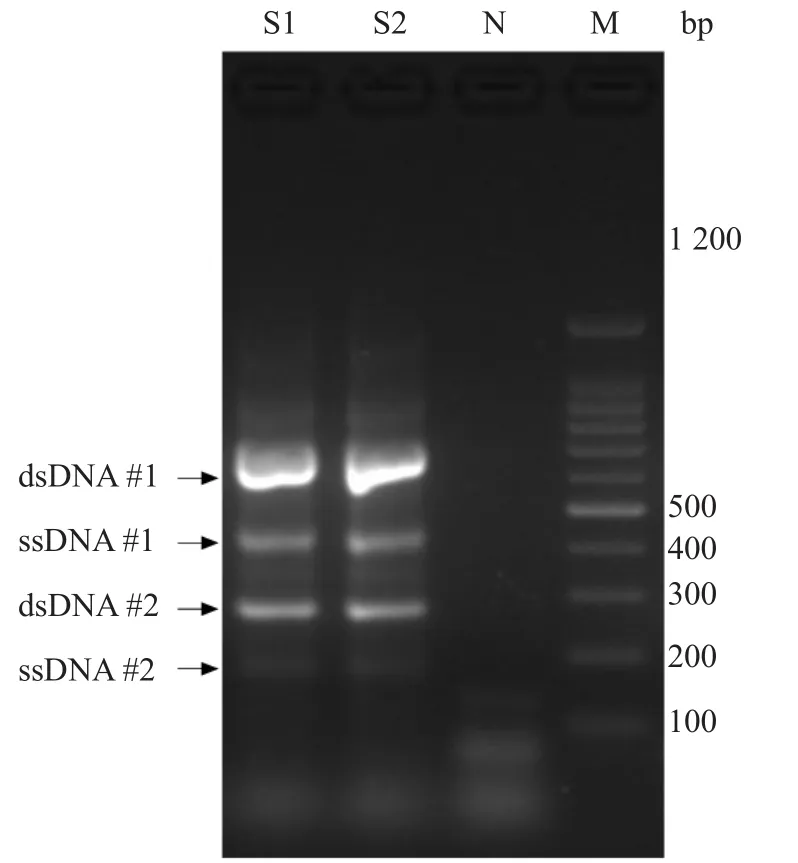
图3 多重不对称PCR特异性扩增目标区域单链DNA片段
2.1.2 荧光信号增量阈值确定 采用建立的异尾双链荧光探针杂交法检测临床样本,并对检测结果进行分析和计算,确定判定突变的荧光信号增量阈值。见表2、图4。

表2 3管反应检测结果的解释(ΔΔFn值)

图4 3管反应检测11种突变样本结果
2.2 异尾双链荧光探针法的检测性能评价
2.2.1 准确性和特异性 按地贫核酸检测国家参考品说明书要求,采用异尾双链荧光探针杂交法检测全套参考品。结果显示,对于检测范围内的11种点突变样本,异尾双链荧光探针杂交法检测结果与国家参考品说明书标示的突变类型的符合率为100%;对检测范围外的其他点突变或缺失突变样本,异尾双链荧光探针杂交法均未检出。见表3。
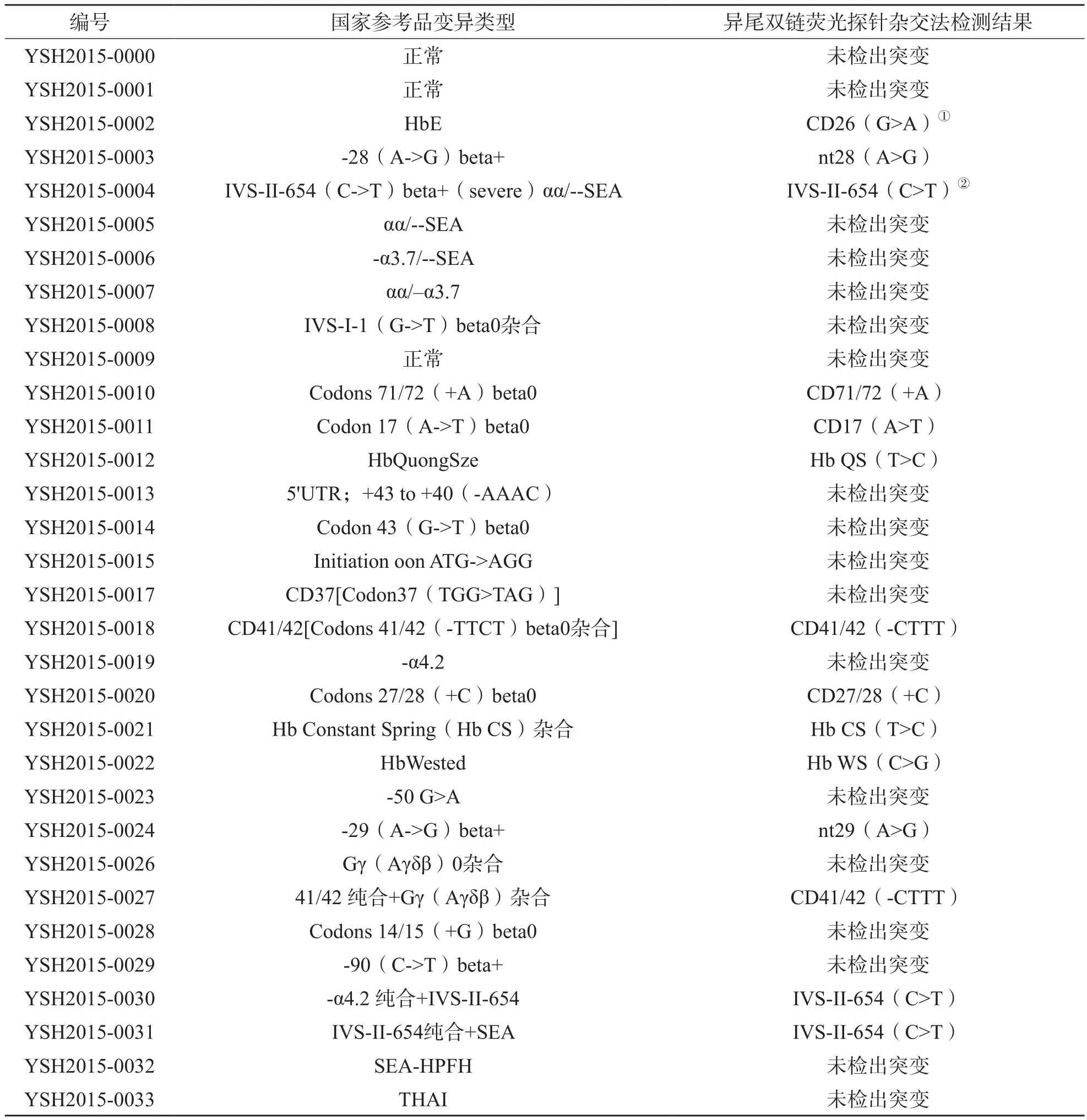
表3 国家参考品检测结果
2.2.2 灵敏度 采用异尾双链荧光探针杂交法检测1.0、2.5、5.0、10.0 ng/μL的α-地贫Hb CS点突变参考品和β-地贫CD41/42、IVS-II-654点突变参考品,结果均与国家参考品说明书中提供的突变类型一致。
2.2.3 临床样本检测 同时采用异尾双链荧光探针杂交法和PCR-反向点杂交法检测200份临床样本。结果显示,异尾双链荧光探针杂交法与PCR-反向点杂交法的符合率为100%。见表4。

表4 2种方法检测临床样本的结果比较
3 讨论
正常人每条16号染色体上有2个α-珠蛋白基因,即α1(HBA1)基因和α2(HBA2)基因,二者表达同一种产物α-珠蛋白链。正常情况下,α2基因较α1基因的功能更强,前者表达量为后者的2倍。α2与α1为高度同源基因,二者序列相似性约为94%,GC含量约为75%,编码区序列完全一致,仅5'端非翻译区与内含子区域存在序列差异[1]。α-地贫基因簇同时存在α2、α1的同源基因HBZ和假基因HBZP1、HBM、HBQ1。中国人群常见的3种非缺失型α-地贫突变Hb WS、Hb QS和Hb CS均发生在HBA2基因编码区[2]。与α-地贫类似,β-地贫基因HBB与HBD碱基序列高度相似,β-地贫基因簇上还存在HBG1、HBG2、HBE、HBBP1等同源基因或假基因。中国人群常见的β-地贫点突变均发生在HBB基因1号外显子和2号外显子区,该区域GC含量约为50%;其中,IVS-Ⅱ-654突变位于2号内含子深处,该区域GC含量约为15%[2,6]。
目前,用于非缺失型α-地贫与β-地贫点突变检测试剂盒主要采用PCR-反向点杂交法、多重荧光熔解曲线法[7]。PCR-反向点杂交法是一种较成熟的检测技术,临床应用较广泛,检测过程包括PCR扩增与膜杂交显色两部分,可检测常见点突变与缺失突变,其检测过程耗时较长,包含大量繁琐的手工操作,效率较低。此外,PCR产物开管检测存在污染风险。多重荧光熔解曲线法近年来逐渐被用于地贫突变检测,该方法首先进行PCR扩增获得目标片段,然后使用双端标记荧光探针或双杂交荧光探针与目标片段杂交,最后通过熔解曲线分析获得熔点信息[8-10]。荧光熔解曲线法由于探针设计的特点,对于探针覆盖范围内相邻的突变位点,其熔点差异较小甚至存在熔点交叉,检测结果只能判定含有2种突变中的一种,需要通过测序法才能鉴定出具体的突变类型。因此,开发一种能够快速、简单、准确检测非缺失型α-地贫与β-地贫点突变的方法具有重要的临床意义。
为解决上述难题,本研究采用多重不对称PCR结合异尾双链荧光探针进行检测。具体设计如下:(1)所有PCR引物均设计为具有较高的Tm值(Tm>70 ℃),PCR扩增时采用较高的退火和延伸温度,一方面使变性的双链DNA维持单链状态以便与引物结合和延伸;另一方面,较高的退火温度使引物与目标区域特异性杂交,避免相似序列干扰。(2)利用单管反应检测多种点突变时,应尽可能提高探针与目标模板的杂交效率,尽可能降低探针与背景模板的杂交效率,从而获得较高的信噪比。有研究发现,在微阵列芯片的探针杂交反应中,单链DNA相比双链DNA有着更高的杂交效率,可获得更高的检测灵敏度[11-12]。本研究采用多重不对称PCR方式,3对引物分别扩增α2基因片段、β基因突变热点区域以及IVS-Ⅱ-654区域,获得目标区域单链DNA片段。相对于荧光熔解曲线法,本研究使用的PCR反应体系复杂度低,仅使用2条引物即可获得目标区域单链DNA片段,无需使用额外的嵌套引物或巢式引物[13],仅需优化每条PCR引物用量即可获得大量单链DNA片段,为异尾双链荧光探针杂交反应提供充足的单链DNA模板,并产生更高的荧光信号,直接通过荧光信号值即可进行结果判定,无需采用复杂的熔解曲线分析和熔点判断[14]。(3)异尾双链荧光探针的探针链被设计为较低的Tm值(60 ℃),淬灭探针链被设计为极低的Tm值(40 ℃),PCR过程中荧光探针链、淬灭探针链受热解链,由于探针Tm值显著低于PCR的退火、延伸温度,荧光探针链、淬灭探针链均处于游离状态,避免了探针与DNA杂交导致的引物延伸受阻,以及Taq酶切割探针引起的PCR反应前后探针总量变化。(4)由于异尾双链荧光探针法通过荧光探针-模板特异性杂交与链置换反应进行检测,探针设计具有极大的灵活性;本研究针对每个待检测突变位点分别设计1对特异性的异尾双链荧光探针;同时,参考中国人群非缺失α-地贫与β-地贫点突变复合发生的位点与频率信息,将常见复合杂合位点设置在不同反应管中[3];通过荧光信号或荧光信号组合即可准确判定突变类型,不受突变位点之间位置关系限制,也无需测序鉴定。与荧光熔解曲线法类似,本研究采用的异尾双链荧光探针法为闭管反应模式,只需加入DNA即可进行PCR反应与荧光检测,整个检测过程均由PCR仪在3 h内完成,反应结束后无需进行开盖处理,不存在PCR产物污染风险。
地贫核酸检测国家参考品作为国家体外诊断试剂标准物质,由中国人群常见的α-地贫缺失与非缺失突变、β-地贫缺失与非缺失型突变组成,用于地贫基因检测试剂盒的性能评价。本研究按国家参考品说明书要求,采用异尾双链荧光探针法进行检测,结果表明:(1)点突变型样本,包括单碱基替换、单碱基插入与多碱基插入等变异类型,均被准确检出,不存在假阴性或非特异性结果;(2)正常样本、缺失样本检测结果均为阴性,不存在假阳性结果;(3)异尾双链荧光探针法检测限为1 ng/μL,低于国家参考品说明书要求的10 ng/μL。因此,异尾双链荧光探针法的性能指标符合国家参考品要求,检测结果准确可靠。
同时,本研究检测了200例临床样本,变异类型包括3种非缺失型α-地贫、8种β-地贫点突变。验证结果表明,异尾双链荧光探针法对97例阳性样本、103例阴性样本的检测结果与PCR-反向点杂交法一致。
综上所述,本研究利用多重不对称PCR与异尾双链荧光探针技术建立了一种通过3管反应检测3种非缺失型α-地贫突变与8种β-地贫点突变的方法。经地贫核酸检测国家标准品与地贫临床标本验证,其性能指标均满足要求,能够准确、快速、可靠地检测11种地贫点突变,具有较高的临床应用价值。

