血液分析仪RBC-O和R-MFV参数在纠正冷凝集标本MCHC中的作用
李 敏, 李建英, 罗国菊, 郭 野
(1.潍坊市人民医院检验科,山东 潍坊 261041;2.中国医学科学院北京协和医院检验科,北京 100730)
冷凝集是指在低温条件下红细胞(red blood cell,RBC)发生可逆性凝集,标本发生冷凝集会导致RBC计数假性减少和体积假性增高的结果。目前,临床实验室在进行血细胞分析时,如遇到冷凝集标本,较普遍的处理方式有37 ℃水浴30 min或进行血浆置换,基本能达到将平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)纠正到<380 g/L的预期效果,但这些处理方式均需要一定的时间,操作步骤相对繁琐,且人工干预的步骤均会造成检测结果产生一定程度的误差。如何利用好血液分析仪的参数,在短时间内有效地解决问题,是对检验人员提出的挑战。有研究发现,冷凝集标本41 ℃加热1 min后检测,或利用血液分析仪的网织红细胞(reticulocyte,RET)通道检测的纠正效果比37 ℃水浴2 h的效果更好[1]。R-MFV、RBC-O是血液分析仪的研究参数,可通过计算纠正MCHC,无需额外的孵育或置换时间。目前尚未见有关联合应用RET通道RBC-O参数和电阻抗通道R-MFV参数计算MCHC来纠正冷凝集标本检测结果的报道。本研究在评估无冷凝集标本R-MFV、RBC-O的可应用性后,探讨R-MFV、RBC-O联合应用在纠正冷凝集标本MCHC中的价值。
1 材料和方法
1.1 样本收集
随机取2021年8月中国医学科学院北京协和医院临床送检血常规的20例无冷凝集标本血液分析仪检测结果。另收集2021年6—8月中国医学科学院北京协和医院住院患者临床送检血常规的15例冷凝集标本。冷凝集判断标准:MCHC≥380 g/L,RBC、血细胞比容(hematocrit,HCT)、血红蛋白(hemoglobin,Hb)之间不符合“3规则”[2],放入4 ℃冰箱5 min有肉眼可见的冷凝集现象[3]。
1.2 仪器与试剂
XN-9100全自动血液分析仪(日本Sysmex公司)及配套试剂、质控品,该仪器电阻抗通道以鞘流电阻抗法检测RBC,RBC-I和R-MFV为该通道研究参数;RET通道采用半导体激光流式细胞术(flow cytometry,FCM)+核酸荧光染色法检测RBC,RBC-O为该通道的研究参数。
1.3 标本处理与质量控制
每日测定3个水平配套质控品,确保结果均在控。无冷凝集标本常规上机检测。冷凝集标本分别用3种方法处理。(1)37 ℃水浴法:将冷凝集标本与含2.0 mL 0.9%NaCl溶液的稀释液一同置于37 ℃水浴箱内孵育30 min,吸取10 μL迅速加入2.0 mL温0.9%NaCl溶液中混匀,滴到计数板上,待RBC在计数板中分布均匀后,采用显微镜法[4]计数RBC。(2)血浆置换法:将标本1 500×g离心3 min,弃去血浆,加入等量0.9% NaCl溶液混匀,重复血浆置换步骤2遍,上机检测。(3)RET通道MCHC检测:采用XN-9100全自动血液分析仪RET通道检测MCHC(记为MCHC-O)。(4)通过RBC-O和R-MFV计算MCHC:用RBC-O替换RBC-I,R-MFV替换红细胞平均体积(mean corpuscular volume,MCV),通过公式MCHC=Hb/(RBC-O×RMFV)计算MCHC(记为MCHC计算)。
1.4 结果判定
(1)采用Bland-Altman法比较20例无冷凝集标本RBC-I与RBC-O、MCV与R-MFV的一致性。以测量结果的差值为纵坐标,均值为横坐标,绘制散点图,并标注出95%一致性界限(±1.96s)。如果2个测量结果的差值均位于95%一致性界限内,则判定为2种方法结果具有较好的一致性[5]。
(2)以37 ℃水浴法为参考方法,分别计算15例冷凝集标本RET通道、血浆置换法RBC计数结果与参考方法的差值,以差值为90%~110%为可接受范围。
(3)以MCHC<380 g/L,RBC、HCT、Hb之间符合“3规则”为纠正合格。统计RET通道、血浆置换法和通过RBC-O、R-MFV计算MCHC达到纠正标准的标本数。
2 结果
2.1 RBC-I与RBC-O、MCV与R-MFV的一致性
RBC-I与RBC-O、MCV与R-MFV的差值均在95%一致性界限内,一致性好。见图1、图2。
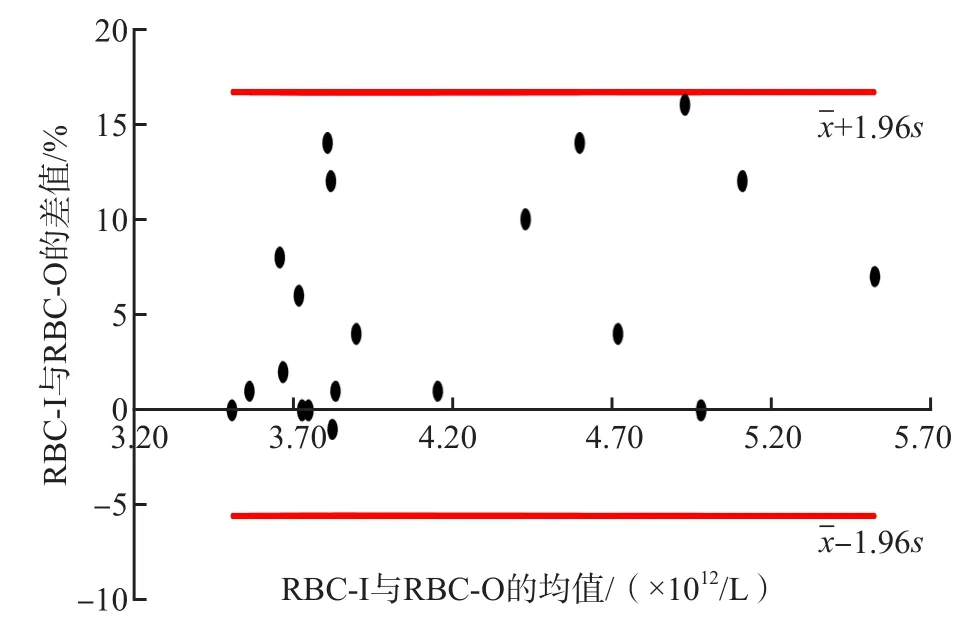
图1 无冷凝集标本RBC-I与RBC-O一致性分析

图2 无冷凝集标本MVC与R-MFV一致性分析
2.2 冷凝集标本处理前后RBC计数结果
除1例冷凝集标本血浆置换法与参考方法差值为60.5%外,其他14例标本与参考方法差值均为90%~110%。冷凝集标本直接上机检测、37 ℃水浴法、RET通道检测、血浆置换法RBC计数结果见表1。
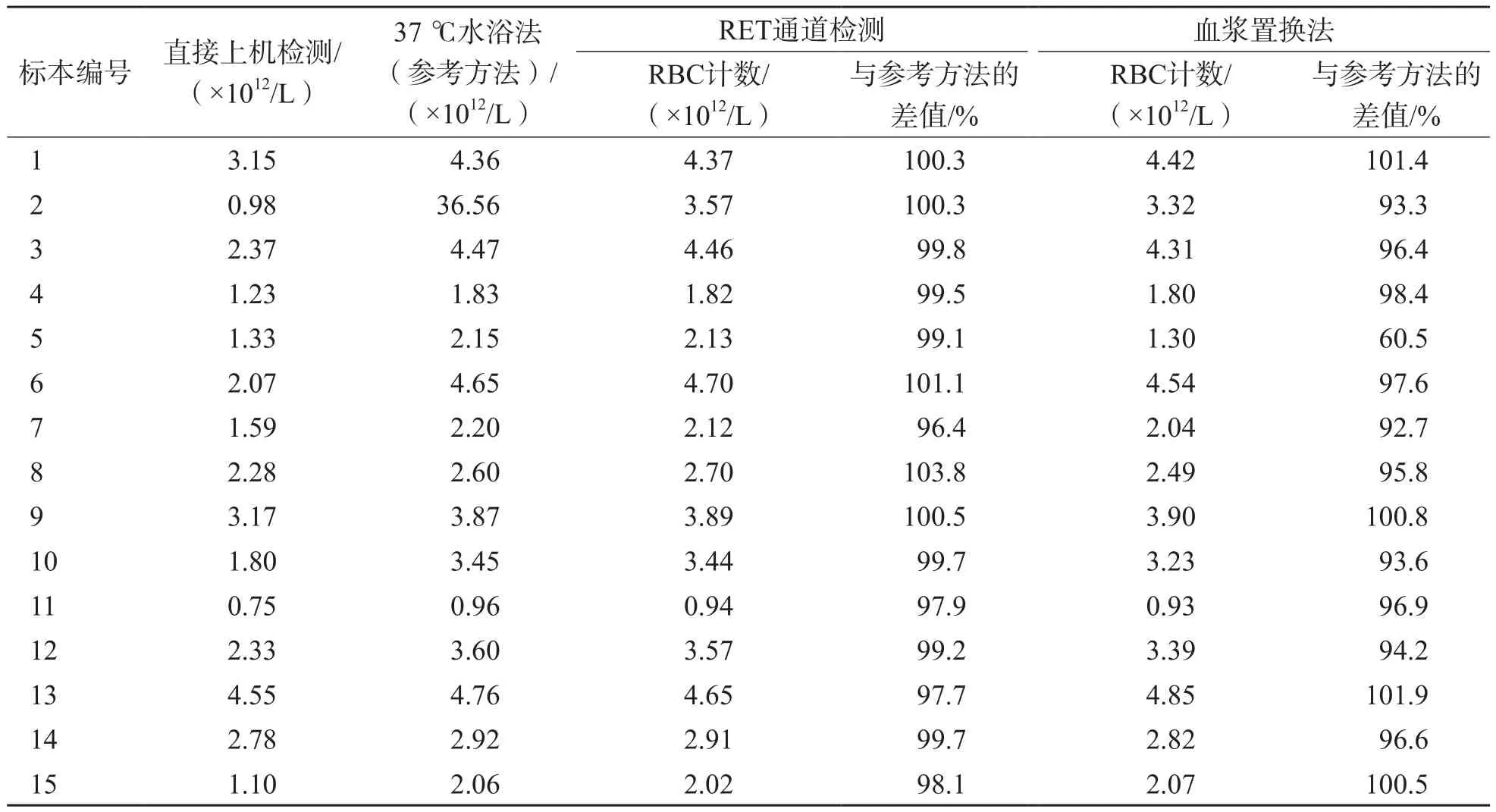
表1 15例冷凝集标本不同方法RBC计数结果
2.3 采用不同方法纠正冷凝集标本MCHC的效果比较
RET通道、血浆置换法和通过RBC-O、R-MFV计算MCHC,分别有5、13、14例达到纠正要求。见表2、图3。

表2 15例冷凝集标本不同方法红系参数纠正结果

图3 3种方法MCHC结果比较
3 讨论
XN-9100全自动血液分析仪检测RBC的原理为电阻抗法,RBC通过小孔时,形成相应大小的脉冲,脉冲的数目代表RBC的数量,脉冲的高度代表单个细胞的体积,脉冲高度叠加,经换算即可得出HCT的值。Hb测定原理为在稀释的血液中加入溶血剂,将RBC溶解,释放出Hb,后者与溶血剂中相关成分结合形成Hb衍生物,进入Hb测试系统进行比色,吸光度的变化与液体中Hb含量成正比[6]。在冷凝集标本中,RBC凝集成团,体积增大,聚集后体积超过250 fL时RBC计数会假性减少;多个RBC聚集后形成的RBC团在通过计数孔时引起脉冲增大,会导致MCV假性升高,凝集的RBC使MCV增高,同时RBC计数减少,但以RBC计数减少为主,因此HCT也随之降低,并造成了由RBC、Hb、HCT计算得到的MCHC结果异常升高[7]。Hb检测为比色法,不受影响,对于冷凝集标本而言,Hb是电阻抗通道提供的不受影响的相对“真值”,可以直接应用。
血液分析仪RET通道的分析原理为半导体激光FCM+核酸荧光染色,且配置41 ℃液体加热设备,故理论上通过RET通道可排除冷凝集干扰,得到可靠的RBC-O[6]。RBC体积服从正态分布,R-MFV与MCV在理论上是一致的[8]。因MCV是所有进入检测范围(25~250 fL)内单个、聚集的RBC体积的平均值,而当RBC体积按大小排序时,聚集的RBC因体积大会排在后边,因此R-MFV未纳入或仅纳入一部分聚集的RBC,其R-MFV也较MCV可靠,理论上更接近于RBC平均体积的“真值”。本研究结果显示,无冷凝集的标本RBC-I与RBC-O、MCV与R-MFV检测结果具有较好的一致性,与相关研究结果[6]一致。
本研究结果显示,RET通道检测与37 ℃水浴法(参考方法)RBC计数的差值均为90%~110%,而血浆置换法5号样本与参考方法RBC计数的差值(60.5%)超出界限,未达到纠正效果,但通过RBC-O和R-MFV计算,则达到了纠正效果;本研究15例冷凝集标本纠正结果显示,仅7号标本未能通过研究参数计算的方法纠正(血浆置换法可以纠正);2号和5号标本血浆置换法未达到纠正标准,但通过RBC-O和R-MFV计算可以纠正;8号标本的MCHC<380 g/L,但RBC、HCT与Hb之间不符合“3规则”,放置于冰箱5 min后,管壁上可看到凝集颗粒,因此在遇到RBC、HCT与Hb含量不成比例时,建议先确认是否存在冷凝集;13号标本因标本凝集成块,初次检测无结果,因此将标本37 ℃水浴30 min后上机检测,结果几乎无偏差。对RET通道、血浆置换法、通过RBC-O和R-MFV计算MCHC均可达到纠正要求(<380 g/L)的标本(4、8、11、13号),MCHC和MCV结果有一定的偏差,但因为尚无可参考的金标准,无法判断哪种方法纠正后的结果更接近真值,建议在报告中进行相应的描述,仅供临床参考。
冷凝集标本虽然可以通过水浴后稀释、血浆置换、水浴后灌板计数、温浴后稀释等方法进行处理,但这些方法都需要一定的时间,并且人工干预造成的误差也不可控制[1]。本研究15例冷凝集标本通过研究参数换算的方法有14例达到了纠正效果,纠正率>90%,为冷凝集标本的处理提供了一种快速的解决方法。然而,RET通道的RBC直方图显示明显不呈正态分布时,R-MFV不适用,此时可采用水浴或水浴后稀释、血浆置换等方法纠正冷凝集标本。
本研究基于工作中冷凝集标本的处理经验,发现血浆置换优于37 ℃ 30 min水浴的纠正效果,因此将血浆置换法与通过RBC-O、R-MFV计算的MCHC结果进行了比较,发现计算的纠正效果较优,但本研究标本例数较少,未来在实际工作中会不断验证RBC-O与R-MFV的应用价值。

