AS患者sLAIR-1和LAIR-1 mRNA的表达及其与疾病活动度的关系
何亚亚, 陈闪闪, 李永胜, 刘 娟
(1.南京医科大学附属淮安市第一人民医院检验科,江苏 淮安 223300;2.南京医科大学附属淮安市第一人民医院风湿免疫科,江苏 淮安 223300)
强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性、多系统的炎症性自身免疫性疾病,主要影响中轴关节[1]。有研究结果显示,AS的发病过程与T细胞功能障碍密切相关,AS患者外周血辅助性T细胞(T helper cell,Th)17占CD4+T细胞的比例显著增加[2]。此外,固有免疫活化在AS的发病机制中同样发挥着重要作用。来自肠道细菌的脂多糖可通过激活单核细胞和巨噬细胞上的Toll样受体(Toll-like receptor,TLR)4显著增强人白细胞抗原B27(human leukocyte antigen B27,HLA-B27)未折叠蛋白诱发的细胞因子分泌能力。活化的巨噬细胞也促进了白细胞介素(interleukin,IL)-23的分泌和Th17细胞的激活。白细胞相关免疫球蛋白样受体-1(leukocyte-associated immunoglobulin-like receptor-1,LAIR-1)是在多种免疫细胞上表达的免疫球蛋白超家族成员,可通过发挥免疫抑制功能维持T细胞和巨噬细胞等免疫细胞的平衡[3]。LAIR-1可在多种自身免疫性疾病中异常表达,但在AS中是否存在表达异常尚未见相关报道。为此,本研究拟分析血清可溶性白细胞相关免疫球蛋白样受体-1(soluble leukocyte-associated immunoglobulinlike receptor-1,sLAIR-1)和外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中LAIR-1 mRNA表达的变化,及其与AS患者疾病活动度之间的关系;并分析sLAIR-1和LAIR-1 mRNA在抗肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)生物制剂英孚利昔单抗治疗前后的变化,探讨将其定为AS生物标志物的可能性。
1 材料和方法
1.1 研究对象
选取2020年9月—2021年6月南京医科大学附属淮安市第一人民医院AS患者81例(AS组),其中男67例、女14例,年龄(32.58±12.94)岁。AS诊断依据国际强直性脊柱炎协会(the Assessment of Spondyl Arthritis International Society,ASAS)2010年发布的诊断标准[4]。排除标准:合并冠心病、活动性感染、糖尿病、多囊卵巢综合征、肝脏疾病、肾脏疾病和肿瘤等。另选取南京医科大学附属淮安市第一人民医院健康体检者80名(正常对照组),其中男68名、女12名,年龄(31.98±9.65)岁。排除标准:有慢性系统性疾病、任何类型的自身免疫性疾病、感染或恶性肿瘤;有类固醇、细胞毒性药物和免疫抑制剂等用药史。2个组之间年龄和性别差异均无统计学意义(P>0.05)。收集81例AS患者中17例活动期患者英孚利昔单抗(西安杨森制药有限公司)治疗6周后的sLAIR-1和LAIR-1 mRNA检测结果,分析治疗前后LAIR-1水平的变化。本研究经南京医科大学附属淮安市第一人民医院伦理委员会审批,所有对象均签署知情同意书。
1.2 方法
1.2.1 临床资料收集 收集所有对象的一般资料[年龄、性别、吸烟史、体质量指数(body mass index,BMI)等]。收集AS患者的详细病史资料[病程、治疗方案、强直性脊柱炎疾病活动评分(ankylosing spondylitis disease activity score,ASDAS)等]和入院后首次实验室检测结果[白细胞(white blood cell,WBC)计数、淋巴细胞绝对数(the absolute value of lymphocyte,LYMPH#)、中性粒细胞绝对数(the absolute value of neutrophil,NEUT#)、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)计数、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)和HLA-B27]。询问患者是否有炎症性背痛、骶髂关节炎,并评估其抗TNF-α治疗疗效。疾病活动指标包括晨僵的持续时间、医生的整体评估(0~10分)、患者的整体评估(0~10分)、ASDAS、CRP及关节压痛和肿胀计数。ASDAS是评价AS疾病活动度新的综合指标[5],包括5项:(1)总体腰背痛程度;(2)患者总体评价;(3)外周关节疼痛肿胀程度;(4)晨僵持续时间;(5)ESR或CRP。ASDAS分为基于ESR(ASDAS-ESR)和基于CRP(ASDAS-CRP)2种评分方式,其中准确性更高的是ASDAS-CRP,计算公式为:ASDAS-CRP=0.12×腰背痛评分+0.06×晨僵持续时长+0.11×患者总体评价+0.07×外周关节肿胀/疼痛+0.58×ln(CRP+1)[6]。
1.2.2 样本采集 采集所有患者入院治疗前、正常对照者体检当日的清晨空腹静脉血6 mL,其中3 mL置于乙二胺四乙酸抗凝管中,用于LAIR-1 mRNA检测;另外3 mL置于干燥管中,离心分离血清后,保存于-80 ℃冰箱,用于血清sLAIR-1、IL-6及IL-17检测。
1.2.3LAIR-1 mRNA检测 采用荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测LAIR-1 mRNA。取1.0 mL乙二胺四乙酸抗凝血,与等体积磷酸盐缓冲液混匀,缓慢加入Ficoll淋巴细胞分离液,密度梯度离心(400×g离心30 min),收集的中间层细胞即为PBMC。采用Trizol试剂(美国ThermoFisher Scientific公司)提取PBMC总RNA,采用iScript cDNA Synthesis kit(美国伯乐公司)将RNA逆转录为cDNA。采用SYBR Green PCR kit(美国伯乐公司)及ABI 7500荧光定量PCR仪(美国ABI公司)进行PCR扩增。反应条件:预变性95 ℃30 s,变性95 ℃ 5 s,40个循环;退火60 ℃30 s。PCR引物由生工生物工程(上海)股份有限公司合成。以β-actin为内参,采用2-ΔΔCt法计算LAIR-1 mRNA的相对表达量。严格按仪器和试剂盒说明书进行操作。 引物序列见表1。
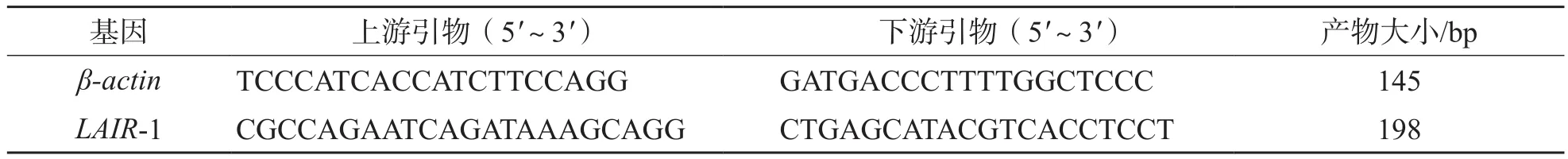
表1 引物序列
1.2.4 sLAIR-1、IL-6及IL-17检测 采用酶联免疫吸附试验检测血清sLAIR-1和IL-17水平,试剂盒购自美国R&D公司(货号分别为DY2664-05、D1700)。采用cobas e602全自动电化学发光分析仪(瑞士罗氏公司)及配套试剂检测血清IL-6水平。严格按仪器和试剂盒说明书进行操作。
1.2.5 活动期AS患者英孚利昔单抗治疗前后sLAIR-1和LAIR-1 mRNA的变化 从81例AS患者中选取17例活动期患者,均为男性,年龄(27.71±5.89)岁。采用抗肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)生物制剂英孚利昔单抗治疗6周。分析治疗前后sLAIR-1和LAIR-1 mRNA的变化。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用独立样本t检验,多组间比较采用方差分析。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Mann-WhitneyU检验。采用Spearman相关分析评估sLAIR-1、LAIR-1 mRNA与各项指标的相关性。AS患者英孚利昔单抗治疗前后各项指标比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AS组和正常对照组临床资料比较
AS组病程为8.00(3.50~61.00)个月,医生整体评价为(5.35±2.04)分,患者整体评价为(6.28±2.11)分,晨僵时长为33(16~47)min,压痛关节数为(2.25±1.58)个,肿胀关节数为(2.18±1.93)个,ASDAS-CRP为(2.98±1.30)分。81例AS患者中,22例(27.16%)有家族史,36例(44.44%)伴外周关节累及,28例(34.57%)合并葡萄膜炎,14例(17.28%)合并肌腱炎。AS组WBC计数、LYMPH#、PLT计数、CRP和ESR高于正常对照组(P<0.05),2个组之间BMI、吸烟史和NEUT#差异均无统计学意义(P>0.05)。见表2。
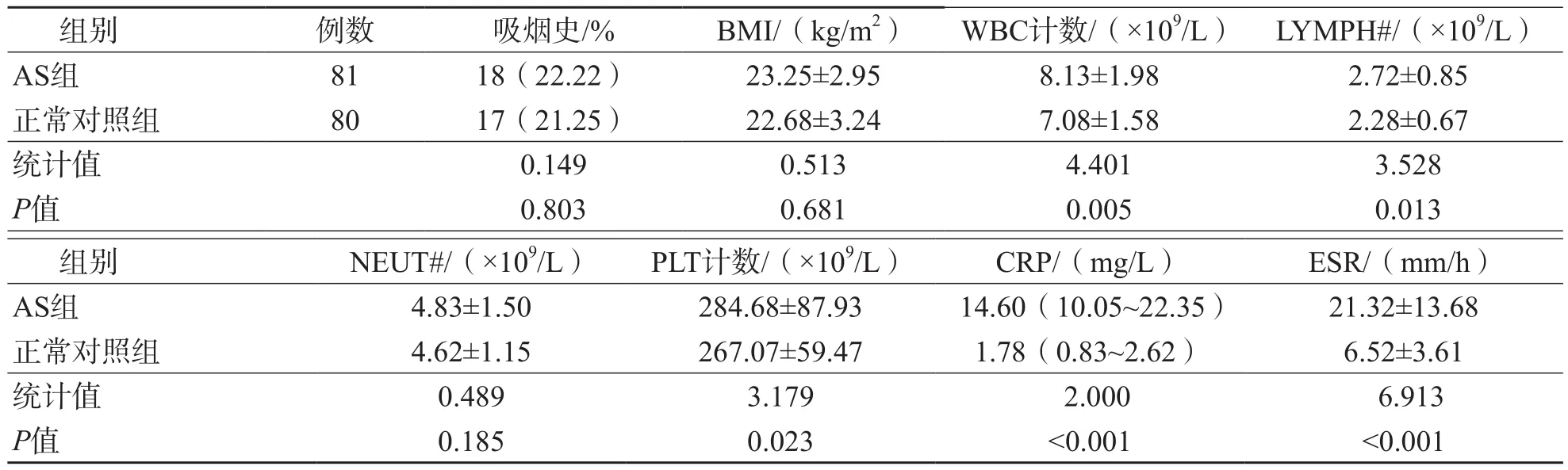
表2 AS组与正常对照组临床资料比较
2.2 AS组和正常对照组sLAIR-1、LAIR-1 mRNA 、IL-17及IL-6水平比较
AS组血清sLAIR-1、IL-17及IL-6水平显著高于正常对照组(P<0.001),而LAIR-1 mRNA水平则显著低于正常对照组(P<0.001)。见表3。
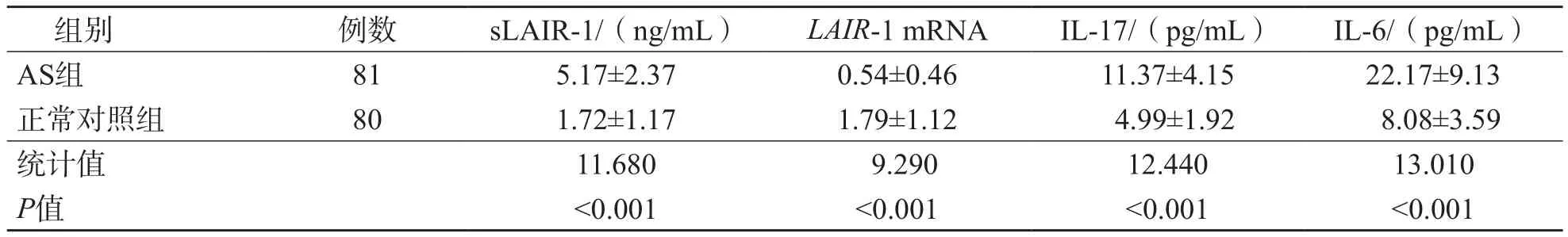
表3 AS组与正常对照组sLAIR-1、LAIR-1 mRNA 、IL-17及IL-6水平比较
2.3 AS患者sLAIR-1和LAIR-1 mRNA与各项指标之间的相关性
Spearman相关分析结果显示,sLAIR-1与IL-17、IL-6、CRP、ASDAS-CRP呈正相关(r值分别为0.482 4、0.475 3、0.391 6、0.565 7,P<0.01),与LAIR-1 mRNA呈负相关(r=-0.446 6,P<0.001);LAIR-1 mRNA与IL-17、IL-6、CRP、ASDAS-CRP呈负相关(r值分别为-0.399 6、-0.227 8、-0.265 1、-0.366 8,P<0.05)。sLAIR-1、LAIR-1 mRNA与WBC计数、LYMPH#、PLT计数及ESR均无相关性(P>0.05)。
2.4 活动期AS患者采用英孚利昔单抗治疗前后sLAIR-1和LAIR-1 mRNA的变化
与治疗前比较,AS患者采用英孚利昔单抗治疗6周后,血清sLAIR-1水平显著下降(P=0.000 2),LAIR-1 mRNA水平显著升高(P=0.001 1)。见图1、图2。

图1 活动期AS患者英孚利昔单抗治疗前后血清sLAIR-1的变化

图2 活动期AS患者英孚利昔单抗治疗前后LAIR-1 mRNA的变化
3 讨论
LAIR-1属于免疫抑制性受体家族成员,可调节免疫系统平衡,防止免疫反应过度可能导致的组织损伤或自身免疫功能紊乱[7]。LAIR-1在大多数免疫细胞中均有表达,包括自然杀伤细胞、T细胞、B细胞、单核细胞和CD34+造血祖细胞[3],LAIR-1活化已被证明可抑制此类免疫细胞的功能[8]。胶原蛋白是LAIR-1的功能性配体,在体外可直接抑制免疫细胞的激活。此外,LAIR-1还能识别具有胶原蛋白结构的蛋白质,如经典补体途径成分C1q[9]。LAIR-1交联会抑制T细胞受体介导的信号传递,B细胞产生IgG、IgE,自然杀伤细胞对靶细胞的裂解[10]。此外,LAIR-1交联和C1q刺激还可抑制浆细胞样树突状细胞释放α干扰素以及单核细胞经TLR9刺激后产生细胞因子[11-12]。在健康人和类风湿性关节炎(rheumatoid arthritis,RA)患者的血浆和尿液中均可检测到sLAIR-1。OLDE NORDKAMP等[13]的研究结果显示,RA患者尿液LAIR-1水平显著高于健康人(P<0.001),并与炎症标志物ESR明显相关。过度表达LAIR-1可降低包括IL-6、IL-8和基质金属蛋白酶-13在内的炎症因子的表达[14]。由此可见,LAIR-1在RA中主要发挥抗炎作用。RA患者CD4+T细胞LAIR-1水平下降,对T细胞激活的抑制不足,促进了自身免疫性疾病的进展[15]。在胶原蛋白的刺激下,CD4+T细胞LAIR-1表达明显上调,用刺激性LAIR-1单克隆抗体共培养时,CD4+T细胞分泌的IL-2、γ干扰素(interferon-gamma,IFN-γ)和IL-17水平显著下降[15]。动物实验结果表明,用刺激性LAIR-1单克隆抗体治疗可减弱LAIR+/+小鼠由胶原蛋白诱发的关节炎[15]。本研究结果显示,AS患者sLAIR-1显著升高(与RA患者情况相同[16]),LAIR-1 mRNA则显著下降,并且这2种形式的LAIR-1与炎症因子均显著相关,与疾病活动度高度相关,提示sLAIR-1或能作为AS疾病活动度评价的潜在指标。
AS的发病机制目前尚不清楚,LAIR-1异常表达的原因可能是:(1)LAIR-1调控免疫细胞介导的炎症反应,可抑制IL-6、IL-17等促炎细胞因子的分泌,而LAIR-1mRNA表达下降可能会导致这种平衡被打破,促进AS发展;(2)AS特有的炎症微环境可显著改变LAIR-1的表达,异常变化的LAIR-1失去了调控功能,导致免疫失衡加剧。在未来的研究中,建议对AS动物模型给予LAIR-1的阻断型抗体或重组蛋白,抑制其表达,以验证其是否可以作为AS的治疗靶点。此外,本研究还发现,AS患者sLAIR-1显著上调,而LAIR-1 mRNA显著下降。LAIR-1 mRNA下降可能是由CD4+T细胞、CD8+T细胞和单核细胞等表面LAIR-1表达下调引起,这与先前在多种自身免疫性疾病中的研究结果[17-18]一致。sLAIR-1表达上调虽在RA中也有发现,但原因尚不清楚,推测可能是因为PBMC中呈游离状态的LAIR-1与非游离状态的LAIR-1竞争结合型配体,进一步削弱PBMC中非游离状态LAIR-1的免疫抑制信号和生物功能,加剧了炎症反应和免疫失衡。目前尚未见sLAIR-1是否可以同样发挥炎症抑制作用的相关报道。在下阶段的研究中,我们将利用LAIR-1刺激体外分离的AS患者的PBMC,分析细胞因子的分泌情况。另外,本研究发现,活动期AS患者经英孚利昔单抗治疗后,sLAIR-1水平显著下降,趋于正常化,但其中有3例患者治疗前后无差异,甚至有所上调。分析这3例患者的临床资料后发现,患者治疗后疾病活动度并无显著变化,推测可能是英孚利昔单抗治疗的耐受患者。
本研究还有一些不足之处:(1)纳入随访的病例相对较少,且未追踪1个完整疗程(30周)后LAIR-1的表达情况;(2)未研究AS患者炎症组织中LAIR-1的表达情况;(3)PBMC中LAIR-1 mRNA下调,但本研究未采用流式细胞术分析各细胞表面LAIR-1的表达情况;(4)未分析17例英孚利昔单抗治疗6周后患者LAIR-1表达水平与炎症指标和临床指标的相关性;(5)本研究为单中心前瞻性研究,结果尚需多中心大样本研究加以验证;(6)受限于治疗随访数,未分析sLAIR-1是否可作为预测英孚利昔单抗治疗反应性的标志物。
综上所述,LAIR-1水平与AS疾病活动度密切相关,提示其或可作为临床评估AS患者疾病活动度的辅助指标。本研究也为未来深入研究LAIR-1与AS发病机制的关系奠定了一定基础。

