去泛素化酶UL36的抑制剂LDN57444抑制马立克氏病病毒的增殖
王文婧,范青松,刘宇航,王 婷,邓国辉,谢知航,王梦涵,吕 岩,许家翠,艾永兴
(吉林大学 动物科学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062)
马立克氏病病毒(Marek's disease virus,MDV)血清Ⅰ型致病性强毒株(virulent)可引起鸡发生马立克氏病(Marek's disease,MD),感染鸡主要表现为多脏器的多发性肿瘤及病毒侵害神经系统引起的神经麻痹[1]。MDV常通过粉尘经呼吸道进入鸡机体,感染B淋巴细胞引起感染性裂解,且易感T淋巴细胞,在T淋巴细胞中增殖,并浸润传播致全身,引起多脏器的肿瘤,侵害神经细胞,入侵羽毛囊细胞经包装释放具有传染性的完整病毒颗粒。此外,MDV在感染过程中也造成鸡免疫系统受损,并常诱发其他病原体的合并感染,进而加重病情引起死亡[1]。MDV血清Ⅱ型和血清Ⅲ型毒株SB-1和HVT最早被开发成MD疫苗,可成功地预防MD的发生[2-3]。而血清Ⅰ型毒株如CVI988/Rispens株与814株被开发成疫苗使防御MD更加有效[2-3]。不过这些疫苗只能防止MD症状的出现,却不能阻止MDV对鸡的感染以及MDV在鸡细胞内的增殖、变异、成熟和释放,从而使疫苗免疫鸡成为新的传染源。同时,经过这种免疫压力和不断的循环淘汰,目前也已出现了毒力更强的超强(very virulent,vv)和超超强(very virulent plus,vv+)MDV毒株[2-5]。这些vv和vv+型毒株可引发感染鸡在肿瘤症状还未出现就发生急性死亡[2-3,6],而经典的SB-1和HVT两种MD疫苗的单用或合用均已无法抵御这些强毒,最有效的CVI988/Rispens疫苗免疫鸡群也常有再次暴发MD的报道[6-7]。另外,已有多例报道,MDV还可与其他禽类的病毒发生重组形成新型毒株,这些情况使得MD的防御更加困难[8-10]。因此,增强MD的防御效果除了加强新型疫苗的研发,研制可直接抗MDV的药物以弥补MD疫苗的短板与加强MD疫苗防御效果,是养禽业防御MD的重要任务。
根据MD疫苗防御机制以及MDV感染与致病机制,可推断,抑制MDV的感染或阻断MDV在细胞内的生命进程,如在MDV感染早期或在T细胞内的潜伏期即扼制MDV的增殖,不但可以减少或防止MDV引起的B细胞增殖性裂解,也可阻止经T细胞浸润在各组织脏器间的传播。由于疫苗接种需要经数日“窗口期(interval)”方可产生免疫效果,因而这段时间对于MDV的早期感染增殖具有重要意义[11],而使用化学药物弥补疫苗接种 “窗口期”以及扼制细胞内病毒的增殖是最迅速、最直接的手段。近年来,也有使用化学药物防御MD的研究[12-14]。随着MDV致病机制的逐渐阐明,可利用的靶点也不断被发现,其中,MDV编码的病毒型去泛素化酶UL36与MDV的增殖、成熟、致病等过程密切相关[15-16]。通过突变破坏其去泛素化酶活性可以降低MD的发生率,减少MDV水平传播[16]。研究发现,UL36的N端去泛素化酶片段(包含催化结构域和核定位信号的480个氨基酸片段,UL36-480)具有去泛素化酶活性[17],且UL36-480片段在所有致病型MDV株中完全一致,与非致病血清Ⅱ型和Ⅲ型毒株则完全不同,与宿主鸡的所有去泛素化酶的氨基酸序列也完全不同[17],这些发现为将UL36-480作为靶点用于抗MDV研究提供了可靠的依据。为提高中靶几率,本研究选择蛋白酶抑制剂库为初筛库,经高通量筛选出对UL36-480活性具有抑制作用的化合物LDN57444,并在细胞和动物水平确定出LDN57444对MDV增殖的抑制作用,该发现为进一步研制抗MD药物提供了重要依据。
1 材料与方法
1.1 动物、细胞和毒株9~10日龄SPF鸡胚与1日龄SPF雏鸡购于北京Boehringer Ingelheim生物技术有限公司;MDV-J1株购于北京市农林科学院畜牧兽医研究所,液氮保存。
1.2 主要试剂与仪器蛋白酶抑制剂初选库购于MCE(中国)皓元生物公司;Ub-Rhodamine110底物为R&D公司产品;UL36-480去泛素化酶和去泛素化酶切反应缓冲液10×Reaction Buffer(500 mmol/L HEPES,1 g/L BSA,5 mmol/L EDTA,10 mol/L DTT)由本实验室制备[17];常用分析纯化学试剂均购于鼎国公司和Sigma-Aldrich公司; CCK-8细胞活力检测试剂盒为Abace生物公司产品;DMEM、SYBR GreenERTMqPCR SuperMix Universal试剂盒、蛋白质相对分子质量标准26610、Gibco胎牛血清(FBS)和DNA聚合酶等为Thermofisher公司产品;E.Z.N.A.Viral DNA Kit为OMEGA公司产品;鸡淋巴细胞分离液为天津灏洋华科生物公司产品;6,96和384孔板为Corning公司产品;多功能微孔板酶标仪-Infinite 200 PRO由TECON公司生产。
1.3 载体和引物用于MDV 基因组定量分析的标准质粒为前期研究构建[17],包含有UL36的N端去泛素化酶480个氨基酸片段(UL36-480)的质粒pFAST-Bac1-UL36-500。用于定量PCR分析用引物由Genewiz公司合成(UL36 F:5′-AGTCCTGCGTCTTCAGTT-3′和UL36 R:5′-CAGAAG-TCGCTATTGTCC-3′)。
1.4 对UL36-480具有抑制作用化合物的筛选以UL36-480酶解Ub-Rhodamine110底物反应体系为基础[17],以化合物浓度低于114 μmol/L对UL36-480的去泛素化酶水解反应具有抑制作用,视为有效抑制作用[18];反应程序为,在384微孔反应板上,先将每孔加入不同化合物≤114 μmol/L、3.5 nmol/L UL36-480、2 μL 10×Reaction Buffer,加超纯水至18 μL,在4℃孵育1 h, 然后每孔同时补加2 μL 终浓度为0.6 μmol/L的Ub-Rhodamine110振荡混均,再置于多功能微孔板酶标仪上检测荧光。筛选出对UL36-480酶反应有抑制作用的化合物,再对筛选出的化合物进行梯度稀释,以确定可抑制UL36-480活性化合物的最低有效浓度。
1.5 LDN57444对UL36-480的酶抑制动力学分析根据上述高通筛选,本研究确定使用4 μmol/L浓度的LDN57444,此条件下对UL36-480的活性具有显著的抑制作用。抑制动力学分析反应体系,应用不同浓度(0.1,0.2,0.4,0.6,0.7,0.8 μmol/L)荧光底物Ub-Rhodamine110,UL36-480终浓度为3.5 nmol/L,再加入上述10×Reaction Buffer,补灭菌超纯H2O至100 μL。反应条件:先将不含Ub-Rhodamine110但包括LDN57444与UL36-480等所有反应成分的体系在4℃孵育1 h,然后37℃孵育2 min恢复反应所需温度,每孔加入等体积但不同浓度的Ub-Rhodamine110后快速混均,将反应孔板置于读板仪上检测荧光值。检测数据应用GraphPad Prism 8.0软件计算各动力学参数并拟合相应曲线,根据抑制前后的Vmax和Km值分析LDN57444对UL36-480的抑制方式。对于非竞争性抑制按公式Ki=[I]/(Vmax/Vmaxinh-1)计算Ki值,其中Vmaxinh为含有抑制剂时UL36-480的最大反应速度,Vmax为无抑制剂情况下的最大反应速度,[I]抑制剂浓度,Ki为抑制常数[19]。应用Cheng-Prusoff方程和Ki值换算出IC50(50%酶活性被抑制时化合物浓度)[20-21],对于非竞争性抑制使用公式IC50=Ki(1+Km/[S]),其中[S]为底物浓度,Km为米氏常数。
1.6 LDN5744与UL36-480互作分析首先应用Modeller(v10.2)(https://salilab.org/modeller)对UL36-480进行建模,然后将产生的结构文件进行去除水分子、加氢、修饰氨基酸、优化能量和调整力场参数等常规处理,导出PDB文件。从Pubchem(https://pubchem.ncbi.nlm.nih.gov)获取LDN57444化学结构数据文件,并应用Discovery Studio 2019转换成mol2格式文件。应用AutoDock Vina (v.1.2.0) ( https://vina.scripps.edu)对这两个文件进行分子对接,分析互作位点、互作力以及最低结合能。分析结果导出成PDB文件,应用Discovery Studio 2019进行结合面、互作力分析以及可视化展示,并制图。
1.7 LDN57444对CEF细胞安全浓度确定CEF细胞根据常规方法从9~10日龄的SPF鸡胚分离制备[22]。96孔细胞培养板中每孔铺入3×104个CEF细胞,用培养基将LDN57444稀释成浓度梯度(1~100 μmol/L),待细胞贴壁后更换含有梯度浓度LDN57444的培养基,终体积为至100 μL,37℃培养3 d。用显微镜观察细胞状态,并参照CCK8使用说明,每个处理孔分别加10 μL的 CCK8检测液,于37℃孵育2 h,应用酶标仪检测450 nm的吸光值,计算细胞活力,应用GraphPad Prism 8.0软件作图。根据通用标准,细胞活力>90%视为无显著影响[23],用于判断LDN57444对CEF细胞的毒性。
1.8 LDN57444对MDV的CPE的影响取新鲜制备的CEF细胞按106个/孔浓度铺入6孔板,过夜培养至贴壁形成单层后,将给药组培养基分别更换为含有不同浓度LDN57444的培养基,对照组更换为含等体积的DMSO但无LDN57444培养基,以20 PFU/每孔接MDV-J1毒株,3 d后在显微镜下观测MDV的CPE数量和面积等参数。应用GraphPad Prism 8.0软件进行统计分析作图,每个处理3次重复实验。
1.9 细胞水平LDN57444对MDV增殖的影响首先将质粒pFAST-Bac1-UL36-500浓度换算成拷贝数浓度,换算公式如下:拷贝数浓度(copy/μL)=质粒质量浓度(g/μL)÷质粒相对分子质量×NA(阿伏伽德罗常数),再以梯度拷贝数(103,104,105,106,107,108,109)质粒作为模板进行Q-PCR。以拷贝数的log值为横坐标,Ct值为纵坐标,应用GraphPad Prism 8.0软件拟合标准曲线和方程,每个处理进行3次重复试验。具体反应条件参考Q-PCR试剂盒说明。细胞中MDV基因组DNA的提取方法参照试剂盒明书进行,每个孔细胞的全程处理条件保持一致。对每孔所提取的基因组DNA取等体积(0.5 μL)作为模板,应用上述定量引物进行Q-PCR,应用拟合的标准曲线方程将所检测的各组Ct值换算成拷贝数,每组试验进行3次重复。
1.10 LDN57444对鸡体内MDV增殖的影响取1日龄SPF雏鸡随机分为3组,每组5只,隔离饲养,均在1日龄按100 PFU/只经腹腔接种MDV-J1毒。根据前期药物安全剂量预试验结果并参考相关文献[24-25],其中两组分别每日腹腔给药0.1 mg/kg和0.5 mg/kg的LDN57444的鸡为试验组,无药物处理只腹腔注射等量灭菌生理盐水(含等量DMSO)为对照组,给药至第14天。鸡均在第21天采集鸡外周抗凝血,按照鸡淋巴细胞分离液说明书分离T淋巴细胞,每组取104个T淋巴细胞提取基因组,参照1.9步骤进行Q-PCR检测分析。
2 结果
2.1 LDN57444抑制UL36-480的去泛素化酶活性从3 000多个蛋白酶抑制中筛选出LDN5744可在远低于114 μmol/L浓度条件下抑制UL36-480的去泛素化酶活性。应用终浓度4 μmol/L的LDN57444作为酶抑制反应动力学分析抑制剂尝试,分析对3.5 nmol/L的UL36-480酶活性的抑制作用(如图1),在无抑制剂条件下,UL36-480的Vmax为4.022 nmol·L-1·s-1,Km为0.691 μmol/L;在应用4 μmol/L的LDN57444处理后,UL36-480的Vmaxinh为2.515 nmol·L-1·s-1,Km为0.685 μmol/L,据此判定LDN57444对UL36-480的抑制属于非竞争性抑制。经公式计算,LDN57444对UL36-480的抑制常数Ki值为6.68 μmol/L,IC50为3.10 μmol/L。
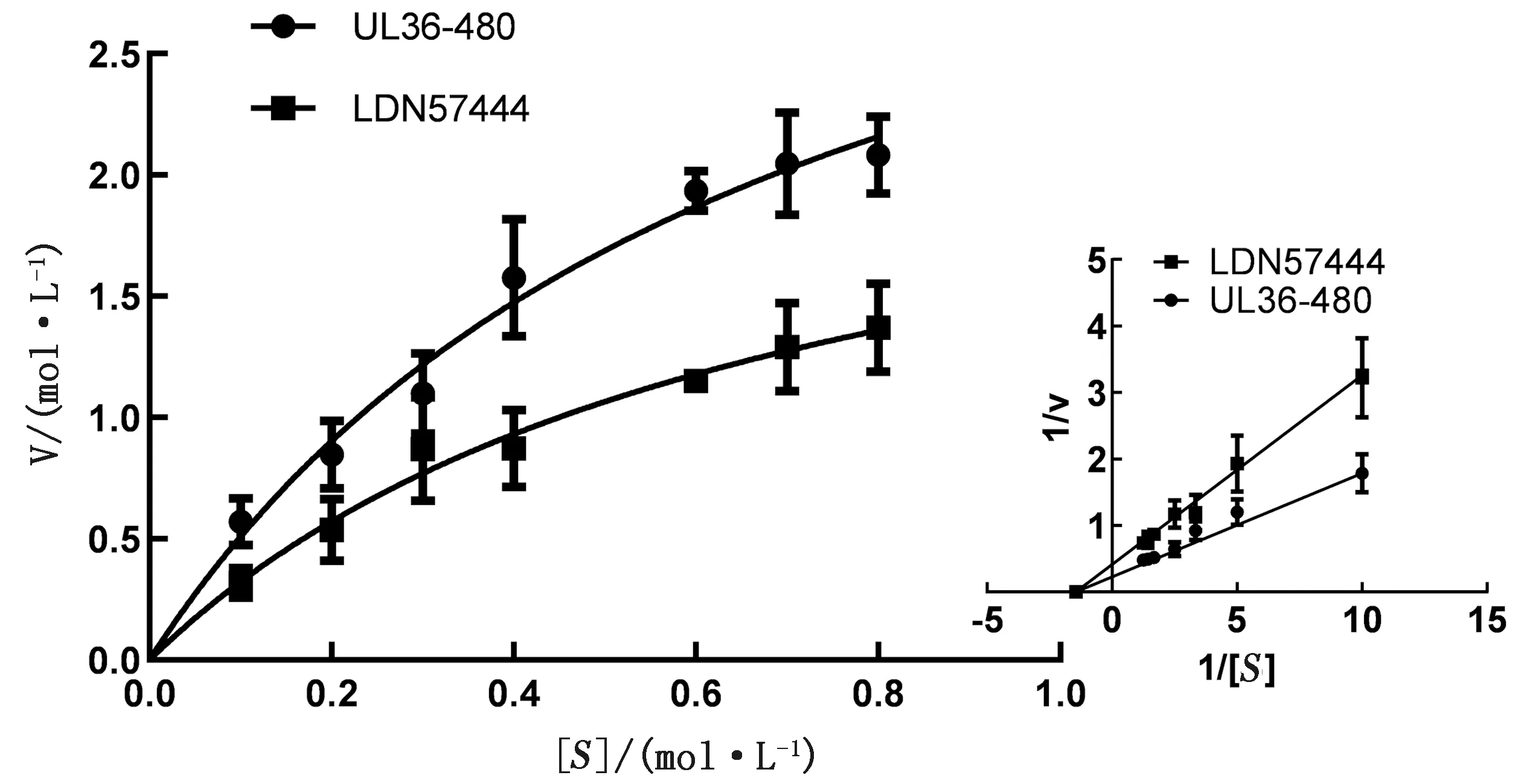
左图.米氏方程曲线;右图.双倒数拟合曲线。V.初始反应速度;[S].底物浓度;UL36-480.无抑制剂处理组;LDN57444.LDN57444处理组
2.2 LDN57444与UL36-480分子互作经对UL36-480同源建模,再与LDN57444进行分子对接,筛选出对接的结合能最低为-28.9 kJ/mol,蛋白质在模拟过程中的构象与初始构象之间的位置变化均方根误差(RMSD)=0。根据互作分析可见,LDN57444与UL36-480的互作位置位于UL36-480的C端一侧的结构域,并不与UL36-480的N端催化活性中心直接互作,这一发现与上述抑制动力学分析所得的非竞争性抑制结果相吻合(图2A)。根据互作面分析可见,LDN57444位于UL36-480的C末端由ILE301、PRO329、ARG330、LYS333、THR404、HIS405、VAL449、ARG464、ASN465、AYR466形成的口袋中(图2B)。进一步的分子作用力揭示,LDN57444主要与UL36-480的ARG-464和HIS-405形成氢键(hydrogen band)作用,与VAL-449形成Pi-Sigma作用,与TYR-466形成Pi-Pi堆积作用,与ILE-301形成Pi-Alkyl作用进而抑制UL36-480的活性(图2C,D)。
2.3 LDN57444抑制MDV在CEF细胞中的复制应用CEF细胞确定了LDN57444对细胞的安全浓度,CCK8法分析发现培养基中含小于30 μmol/L LDN57444的条件下,细胞活力大于90%(如图3),因此,后续LDN57444的细胞水平试验使用低于30 μmol/L 的药物浓度。应用5 μmol/L和20 μmol/L 的LDN57444处理MDV致CEF的CPE,镜下可见CPE数量减少,面积减小(图4)。对每个处理孔中所有CPE的总面积进行统计分析发现,与无药物处理组(对照组)相比,LDN57444显著抑制CPE的形成(P<0.01),对照组CPE平均122个,而LDN57444处理组的CPE个数和CPE平均面积都显著低于对照组(表1,P<0.01)。应用含有UL36基因的标准质粒进行拷贝数梯度稀释,进行定量PCR,并与Ct之间建立的标准曲线方程y=43.131-1.702ln(x),其中y为Ct值,x为拷贝数[26]。应用各处理组细胞的基因组作为模板,并进行定量PCR,根据标准曲线方程换算各处理孔中MDV的拷贝数,结果发现5,20 μmol/L的LDN57444处理的MDV拷贝数显著低于对照组(P<0.01),分别下降39倍和2 679倍(表2)。说明在CEF细胞中MDV的增殖受LDN57444的显著抑制。

图3 不同浓度LDN57444条件下CEF细胞活力分析

A.无LDN57444处理的对照组;B.5 μmol/L LDN57444处理组;C.20 μmol/L LDN57444处理组

表1 LDN57444对MDV致CEF细胞CPE形成的影响
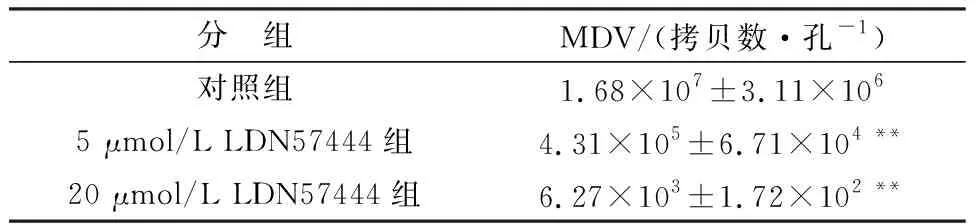
表2 LDN57444对CEF细胞中MDV增殖的影响
2.4 LDN57444抑制MDV在鸡体内的复制如果如表3所示,与对照组相比,LDN57444处理组的T细胞中MDV基因组拷贝数显著降低(P<0.01),0.1 mg/kg LDN57444给药组降低了29倍,0.5 mg/kg LDN57444给药组降了1 315倍,表明应用LDN57444药物处理可显著抑制 MDV 在鸡体内的增殖。

表3 LDN57444对MDV在T淋巴细胞中复制的影响
3 讨论
泛素化修饰及其调控机制涉及细胞几乎所有的生命进程和活动,包括染色质重塑与转录调控、免疫与炎症调节、各种病原感染与致病、细胞增殖与凋亡调控等等[27]。而泛素化修饰与去修饰过程是由泛素化修饰3种酶与去泛素化酶调节反应的平衡,任何因素打破这种平衡都可能会引起疾病。而许多病原体也可以通过掌控宿主细胞的这种调控机制为自身的生命进程服务,如感染、增殖、成熟、释放等过程[27]。很多病原体本身也编码泛素化相关酶和去泛素化酶,但这些病原体的酶类与宿主细胞并无序列和结构上的同源性,从而使这些病原体更易逃避宿主的免疫识别与清除,而当许多研究揭示这些病原体的致病机制时,这些酶也便成为了可用于研发药物的靶点[17,19,28-33]。因此,多年来,随着泛素化修饰与去修饰研究的进展,相应的药物研发也同步进行,以期尽早获得更有效的靶向药物。
在抗病毒研究方面,研究发现,SARS-CoV 编码的PLpro是一种病毒型的去泛素化酶,6MP和6TG可以通过抑制PLpro的去泛素化酶活性进而用作抗SARS-CoV 的药物[34]。而在SARS-CoV-2冠状病毒编码的3Clpro酶同样也可作为抗病毒抑制剂筛选的临床研究[35]。HIV-1酶也是作为抗HIV药物的筛选靶点,利用该靶点筛选出的特异性药物saquinavir已经用于临床,同时还筛选出了具备抗肿瘤和抗HIV的抑制剂ritonavir[36]。而化合物PR-619可抑制血吸虫编码的去泛素化酶SmUSP9x的表达以及虫源泛素E3连接酶SmSmad2的活性,从而抑制寄生虫的产卵,导致线粒体变化,自噬体形成,因此,靶向虫源的去泛素化酶可为从全新角度开发抗血吸虫病新药拓展了思路[37]。
M.V编码的UL36是MDV结构中一种分子量较大的被膜蛋白,由MDV的MDV049基因编码,该蛋白包含3 000多个氨基酸,但感染宿主细胞后却以N端约70 kDa的长度存在,其机制目前还不清楚[38]。此片段包含去泛素化酶活性中心(UL36-USP),而其N-端480个氨基酸片段同时还包含一个核定位信号序列[38],这种催化活性结构域在大部分疱疹病毒中均存在,不过在MDV的致病毒株与非致病毒株之间,氨基酸序列却不相同,UL36-USP的催化活性对病毒的感染、复制和成熟等过程具有重要作用[39-40]。MDV编码的UL36的C98是其催化活性中心位点,附近的Q85、L106、D232和H234这4个位点对UL36的去泛素化酶活性也至关重要,这些位点的突变均可破坏MDV的致瘤作用,阻止MDV在宿主细胞内的增殖,病毒颗粒成熟受阻,传播能力下降[41]。由于UL36去泛素化酶活性片段在所有血清Ⅰ型的致病毒株中完全保守[42],因此,UL36的N端去泛素化酶片段(UL36-480)可作为抗MDV药物研发的潜在靶点。
根据上述研究策略,本研究与公司合作初步应用蛋白酶抑制剂库建立初筛库,并由公司合成,使用384孔板的微量特点结合灵敏的特异荧光底物反应,快速筛选出LDN57444对UL36-480具有显著的抑制作用。研究发现LDN57444是泛素C端水解酶UCH-L1和UCH-L3抑制剂,LDN57444可通过抑制UCH-L1调节自噬途径进而影响神经细胞中α突触核蛋白(alpha-synuclein),因此,被认为在帕金森病(Parkinson's disease,PD)发生发展过程起到调节作用,可以作为PD的靶向药物[43-45]。LDN57444还对肺癌H1299细胞增殖具有显著的抑制作用[46]。LDN-57444 也可以通过抑制 UCHL1减弱小鼠房颤[25],通过调节HIF-1α信号通路保护缺血性心脏损伤[47]。LDN57444 还可通过调节氧化应激和线粒体功能以及降低 ERK1/2 表达来阻碍小鼠卵母细胞成熟[48]。LDN57444通过抑制UCH-L1和UCH-L3活性调节抗凝血酶蛋白表达量进而用于血友病一类凝血疾病的治疗[49]。目前有关LDN57444的报道主要集中于通过抑制UCH-L1活性进行调节与自噬、抗氧化等相关通路的作用,还未见任何有关抗病毒的研究报道。而本研究从数千个化合物中筛选到LDN57444可抑制MDV编码的UL36的去泛素化酶活性,也是本研究领域首次发现,为LDN57444作为抗病毒靶向药物研究开辟了新思路。同时为揭示这些病毒编码的蛋白活性特点,阐明其对宿主细胞的调控机制,对于理解病毒致病机制,研发靶向药物提供了重要依据。
鸡细胞内含有数百种去泛素化酶,目前已报道LDN57444可抑制人的UCH-L1活性进而影响相关的调节通路,有研究发现UCH-L1属于癌基因有助于细胞恶性增殖,并且在KSHV 和EBV等病毒感染时会表达量升高[50]。鸡与人的UCH-L1在氨基酸序列上只有75%保守性,目前还不清楚LDN57444是否也可抑制鸡的UCH-L1活性,并参与了抑制MDV在鸡细胞内增殖及致病的作用。除了抑制MDV的UL36,是否还通过抑制细胞内其他去泛素化酶或其他类型的酶进而抑制MDV在宿主细胞内的增殖,还需要进一步的研究予以揭示。在MD鸡模型水平的研究发现,使用LDN57444可显著抑制MDV在鸡T细胞内的增殖,鸡内脏并未出现MD的病变,但可见肝脏、肾脏及肠道有少量出血,因为在对照组并未见这种现象,因此,这种病变可能与LDN57444毒性有关。因此,进一步研究分析此病变的原因以及LDN57444在动物水平的毒理学,可为LDN57444在未来的临床使用提供重要依据。
LDN57444除了可抑制人的UCH-L1和UCH-L3以及本研究中MDV编码的UL36,是否也能抑制其他动物病毒的去泛素化酶,目前还未见报道,因此,本研究提供的研究方法及研究结果也可为其他动物病毒病的靶向药物研究提供参考。

