基于高通量测序技术分析食物蛋白诱导性直肠结肠炎患儿肠道菌群特征
陈顺丽 汤正珍 黄波 赵兴艳 陈寿珊
(1.遵义医科大学研究生院,贵州遵义 563000;2.遵义医科大学第三附属医院/遵义市第一人民医院儿科,贵州遵义 563000)
食物蛋白诱导性直肠结肠炎(food proteininduced proctocolitis,FPIP)是由免疫反应介导的一种或多种食物蛋白引起的远端直肠结肠黏膜炎症改变[1],在母乳喂养的婴儿中很常见,约占60%[2],通常在出生后6个月内出现临床症状,在1~4周龄时大便中出现间歇性血丝,患儿一般状况好,无体重减轻,约22%的母乳喂养婴儿存在湿疹[3],目前有关FPIP 发病机制尚不明确,认为主要与非免疫球蛋白(immunoglobulin,Ig)E介导有关[4]。治疗措施主要为母亲规避可疑过敏原或者患儿进食深度水解蛋白奶粉。研究发现FPIP 患儿口服乳酸杆菌能缓解症状[5],其机制尚不清楚。临床中发现部分母亲规避食物蛋白后患儿仍反复血便,对此尚无特效方法。
近几年,随着过敏性疾病(其中包括FPIP)的发生率逐年增加,肠道菌群与过敏性疾病的关系是研究的热点[6];食物过敏包括IgE 介导和非IgE 介导;研究显示IgE 介导的过敏患儿的肠道菌群中双歧杆菌、乳杆菌等专性厌氧菌明显降低[7]。FPIP作为非IgE介导的过敏性疾病之一,是否存在肠道菌群失衡,目前尚未见报道。本研究拟通过高通量测序技术探究FPIP 患儿与健康婴儿肠道菌群的差异性特征,进一步探讨肠道菌群与FPIP 发病的相关性。
1 资料与方法
1.1 研究对象
采用前瞻性病例对照研究设计,选取2018 年10 月至2021 年2 月我院儿科门诊就诊的FPIP 患儿31 例作为FPIP 组,诊断标准参照《食物过敏相关消化道疾病诊断与管理专家共识》[3];按照随机数字表法另选取同期我院儿童保健科行健康体检的婴儿31 例作为健康对照组,近2 周无任何消化道症状。该研究已获得遵义市第一人民医院伦理委员会批准(2021-024)并取得入组婴儿家属知情同意。
1.2 纳入标准
(1)两组婴儿(月龄<6 个月)均为纯母乳喂养,未添加任何辅食;(2)取样前1周患儿母亲饮食基本无变化;(3)入院前2周患儿及其母亲均未使用过抗生素、类固醇激素、中草药或益生菌制剂及饮品;(4)FPIP 组临床表现主要以黏液血丝便为主要症状,一般情况可。
1.3 排除标准
(1)湿疹及特应性皮炎;(2)不洁饮食、细菌性痢疾、寄生虫感染及其他系统感染导致症状性腹泻,先天性巨结肠、肠套叠、胃肠道先天畸形或其他感染性疾病;(3)合并基础疾病或有并发症、营养不良、厌食症等其他疾病。
1.4 标本收集及粪便DNA提取
使用无菌采集管收集所有受试者粪便标本至实验室进行分装,取500 mg装入无菌EP管中,转运至-80℃冰箱冻存待检。采用粪便DNA提取试剂盒(QIAGEN,德国)提取粪便细菌DNA,具体步骤严格按照试剂盒说明书操作。用1%的琼脂糖凝胶电泳检测其基因组中是否含有杂质及降解成分并测定其大小和完整性;使用Nanodrop 分光光度计检测DNA样品浓度及纯度。
1.5 高通量测序
基于美国Illumina 公司的MiSeq 测序仪(PE300),利用引物338F/806R 对提取的DNA 样本16S rDNA V3~V4 高变区序列进行扩增,然后对扩增片段进行二代基因测序。
1.6 统计学分析
采用SPSS 22.0 统计软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用两样本t检验,计数资料以百分率(%)表示,两组间比较采用卡方检验,P<0.05 为差异有统计学意义。
将测序获得的原始数据导入QIIME2 软件进行分析和处理,经过质量过滤后的序列以97%的同一性阈值被聚类到一个操作分类单元(operational taxonomic units,OTU)中。基于Greengenes数据库(version 13.8)将序列进行相似度匹配和物种鉴定,获取每个物种的相对丰度。采用Alpha 分析、Beta分析、线性判别分析(linear discriminant analysis effect size,LEfSe),利用属水平的物种丰度信息,分 别 使 用Mothur 软 件(1.30.2)、Qiime 2 软 件(1.9.1)、LEfSe 软件进行两组间差异物种检测。Alpha分析、Beta分析检测P<0.05,LEfSe的线性判别分析(linear discriminant analysis,LDA)值>2的物种即为组间差异有统计学意义的物种。
2 结果
2.1 一般资料
本研究共纳入FPIP 患儿31 例,其中男18 例,女13 例,年龄0~6 月龄,平均年龄(2.7±1.9)月龄;健康对照组31例,其中男17例,女14例,年龄0~6 月龄,平均年龄(2.5±1.4)月龄,两组年龄(t=0.493,P=0.624)、 性 别(χ2=1.319,P=0.798)差异均无统计学意义。
2.2 肠道菌群多样性分析
两组粪便DNA 样本经Illumina Miseq 平台测序序列优化后,共获得3136284 条有效序列及1884242 条唯一序列,平均每份样本序列数为30391条,测序深度均达到99%。经鉴定细菌来源20门、41纲、90目、151科、273属、404种及522个OTU。Alpha 多样性分析菌群多样性(Shannon指数)和丰富度(Chao 指数)结果显示,FPIP 组患儿肠道菌群多样性Shannon 指数低于健康对照组,但差异无统计学意义(P>0.05);FPIP 组患儿肠道菌群丰富度Chao指数明显高于健康对照组(P<0.01)。见表1。
表1 FPIP组和健康对照组的菌群Alpha多样性分析(±s)
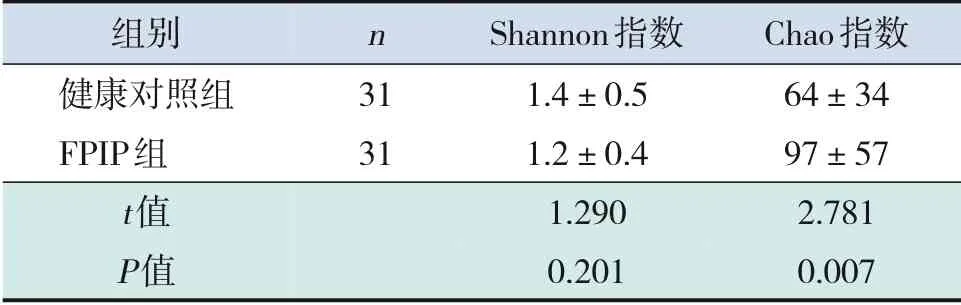
表1 FPIP组和健康对照组的菌群Alpha多样性分析(±s)
组别健康对照组FPIP组t值P值n 3131 Shannon指数1.4±0.51.2±0.41.2900.201 Chao指数64±3497±572.7810.007
对两组样本行主坐标分析(principal co-ordinates analysis,PCoA)探究样本间肠道菌群相似性或差异性,采用组间差异检验(Adonis 检验)分析不同分组间差异是否存在统计学意义。结果显示:健康对照组各样本点间距离较小,提示组内肠道菌群构成较为相似,但FPIP 组各样本点间距离较大,表明组内肠道菌群构成存在较大差异;且两组样本组间距离也较大,FPIP 组和健康对照组肠道菌群呈分离状态,提示两组样本在肠道菌群构成上差异明显(R²=0.060,P=0.001)。见图1。
2.3 肠道菌群组成分析
在菌群多样性分析的基础上对FPIP 组和健康对照组的菌群组成进行对比分析,两组共有OTU 280个,FPIP组独有OTU 150个,健康对照组独有OTU 107个。对OTU进行聚类分析发现,在门水平上,两组菌群均主要由厚壁菌门、放线菌门、变形菌门、拟杆菌门构成(图2)。在属水平上,FPIP组主要由大肠埃希氏菌属、梭状芽孢杆菌属、肠球菌属、克雷伯氏菌属和双歧杆菌属组成;健康对照组主要由双歧杆菌属、链球菌属组成(图3)。进一步通过Heatmap图观察两组间肠道菌群组成及分布情况(图4),在FPIP组中样本5(78%)、8(84%)、9(82%)的肠球菌属相对含量显著高于其他样本;健康对照组中样本1(83%)、2(91%)、14(93%)、26(95%)的双歧杆菌属相对含量显著高于其他样本;此外,狭义的梭菌属在FPIP 组 中 样 本16 (69%)、17 (61%)、23(96%)中显著富集;志贺氏菌属在FPIP组中样本15(87%)、19(62%)、29(67%)、34(55%)中显著富集;提示肠球菌属、双歧杆菌属、梭菌属及志贺氏菌属是两组儿童肠道菌群变化的主要菌属。
2.4 肠道菌群物种差异分析
对FPIP 组和健康对照组进行肠道菌群物种差异比较分析发现,在门水平上,与健康对照组相比,FPIP组中放线菌门(Actinobacteria)构成比显著降低(P<0.001),变形菌门、梭杆菌门、绿弯菌门、酸杆菌门和未知菌门(SBR1093)构成比明显增加(P<0.05)(图5);在属水平上,与健康对照组相比,FPIP 组中双歧杆菌属和瘤胃球菌属构成比明显降低(P<0.05),梭状芽孢杆菌属和志贺氏菌属构成比明显增加(P<0.05)(图6)。进一步行LEfSe 多级物种差异判别分析(从门到属,LDA 阈值为3),显示FPIP 组变形菌门、ν-变形菌纲、肠杆菌目、肠杆菌科、克雷伯氏菌属、乳杆菌目等菌群丰度显著高于健康对照组;放线菌门(纲)、芽孢杆菌纲、双歧杆菌目(科、属)及布劳特氏菌属等菌群丰度显著低于健康对照组(图7)。
3 讨论
FPIP 是食物过敏引起的一种消化道疾病,与本病相关的致敏原有牛奶、鸡蛋、豆类、鱼、小麦等,绝大多数患儿的实验室检查指标正常,皮肤点刺试验和血清特异性IgE检测呈阴性。肠道微生态在人类健康中发挥重要作用,研究显示肠道菌群多样性降低与1 岁以下婴儿的过敏性疾病相关[8]。Zimmermann 等[9]报道婴幼儿肠道菌群的多样性降低可导致IgE介导过敏性疾病如湿疹及过敏性鼻炎等的发生率增加;另一项研究同样也提示了IgE介导的特应性湿疹婴儿总微生物群的多样性较低[10]。上述研究证实肠道菌群多样性的减少与IgE介导过敏性疾病相关。但肠道菌群多样性与非IgE 介导的过敏性疾病的相关性报道较少,Berni Canani 等[11]研究发现非IgE 介导的牛奶过敏性疾病患儿与正常健康婴儿肠道菌群多样性无差异;FPIP作为非IgE介导的过敏性疾病之一,本研究对31例FPIP患儿和31例健康婴儿进行肠道菌群多样性分析。
群落生态学中研究微生物多样性,通过单样品的多样性分析(Alpha 多样性)可以反映微生物群落的丰度和多样性,包括一系列统计学指数估计群落的物种丰富度和多样性。Alpha多样性分析作为研究肠道菌群多样性的重要方法之一,常用的 度 量 标 准 有Chao、Shannon、Ace、Simpson、Coverage 等指数。Chao 指数是用Chao1 算法估计样品中所含的OTU 数目,利用Chao 指数评估一个样本中OTU 数目多少,Chao 指数越大,OTU 数目越多,说明该样本物种数比较多。Ace指数用来估计群落中的OTU 数目,是生态学中估计物种总数的常用指数之一,与Chao1 的算法不同。Shannon 指数用来估算样品中的微生物多样性,它与Simpson多样性指数均常用于反映群落多样性,Shannon 值越大,说明群落多样性越高。Simpson 指数在生态学中常用来定量描述1 个区域的生物多样性。Coverage指数是指各样品文库的覆盖率,其数值越高,则样品中序列被测出的概率越高,而没有被测出的概率越低,该指数反映本次测序结果是否代表了样品中微生物的真实情况。Alpha多样性分析5 个指数中通常以Shannon 指数代表物种多样性[12],Chao指数代表物种丰富度[13],因此本研究Alpha 多样性分析仅展示Shannon 和Chao 指数。本研究菌群多样性Shannon指数示FPIP组低于健康对照组,但差异无统计学意义,考虑与本研究纳入样本量少有关。FPIP 组菌群丰富度Chao 指数示FPIP 组明显高于健康对照组,提示FPIP 组中OTU数目多于健康对照组。
有研究显示,婴幼儿肠道菌群主要由拟杆菌门、放线菌门、厚壁菌门和变形菌门4 个菌门构成[14-15]。本研究对FPIP 组和健康对照组的菌群组成进行对比分析,两组共有OTU 280 个,对OTU进行聚类分析发现,在门水平,两组肠道菌群均主要由上述4 个菌门构成,门组成与健康婴幼儿、IgE 介导[15]与非IgE 介导[1]过敏性疾病患儿一致。健康婴幼儿肠道菌群中最多的是厚壁菌门和拟杆菌门,超过90%[16];厚壁菌门多为革兰阳性菌,细胞壁含肽聚糖量高,具有维持肠道正常的营养、代谢和免疫功能[17];拟杆菌门为革兰阴性菌,在分解多糖调节及促进肠道发育方面有重要的作用。最近一项研究显示IgE介导的食物过敏儿童肠道菌群中拟杆菌门和厚壁菌门明显增加[15];王和平等[18]通过湿疹患儿和健康婴幼儿各10例进行肠道菌群对比分析示拟杆菌门、放线菌门、厚壁菌门和变形菌门构成无差异。本研究中FPIP 组患儿厚壁菌门和拟杆菌门较健康对照组稍高,但差异无统计学意义,考虑与本研究样品量少有关。
近来研究显示非IgE介导的过敏性疾病的肠道菌群失衡主要表现为变形菌门明显增加[19],本研究中与正常健康婴儿相比,非IgE介导的FPIP患儿肠道菌群中变形菌门显著增加,放线菌门明显减少。放线菌门是丝状革兰阳性菌,在有机物质分解中发挥重要作用,主要参与合成代谢产物,如抗生素、色素、酶抑制剂和生物技术相关酶等,本研究中FPIP 患儿肠道菌群放线菌门明显减少,且在此门属下,双歧杆菌属明显减少;双歧杆菌在母乳喂养的婴幼儿肠道菌群中占99%[20],作为黏附于肠黏膜上皮的有益菌,特别是黏附于结肠黏膜上皮的双歧杆菌可以消耗人乳中复杂寡糖,而使其成为母乳喂养婴儿肠道中最丰富的定植者;本研究结果提示FPIP 的发生伴随有益菌双歧杆菌的减少。变形菌门属于革兰阴性杆菌,是肠道菌群常见兼性厌氧菌,在健康婴儿体内较厚壁菌门和放线菌门丰度少,在人体内含量小于1%,多为致病菌,研究发现变形菌门丰度增高可作为肠道菌群紊乱的标志[21]。本研究中FPIP 组患儿肠道菌群中变形菌门较健康对照组明显增多,同时在此门属下,FPIP 组中志贺氏菌属和梭状芽孢杆菌属水平明显高于健康对照组。以上结果提示FPIP 患儿肠道菌群结构可能存在失调的情况,主要以双歧杆菌含量下降、志贺氏菌属和梭状芽孢杆菌增加为主。
本研究提示FPIP 与肠道菌群有一定关系,肠道菌群失调可能影响其发病和转归,但目前这种因果关系仍无定论。因此可能需更进一步研究探讨两者的关系,从而为FPIP 的诊治提供更多临床参考。
利益冲突声明:所有作者声明不存在利益冲突关系。

