Qsep100 核酸蛋白分析系统的应用和维护
刘丽,方三华,杨丹
(浙江大学医学院公共技术平台,杭州 310058)
核酸是生命活动最基本的遗传物质,蛋白质是生命体的重要组成部分,是生命活动的主要承担者和执行者。人类基因组由20 000~30 000 个基因组成,这些基因可编码超过50 万种不同的蛋白质[1-2],核酸和蛋白的异常表达会导致多种遗传疾病的发生。对特定核酸或蛋白进行快速准确的定量分析对促进人类健康的发展具有重要意义。人类基因组计划以及在此基础上研究所有蛋白质的表达、结构以及功能的蛋白质组学极大促进了高通量核酸、蛋白定量及分离技术的发展[3]。目前,大多数实验室仍然在使用传统的琼脂糖凝胶或聚丙烯酰胺凝胶电泳的方法进行核酸或蛋白片段的定性或半定量分析。然而传统的电泳分析方法耗时、耗力,需要对实验条件进行优化及对图像进行分析处理,要求实验者具备较高的实验操作经验和良好的实验技能,同时传统的电泳分析需要一定的样本量进行检测,对稀有样本不太友好。毛细管凝胶电泳(CGE)由于其快速、稳定、自动化、高灵敏性、高分辨率、操作简单等优势,近年来被越来越多的实验室接受并用于核酸片段分离及蛋白和多糖的分析[4-5]。Qsep100 核酸蛋白分析系统是一款利用一次性笔形凝胶卡夹的新型毛细管凝胶电泳仪[6-7]。该系统基于毛细管凝胶电泳的原理,将激光诱导荧光检测技术引入到毛细管电泳中,具备荧光检测的灵敏性和上样及数据分析的自动性,特别适用于DNA、RNA、蛋白质的定性、定量检测及质控分析,目前已广泛应用于科学研究、药物开发、临床诊断、转基因动植物检测、农产品改良和环境检测等领域[2,8-12]。
笔者对该仪器的原理、功能作详细介绍,对不同凝胶卡夹类型的实验条件、样本要求及参数设置进行讨论,同时针对仪器共享服务平台如何进行更高效的仪器维护和管理进行探讨,以期为广大科研工作者提供更加科学、有效的核酸蛋白检测方案。
1 仪器组成及特点
Qsep100 核酸蛋白分析系统配备了(505±15)nm 波长的LED 光源、光电倍增管(PMT)接收器、590~650 nm 长通滤光片,实现了高灵敏的信号采集;同时自动样品台具备X、Y、Z三个方向的精准步进电动机,保障了样本和试剂台的移动,实现了8联管、12 联管或者96 孔板的自动进样检测。仪器采用多种不同用途的可抛弃式预制胶卡夹,无需配胶、灌胶、点样等操作,大幅度提高工作效率的同时,显著降低了实验成本。
Qsep100 仪器特点见表1。基于该仪器的高灵敏性及高分辨率等一系列优势,除最常用的核酸质控等方面的应用外,还可用于蛋白分析、核酸蛋白互作、常规聚合酶链式反应(PCR)产物检测、短串联重复序列/简单重复序列(STR/SSR)微卫星分型、扩增片段长度多态性/限制性内切酶切片段长度多态性分析(AFLP/RFLP)、高分辨率基因分型、高分辨率多重PCR 分析、质粒DNA 酶切构造及纯度分析、合成引物分析等[13-14],是近年来新兴的毛细管凝胶电泳仪,可完全替代昂贵的进口设备,如Agilent 2100 Bioanalyzer 等。
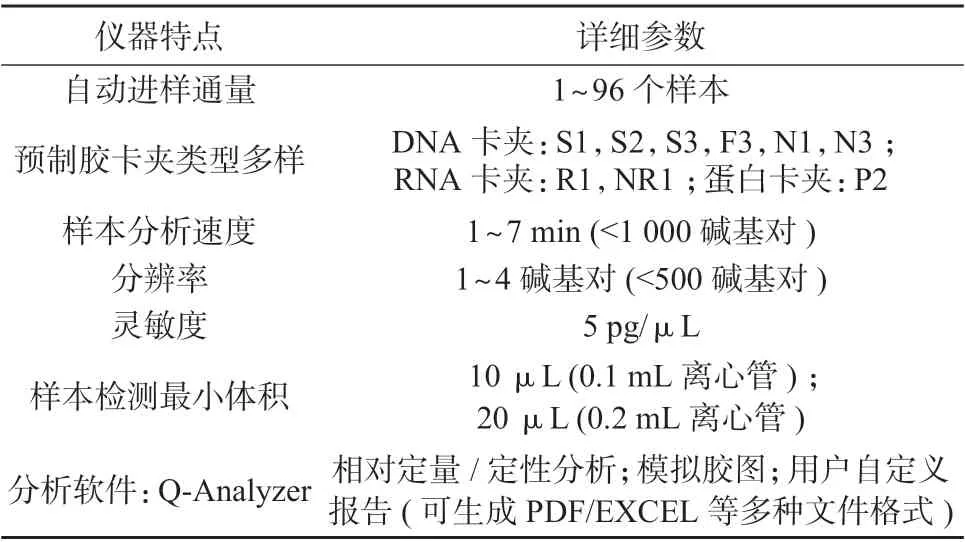
表1 Qsep100 仪器特点汇总
2 样本制备及注意事项
Qsep100 适用范围广,具有多种不同应用,不同样本的上机检测浓度范围、样本是否需要预处理等样本制备环节,对实验结果准确性至关重要,因此实验前需了解样本的来源、性质以及上机要求等条件。
2.1 DNA 样本
上机质量浓度建议为1~2 ng/μL,S2 标准卡夹检测下限为0.05 ng/μL。
2.2 细胞游离DNA/循环肿瘤DNA 样本
质量浓度0.02 ng/μL 以上的都可以用S2 标准卡夹(可以提高进样电压或者进样时间以增加进样量);当S2 卡夹无法检出时则用高敏卡夹(N1)。
2.3 PCR 产物
上机质量浓度建议为1~2 ng/μL 左右,质量浓度较高时也可以通过减少进样时间进行检测,检测下限为5 pg/μL。
2.4 基因组DNA/石蜡包埋样本DNA 样本
上机质量浓度建议3~5 ng/μL,S2 标准卡夹检测下限为0.5 ng/μL。
2.5 总RNA 样本
上机前需将样本进行预处理;在95 ℃下加热5 min,再于冰上放置5 min 后检测。上机质量浓度建议为10~20 ng/μL,RNA 卡夹检测下限为0.2 ng/μL。
2.6 蛋白样本
与核酸样本不同,蛋白样本需提前根据说明书用染料标记,蛋白样本与染料的浓度需在说明书的基础上根据蛋白样本的生化性质调整。总的来说,碱性蛋白较酸性蛋白易于被标记,氨基酸组成中赖氨酸的含量越高,被标记越多。溶解蛋白样品的缓冲液中不能含有任何一级胺,如三羟甲基氨基甲烷(Tris);不能含有清洁剂,如十二烷基硫酸钠(SDS)。适用的缓冲液浓度及种类如:50~100 mmol/L 碳酸钠溶液、磷酸钠溶液、硼酸钠溶液或pH 7.0~9.0 的羟乙基哌嗪乙硫磺酸(HEPES)缓冲溶液。
对于DNA 样本建议用卡夹配套的稀释液(稀释至10 倍体积后使用)稀释至推荐浓度范围进行上机检测,避免使用TE 缓冲液等常用溶液直接稀释样本,以避免溶液中的离子影响毛细管凝胶电泳的运行和数据分析。另外样本浓度的初步测定建议用较为灵敏的Qubit 荧光定量仪检测,如果用紫外分光光度计NanoDrop 检测,浓度下限需至少提高2~3 倍。
3 应用实例
3.1 cDNA 文库检测
检测参数:S2 卡夹,进样电压为4 kV,进样时间为10 s,分离电压为8 kV,分离时间为171 s。
在以上检测参数下,小鼠神经组织cDNA 文库检测结果如图1 所示。结果显示该cDNA 文库58.5%的片段长度分布在400~600 碱基对(bp)。

图1 小鼠神经组织cDNA 文库检测结果
Qsep100 系统可根据检测结果进行弥散条带(smear)分析:设定不同片段长度区间及不同片段间隔对样本的片段长度和丰度进行分析(图1c)。检测所得的cDNA 样本建库后片段的长度和丰度信息,是判断样本是否可以进行下一代测序(NGS)的重要依据。
3.2 cDNA 样本检测及PCR 验证实验
检测参数:S2 卡夹,进样电压为8 kV,进样时间为10 s,分离电压为8 kV,分离时间为170 s。
在以上检测参数下,小鼠神经细胞cDNA 检测结果及PCR(聚合酶链式反应)扩增后琼脂糖凝胶电泳结果如图2 所示。用标准S2 卡夹检测小鼠某特定脑区神经细胞的cDNA,峰形图结果显示无明显信号峰(图2a),但该cDNA 样本经特定引物扩增后,琼脂糖凝胶电泳结果有明显条带(图2c)。结果提示如样本浓度较低则S2 标准卡夹可能无法检测到明显的信号峰,但此时并不表示样本无法进行后续实验,仅表示更高灵敏性的卡夹(如N1 卡夹)更适合该样本的检测。实验证明根据样本的浓度信息选择适合的卡夹至关重要。

图2 小鼠神经细胞cDNA Qsep100 检测结果及PCR 扩增后琼脂糖凝胶电泳结果
3.3 RNA 质控实验
检测参数:R1 卡夹,进样电压为4 kV,进样时间为10 s,分离电压为4 kV,分离时间为579 s。
根据沉降系数(s)不同,真核生物核糖体RNA(rRNA)的主要亚基可分为18s和28s两个亚基。在RNA 提取过程中由于RNA 极易降解,因此28s和18s含量和比值常用作衡量RNA 完整性的指标。从大米样品中提取的一种真菌RNA 质控结果如图3 所示。结果显示该RNA 样本的28s和18s比值(28s/18s)为2.18,两个信号峰完整。同时该RNA样本的质量指数RQN 值为9.84,DV200 值为97.3(片段长度大于200 bp 的比例),RNA 质量较高。
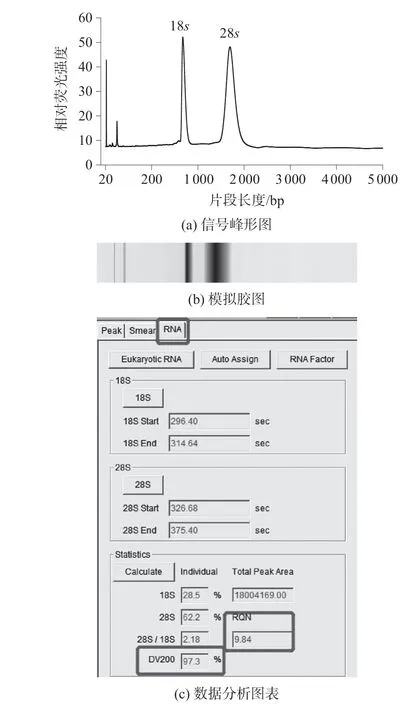
图3 一种真菌RNA 质控结果
该样本用Nanodrop 检测结果显示:260 nm 的吸光度与280 nm 的吸光度比值(OD260/OD280)为2.16,260 nm 的 吸 光 度 与230 nm 的 吸 光 度 比 值(OD260/OD230)为2.51。用Nanodrop 检测RNA 样本时OD260/OD280值在1.8~2.2 之间,OD260/OD280的比值在1.6~2.5 之间,表示样本质量较好。但是降解的核酸片段仍然在260 nm 处有很强的吸收峰,因此Nanodrop 检测的浓度并不代表样本中完整核酸的浓度。如图3 所示,Qsep100 可以给出该样本的RQN 值为9.84(0~10,不小于7 有效[15])以及DV200 值为97.3%,据此可判断该RNA 样本质量较高并可用于NGS 测序或后续PCR 实验[15-18]。有文献证明DV200 参数更能表征样本的完整性[16],而这一参数是Nanodrop 及Qubit 所不能够提供的。
4 实验注意事项
在仪器检测过程中,为达到高质量、重复性好的实验结果,在试剂准备、仪器质控、参数设置、数据分析等方面有许多需要使用者注意的事项。
(1)检测前需提前30 min 将卡夹放置室温平衡,以保障预制胶的均一性和稳定性。
(2)对于核酸卡夹,样品台S 槽内加分离液,P、W、C 位置为清洗槽,加超纯水。而蛋白卡夹则不同,为平衡毛细管中电解质,P、W、C、S 四个卡槽均加入1×蛋白分离液。P、W、C 和S 槽中的液面高度以缓冲液槽的刻度线处为宜,不能低于槽体积的2/3。
(3) RNA 和DNA 样本的分离液浓度不同,最好在缓冲液槽边缘标注DNA 或RNA 字样以示区别。同时,在仪器使用记录本中记录当前检测的样本具体信息。
(4)样本体积不少于10 μL (15 μL 以上最好),但实际进样体积不足1 μL。放置样本和缓冲液后,请确保点击“P”,将样本盘回归原位,再点击“Run”或进行下一步操作,否则容易造成仪器样本托盘运动过程中撞弯或撞断毛细管尖端。
(5)样本管使用带盖的离心管时,最好剪去盖子,或是将盖子下压并低于管面高度,以防盖子打弯毛细管。加热过的8 联管或者96 孔板,请检查两侧是否因受热而翘起。实验前需检查实验室自备的0.2 mL PCR 管是否匹配,有些品牌的0.2 mL PCR 管放置样本盘后不能按压到底部导致样本管过高,导致卡夹移动过程中容易打弯卡夹或者把管子打飞,造成不可挽回的后果。
(6)实验过程中需时刻关注实时数据,仪器检测过程中黑色电流线应保持稳定,如波动较大,很可能是胶闲置过久造成的,建议先进行通胶(T-purge 或HV-T-purge),然后再进行质控和样本检测。
(7)数据分析时不同参数设置可能会影响最终的定量值,同一批检测需设置相同的参数。以下我们将对同一样本进行不同参数的数据分析,比较所得的结果进行详细说明。
对同一分子质量标记(20~5 000 碱基对)数据进行不同参数的分析结果如图4 所示。以分子质量标记为20~5 000 碱基对中迁移时间为154.88 s 的条带为例(图中箭头所示),用不同的基线和峰阈值线参数进行数据分析,结果见表2。由图4 和表2可以看出,当设置不同参数时,对同一条带检测的浓度也不同,因此同一批实验应该设置相同的分析参数,以防止数据分析中人为造成的差异。
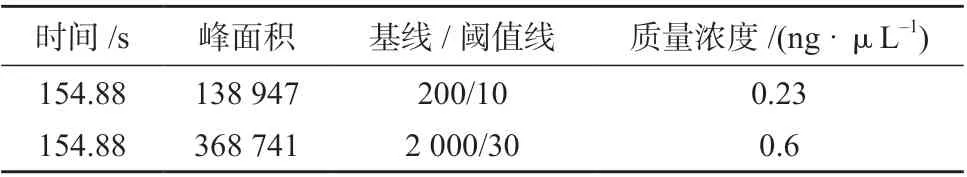
表2 不同参数设置对应的分子质量标记为20~5 000 bp 中迁移时间为154.88 s 的条带浓度
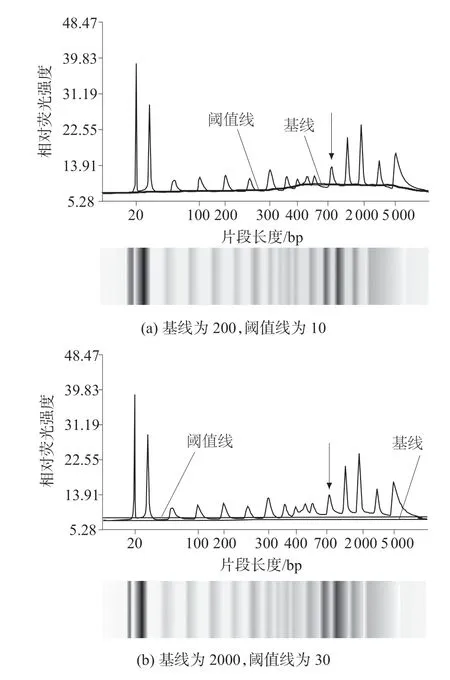
图4 不同参数设置对应的相对分子质量标记数据
5 仪器维护
Qsep100 核酸蛋白分析系统操作简单,仅需四步即可完成多达96 个样本的自动检测,同时无需太多的维护工作,特别适合在仪器共享平台中开放共享。但是为了保证仪器及卡夹状态的稳定性,除了实验检测前必需的卡夹校准外,在仪器开放过程中,还需要做到如下几点:
(1)储存卡夹时需竖直放置,每天检测前执行通胶步骤。通胶方式有3 种:第1 种,软件Direct Control-purge 设置180 s,该过程仅通气,不加电。第2 种,软件参数设置界面method-T-purge,设置“run”为“5”(运行5 个周期,每个周期120 s)。第3 种,软件参数设置界面method-T-HV purge 为“8 kV,120 s”,加电通胶,速度快。
(2)如果在2~3 h 内继续使用,可不取出卡夹,卡夹无需再次质控,可直接检测。但建议每次试验重新检测相对分子质量标记“size marker”,以方便对样本进行准确的相对分子质量测定。
6 结语
核酸蛋白检测是分子生物学的基本实验,同时也是其它分子实验如PCR、RNA-seq、下一代测序等实验的上游实验。核酸蛋白检测的准确性和灵敏性直接决定了后续实验的结果,是大多数分子实验的基石。Qsep100 核酸蛋白分析系统提供了一种快速、简单且高灵敏性的检测方法,但在检测范围、灵敏性、绝对定量等方面仍有很大的提升空间,比如目前仅能对蛋白进行定性检测,无法进行定量测定,也就是说该仪器还无法替代传统的Western Blot实验。将来核酸蛋白检测必定向多参数、高特异性、高准确度、更便捷的方向发展,将极大助力其它分子生物学的研究。

