液相色谱-串联质谱法测定中药材中11 种真菌毒素
刘静,朱叶梅,董胜强,杨盼盼,廖予琦,杨飚,张建,李瑞
(云南同创检测技术股份有限公司,昆明 650106)
中药材是中国传统医药产品,部分中药材既可以作为药物,也可以作为食物、保健品,能够加工成具有食疗功能的膳食。大部分中药材以干燥块茎流通,具有药用、保健价值,有些为中国名贵中药材[1]。中药材的炮制过程主要为直接干燥、微波真空干燥、微波后水蒸、真空冷冻或干燥等[2]。若中药材中水分含量过高,在储藏过程中,中药材会滋生霉菌、真菌等。由真菌、细菌、病毒等引起的中药材中微生物群落变化,会给中药材带来病害[3];同时,中药材内也会产生真菌的次生代谢物真菌毒素[4-5]。真菌毒素主要存在于植物产品及植物性中药材中[6-7],另外,真菌毒素还可通过动物摄入,从而污染动物源性中药材[6-9]。真菌毒素不仅会破坏中药材的品质,降低中药材的功效,甚至会危害人体的健康。目前已确定的真菌毒素约300 多种[10],依据毒性程度划分,毒性较大的有黄曲霉毒素、赭曲霉毒素、伏马菌素、呕吐毒素、T-2 等[11-14]。
仪器分析法灵敏度高,可对毒素进行精确定量,是目前真菌毒素检测的主要手段[15],其中常用的检测方法有高效液相色谱法、气相色谱-质谱联用法和液相色谱-质谱联用法等[16-18]。目前测定中药材中真菌毒素的相关研究主要集中在黄曲霉毒素(B 族、M 族、G 族)、赭曲霉毒素,而T-2 毒素、脱氧雪腐镰刀菌烯醇和伏马毒素的测定未见报道。笔者采用不同极性的2 种提取溶剂对4 种类别的11种真菌毒素进行提取,用三重四级杆质谱仪正离子和多重反应监测(MRM)模式测定,建立了中药材中11 种真菌毒素的检测方法,以期为评价中药材的安全性提供技术参考。
1 实验部分
1.1 主要仪器与试剂
液相色谱-串联三重四级杆质谱仪:Agilent 1290-6460 型,美国安捷伦科技有限公司。
分析天平:AB204-S 型,感量为0.1 mg,瑞士梅特勒-托利多集团。
液氮:纯度不小于99.9% (体积分数),昆明仓辉经贸有限公司。
中药材样品:天麻、三七、石斛、红花、茯苓,市售新鲜样品。
11 种真菌毒素标准样品:伏马毒素B1、伏马毒素B2、T-2 毒素、赭曲霉毒素A、黄曲霉毒素G2、黄曲霉毒素M2、黄曲霉毒素M1、黄曲霉毒素G1、黄曲霉毒素B2、黄曲霉毒素B1、脱氧雪腐镰刀菌烯醇,纯度均不小于95% (质量分数),坛墨质检科技股份有限公司。
13C34伏马毒素B1、13C17黄曲霉毒素B1 同位素标记物标准样品:质量浓度均为25 μg/mL,坛墨质检科技股份有限公司。
甲醇、甲酸:色谱纯,北京迪科马科技有限公司。氨水:分析纯,西陇化工股份有限公司。
多功能固相净化柱:M1000 型,青岛普瑞邦生物工程有限公司。
PriboFast®固相净化柱:MFC100 型,青岛普瑞邦生物工程有限公司。
PriboFast®真菌毒素六合一免疫亲和柱:IAC-400-6 型,柱容量为6 mL,青岛普瑞邦生物工程有限公司。
实验用水为去离子水。
1.2 溶液配制
提取溶剂A:乙腈和水按80∶20 的体积比混合均匀,加入质量分数为0.1%的甲酸。
提取溶剂B:乙腈和水按20∶80 的体积比混合均匀,加入质量分数为0.1%的甲酸。
11 种霉菌毒素混合标准储备液:11 种霉菌毒素的质量浓度均为1.0 μg/mL,分别称取伏马毒素B1、伏马毒素B2、T-2 毒素、赭曲霉毒素A、黄曲霉毒素G2、黄曲霉毒素M2、黄曲霉毒素M1、黄曲霉毒素G1、黄曲霉毒素B2、黄曲霉毒素B1、脱氧雪腐镰刀菌烯醇各1.0 mg 于10 mL 容量瓶中,均用甲醇溶解并定容至标线,配制成11 种单标储备液。分别移取上述11 种单标储备液各0.5 mL 于同一只50 mL 容量瓶中,用甲醇定容至标线,混匀。
混合内标溶液:13C34伏马毒素B1、13C17黄曲霉毒素B1 质量浓度均为1.0 μg/mL,分别移取13C34伏马毒素B1 和13C17黄曲霉毒素B1 标准样品各1.0 mL 于同一只25 mL 容量瓶中,用甲醇定容至标线,混匀。
11 种霉菌毒素系列混合标准工作溶液:分别取适量的11 种真菌毒素混合标准储备液于10 mL容量瓶中,加入1.0 mL 混合内标溶液,用质量分数为0.1%的甲酸溶液定容至标线,配置成11 种真菌毒素的质量浓度均分别为0.1、1.0、5.0、20、50、100 ng/mL 的系列混合标准工作液;分别移取上述系列混合标准工作溶液各1.0 mL,加入已吹至近干的空白样品基质中,用0.22 μm 滤膜过滤,得到相同质量浓度的基质匹配系列混合校正工作溶液。
1.3 仪器工作条件
1.3.1 液相色谱
色谱柱:Waters Acquity BEH C18柱(100 mm×2.1 mm,1.7 μm,美国沃特世公司);柱温:(25±5)℃;流动相:A 为质量分数为0.1%的甲酸溶液,B为含有质量分数为0.1%甲酸的甲醇溶液,流量为0.3 mL/min;进样体积:5 μL;梯度洗脱程序见表1。
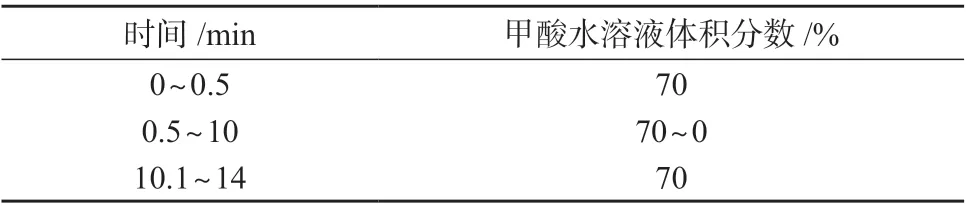
表1 梯度洗脱程序
1.3.2 质谱
离子源:正离子电喷雾电离源(ESI+);检测方式:多重反应监测(MRM)模式;干燥气:氮气,流量为6 L/min,温度为325 ℃;鞘气:氮气,流量为10 L/min,温度为350 ℃;毛细管电压:3 500 V;11 种真菌毒素质谱采集参数见表2。

表2 11 种真菌毒素和2 种内标的质谱采集参数
1.4 实验步骤
1.4.1 样品处理
将采购的新鲜中药材样品,在自然条件下阴干,使最终水分控制在5%~10% (质量分数)之间。然后磨碎过0.425 mm 筛。称取2 g 磨碎后的样品,置于50 mL 离心管中,加入15 mL 提取溶剂A,涡旋1 min,振荡提取60 min,以5 000 r/min 转速离心5 min,将上清液转移至另一只50 mL 离心管中,向剩余样品中再次加入15 mL 提取溶剂B,涡旋1 min,继续振荡提取30 min,然后以5 000 r/min转速离心5 min,合并第一次提取液。再次以5 000 r/min 转速离心5 min,取上清液,于40 ℃氮吹浓缩至10 mL,取980 μL 最终提取液于样品瓶中,加入20 μL 混合内标溶液,充分混匀,经0.22 μm 过滤膜后得到样品溶液。
1.4.2 定量方法
在1.3 仪器工作条件下,先测定1.2 中不同浓度的11 种真菌毒素基质匹配系列混合校正溶液,然后测定1.4.1 处理后的样品溶液,样品溶液中检出的色谱峰保留时间需与标准溶液中某组分色谱峰保留时间一致,且所选择的两对子离子的质荷比一致。以待测真菌毒素质量浓度与内标物质量浓度的比值为横坐标、待测真菌毒素色谱峰面积与内标物色谱峰面积的比值为纵坐标绘制校正曲线,采用内标法定量,得到待测真菌毒素的质量浓度。
2 结果与分析
2.1 色谱条件优化
参考文献[11],采用常用的C18色谱柱分离,并对流动相进行优化。分离真菌毒素最常用的流动相为甲醇、乙腈水溶液(加入一定量的甲酸、乙酸铵)。分别考察了甲醇-甲酸水溶液、甲醇-乙酸铵水溶液、乙腈-甲酸水溶液和乙腈-乙酸铵水溶液4 种流动相体系。结果发现,以甲醇作为有机相可使真菌毒素得到较好的分离,加入甲酸可提高分离度,通过提高离子化效率而提高11 种真菌毒素的灵敏度。综合考虑,选择0.1%的甲酸溶液和0.1%甲酸-甲醇溶液为流动相体系。质量浓度为10.0 ng/mL 的11 种真菌毒素基质匹配混合校正溶液的多反应监测(MRM)色谱图如图1 所示。
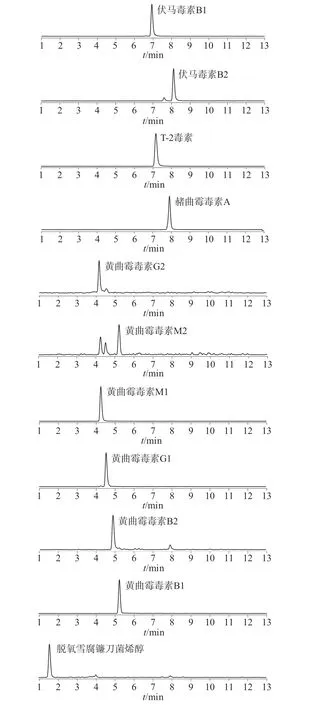
图1 11 种真菌毒素基质匹配混合校正溶液MRM 色谱图
2.2 提取方式选择
要实现同时检测不同理化性质的真菌毒素,需要合适的提取溶剂。常用的提取溶剂一般为不同体积比的甲醇、乙腈等有机相与水的混合溶液。Sulyok等[19]曾对体积比为20∶80至90∶10的乙腈-水体系进行考察,结果表明,当以乙腈体积分数占比较高的乙腈-水体系为提取溶剂时,对多种真菌毒素的提取效果均较好,最常用的提取溶剂为乙腈-水(体积比为80∶20)[20]。待测的11 种真菌毒素极性差异较大,若使用同一种提取溶剂提取,会存在提取不完全的情况。选择乙腈-水体系作为提取溶剂,按1.2 方法分别配制提取溶剂A、提取溶剂B。分别考察提取溶剂A、提取溶剂B 及两种提取溶剂混合提取3 种提取方式对11 种真菌毒素的提取效果,不同提取溶剂对应的真菌毒素的回收率见表3。

表3 不同提取方式对应的真菌毒素回收率 %
由表3 可知,提取溶剂A 对大部分真菌毒素提取效果较好,但对极性较大的伏马毒素类提取效果较差;提取溶剂B 对大部分真菌毒素提取效果较差,但对极性较大的伏马毒素类提取效果较好;采用混合提取,即先用提取溶剂A 对大部分真菌毒素进行提取,然后用提取溶剂B 对极性较大的伏马毒素类进行提取,11 种真菌毒素的提取效果均较好,回收率均达到80%以上,故选择提取溶剂A 和提取溶剂B 混合提取方式。
2.3 基质干扰与消除
由于植物提取液基质复杂,分别采用纯溶剂标准曲线法和基质匹配校正曲线法考察样品基质对测定结果的影响。分别配制乙腈-水(体积比为80∶20)纯溶剂系列标准工作溶液和11 种真菌毒素基质匹配系列混合校正溶液,在1.3 仪器工作条件下分别测定,绘制纯溶剂标准曲线和基质匹配校正曲线,以两种曲线斜率的相对偏差反映基质效应大小,结果见表4。由表4 可知,采用液相色谱-串联质谱法检测,两种曲线斜率的相对偏差绝对值为9.9%~46.5%,表明采用液相色谱-串联质谱法检测中药材中11 种真菌毒素基质效应较大。

表4 11 种真菌毒素标准曲线和校正曲线的斜率
为了有效消除基质效应,选取3 种净化方法进行对比试验:(1)基于QuEChERS 原则的净化法;(2)免疫亲和-净化柱法;(3)两步溶剂萃取法。3 种净化方法对应的11 种真菌毒素的回收率见表5。由表5 可知,采用前两种净化方法11 种真菌毒素的回收率整体偏低,采用两步溶剂萃取直接过滤进样并结合内标法测定,11 种真菌毒素的提取效果均较好,可以实现同时准确测定,故选择以提取溶剂A和提取溶剂B 为溶剂的两步溶剂萃取净化方法消除基质效应。
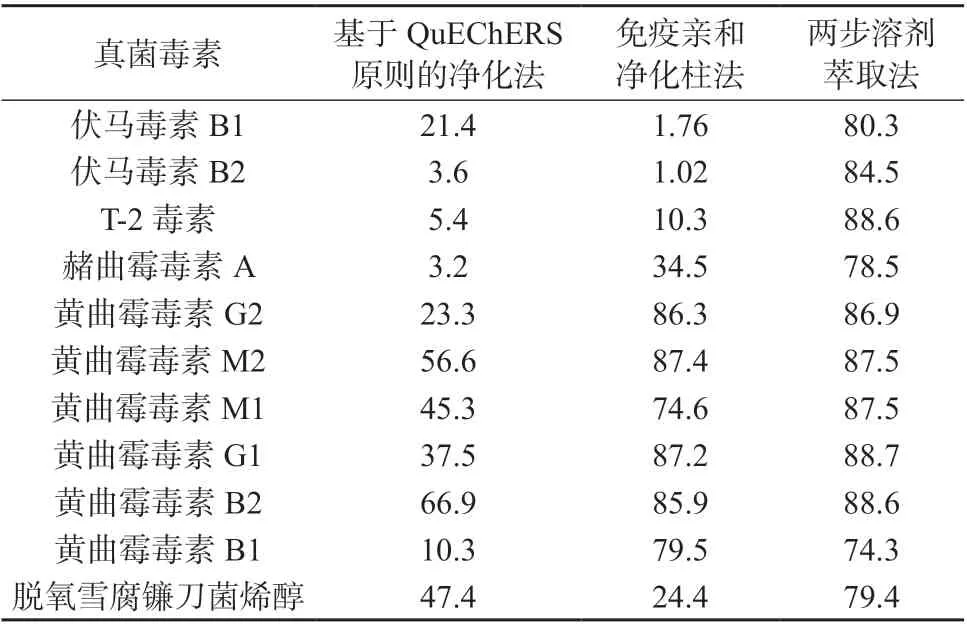
表5 不同净化法对应的11 种真菌毒素回收率%
2.4 线性方程、检出限和定量限
在1.3 仪器工作条件下,对11 种真菌毒素基质匹配系列混合校正溶液进行测定,以待测真菌毒素的质量浓度与内标物质量浓度的比值x为横坐标、对应的待测真菌毒素的色谱峰面积与内标物色谱峰面积的比值y为纵坐标拟合校正曲线,计算线性方程和相关系数。取11 种真菌毒素基质匹配混合校正溶液,用质量分数为0.1%的甲酸溶液不断稀释后测定,分别以3 倍信噪比和10 倍信噪比对应的待测真菌毒素的质量浓度为该方法的检出限和定量限。11 种真菌毒素的质量浓度线性范围、线性方程、相关系数、检出限及定量限见表6。由表6 可知,11种真菌毒素线性方程的相关系数均不小于0.996,检出限和定量限均低于文献值[14-15]。
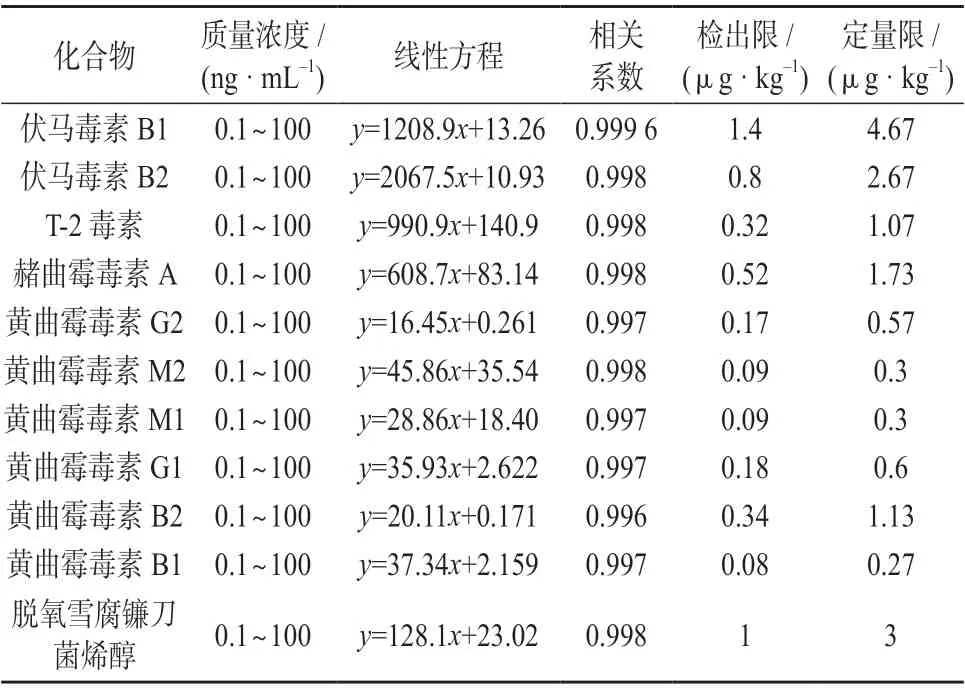
表6 11 种真菌毒素的质量浓度线性范围、线性方程、相关系数、检出限及定量限
2.5 加标回收与精密度试验
选择天麻样品,按1.4 方法进行样品处理,按1.3仪器工作条件测定,11 种真菌毒素均未检出。在该天麻样品中加入适量的11 种真菌毒素混合标准储备液,按1.4 方法平行处理6 份样品溶液,在1.3 仪器工作条件下分别进行测定,计算加标回收率和测定结果的相对标准偏差,结果见表7。天麻加标样品溶液MRM 色谱图如图2 所示。由表7 可知,11种真菌毒素的加标回收率为76.1%~97.6%,测定结果的相对标准偏差为3.97%~8.58%,表明该方法准确度和精密度均较好,满足天麻等中药材复杂基质的检测要求。
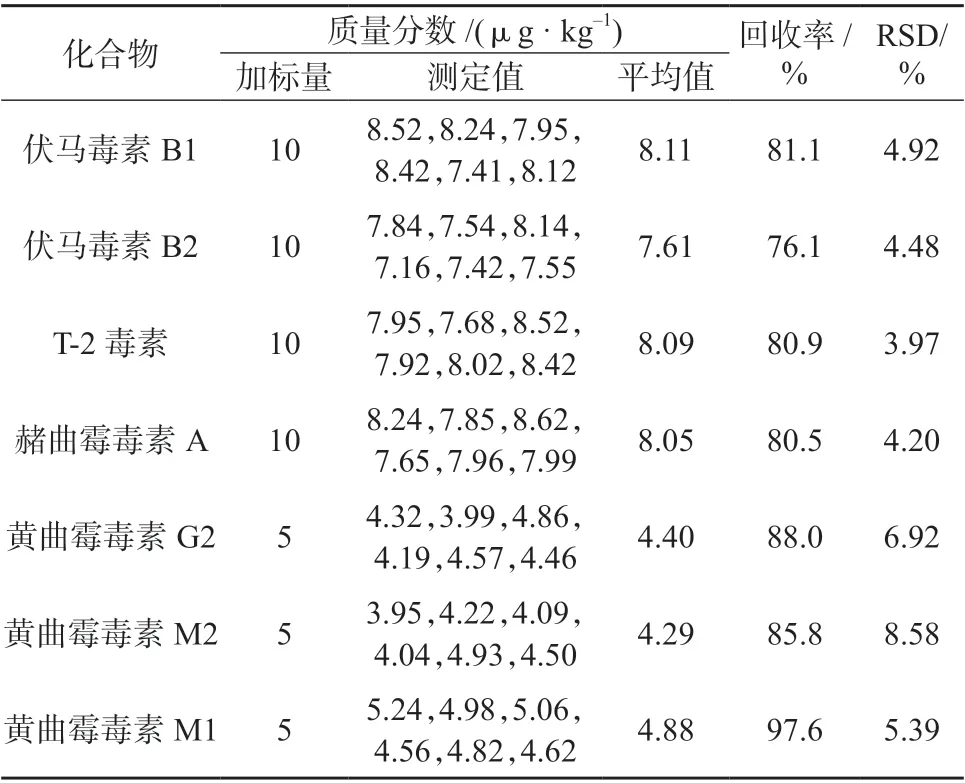
表7 加标回收试验测定结果
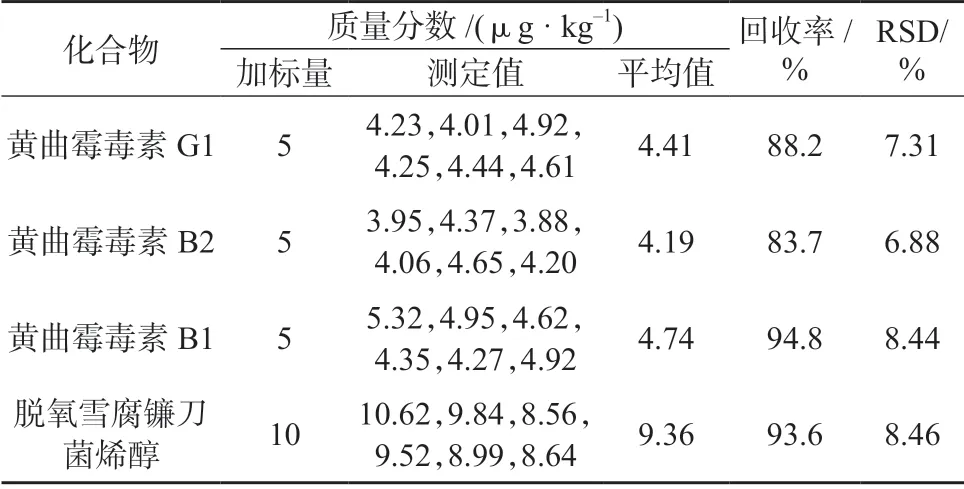
续表7
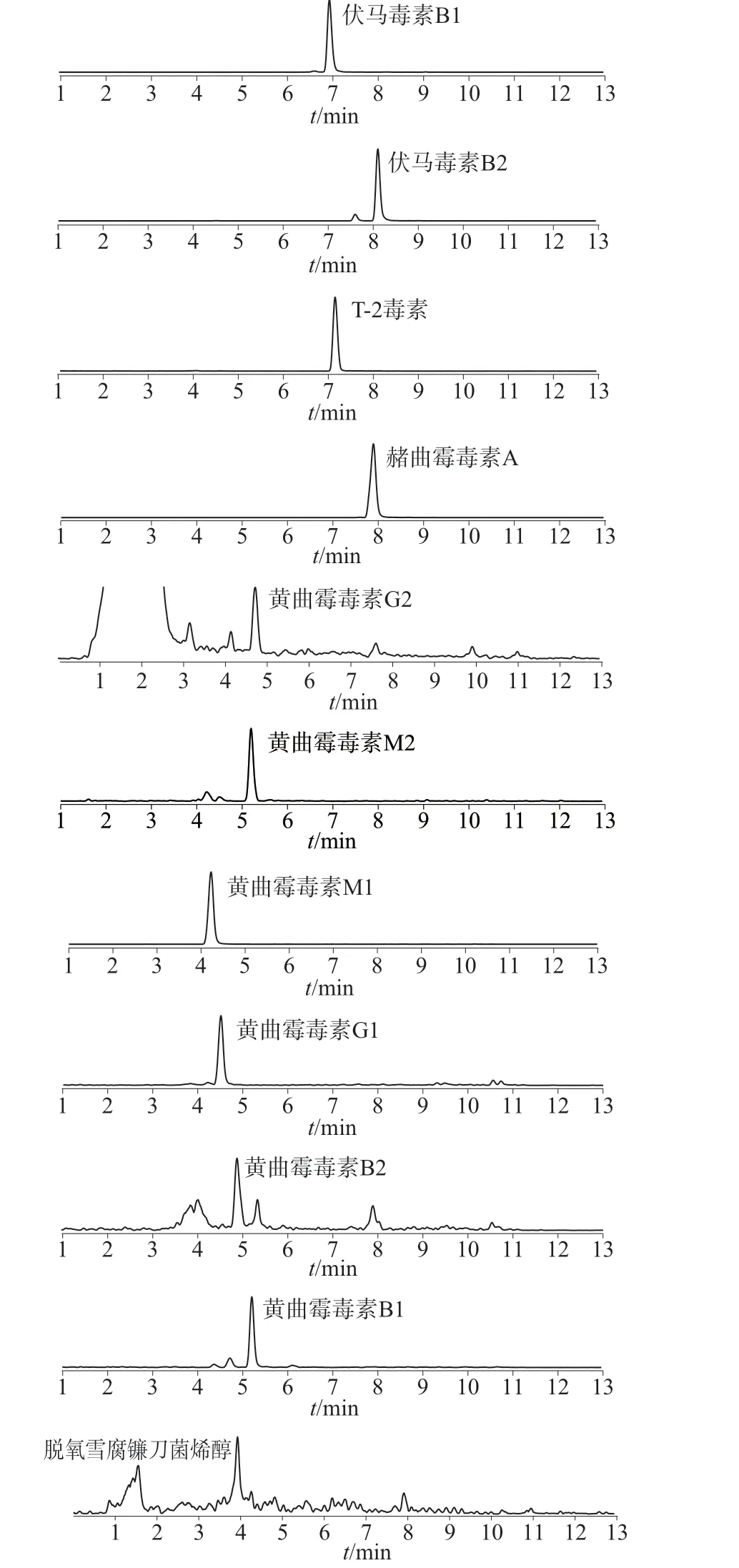
图2 天麻加标样品MRM 色谱图
3 结语
建立了液相色谱-串联质谱法测定中药材中11 种真菌毒素的分析方法。该方法在14 min 内能够准确地完成11 种真菌毒素的定性、定量分析,具有简洁、灵敏、准确稳定等特点,适合于中药材中11种真菌毒素的快速测定,对评价中药材内在质量与安全性具有重要意义。

