萱草原生质体制备体系的优化
牛晓茹,景欢欢,田宁,郑硕理,陈白冰,黄程前*,陈己任,3*
(1.湖南农业大学 a.风景园林与艺术设计学院;b.园艺学院,湖南 长沙 410128;2.湖南省森林植物园 花卉研究所,湖南 长沙 410116;3.湖南省中亚热带优质花木繁育与利用工程技术中心,湖南 长沙 410128)
萱草(Hemerocallisfulva)是百合科(Asphodelaceae)萱草属(Hemerocallis)一种多年生宿根草本植物,它株型挺拔,花色艳丽,花期长,抗性强,适应性强,广泛用于道路绿化、公园绿化和阳台美化,在欧洲与北美地区的花园中占据重要的地位[1-2]。萱草在我国分布广泛,栽培历史悠久,但其单体花期不超过一天,限制了其往切花应用方面的发展[3]。研究表明,萱草花期受不同的单基因控制[4]。因此开花时间不同的萱草品种杂交有可能延长花期,Darrel Apps[5]利用早花和晚花品种杂交选育出连续开花6个月的“金娃娃”。近年来,利用转基因技术改良牵牛花[6]、菊花[7]、紫羊茅[8]、水稻[9]等植物的花期。原生质体融合技术是传统育种的辅助手段,不仅能够克服有性生殖障碍,而且可以促进优良性状的种内、种间、属间整合,从而获得有性杂交无法得到的优良种质资源[10-11]。狼尾草与天竺草[12]、羊草与小麦[13]、多花黑麦草与小麦[14]采用PEG法进行原生质体融合得到了杂种植株,为野生资源的利用提供了新途径。原生质体的制备与培养是进行细胞融合的前提,在植物育种、性状改良和遗传转化等领域具有重要意义[15-16]。
植物原生质体是没有细胞壁的裸露细胞,具有细胞全能性,可以再生成完整的植株。原生质体的分离方法主要有酶解法、机械法和化学法等[17],其中酶解法的应用最为广泛[17]。Cooking等[18]最早通过酶解法分离出番茄根尖的原生质体,随着纤维素酶、果胶酶等酶类的普及,原生质体分离技术也越来越成熟。20世纪80年代,周嫦[19-21]利用内壁酶解的方法分离出了萱草的花粉原生质体,并在含有不同添加物的K3基本培养基中实现了原生质体细胞分裂,形成细胞团和原胚。吴逸等[22]以大花萱草的花瓣为试验材料,分离出花瓣细胞的原生质体。在以黄花菜叶片为材料提取原生质体时,采用果胶酶、纤维素酶、崩溃酶来分离原生质体[23]。国内外关于萱草原生质体制备研究报道较少,以花粉、花瓣为原材料,其取材方面受到一定限制,以叶片为原材料,后期原生质体培养易受污染。本研究以萱草无菌苗叶片和花瓣为试验材料,通过正交试验,探究纤维素酶浓度、离析酶浓度、酶解时间、渗透压调节剂种类、渗透压大小、离心转速等因素对原生质体产量和活力的影响,为体细胞杂交及后期新品种的培育奠定基础。
1 材料与方法
1.1 试验材料
萱草叶片取自萱草‘贵妇’(Hemerocalliscv.‘Guifu’)前期建立再生体系的无菌苗的幼嫩叶;花瓣取自室外盆栽苗,盛花期采摘,花瓣颜色为紫红色。
主要试剂有纤维素酶(R-10,Yakult Honsha)、离析酶(R-10,Yakult Honsha)、山梨醇、甘露醇、蔗糖、葡萄糖、牛血清蛋白(bovine serum albumin,BSA)、MES、亚甲基蓝溶液、Z3培养基:MS+0.5 mg/L 6-BA+0.01 mg/L NAA+蔗糖30 g/L+7 g/L琼脂。
1.2 试验方法
1.2.1 无菌苗的扩繁
萱草外植体经消毒后,进行组织培养建立再生体系;切取再生出的幼嫩芽接种于Z3培养基中进行继代培养,培养周期50~60 d,培养条件为16 h光照+8 h黑暗,25±2 ℃。
1.2.2 试剂配制
酶解液的配制:按试验设计添加纤维素酶R-10、离析酶R-10、山梨醇、8 mmol/L CaCl2、3 mmol/L缓冲液MES(pH=5.7)、0.1%BSA,pH为5.6~5.8,对酶解液进行过滤灭菌(0.22 μm微孔滤膜抽滤灭菌)。酶解液浓度配比按照三因素三水平的正交试验L9(33)(表1),9个处理中山梨醇浓度均为0.5 mol/L[22]。
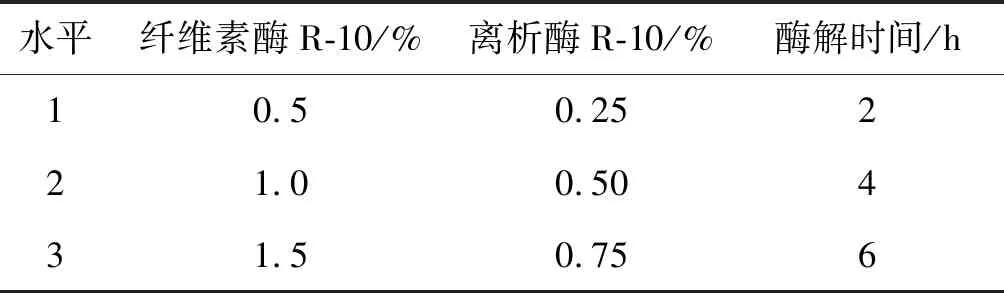
表1 萱草原生质体分离正交试验设计Table 1 Orthogonal experimental design for protoplast isolation of H. fulva
W5溶液制备:154 mmol/L NaCl+125 mmol/L CaCl2·2H2O+5 mmol/L葡萄糖+0.03%MES,pH为5.8,高压灭菌20 min,室温保存。
1.2.3 原生质体的酶解与纯化
取培养50~60 d的健康萱草叶片和盛开的花瓣,用干净的手术刀片将其切成宽0.5~1 mm的长条,将处理好的材料按1∶10(即0.5 g切碎的材料加入5 mL酶解液)的比例加入酶解液中,于50 r/min、25±1 ℃黑暗条件下震荡酶解2~6 h。酶解结束后,向酶解混合物中加入等体积的W5溶液静置5 min,终止反应;用40 μm的过滤筛过滤酶解产物;分别用(400、600、800、1 000、1 200 r/min)室温离心2 min,弃上清液,收集原生质体,之后再加入1 mL W5溶液重悬后,800 r/min离心2 min,弃上清,加入0.5 mL W5溶液重悬,得到纯化后的原生质体备用;将原生质体悬浮液进行稀释,在倒置显微镜下统计血球计数板上的原生质体个数。
1.2.4 渗透压调节剂种类及浓度对原生质体制备的影响
将叶片和花瓣分别放入其最佳酶液组合中,分别加入0.5 mol/L的甘露醇、山梨醇、蔗糖、葡萄糖4种渗透压调节剂,黑暗条件下酶解4 h,比较不同渗透压调节剂对原生质体产量的影响。
将叶片和花瓣分别放入其最佳酶液组合中,分别加入甘露醇0、0.2、0.4、0.6、0.8、1.0 mol/L共6个处理,黑暗条件下酶解4 h,比较不同浓度甘露醇对原生质体产量的影响。
1.3 原生质体的产量测定
用移液枪吸取10 μL原生质体溶液滴加在0.1 mm血球计数板上,静置10 s,让液体自然充满计数室,在倒置显微镜下观察和统计原生质体数量。产量统计用血球计数板法,在倒置显微镜下找到计数室的25个方格,统计中间和4个角上方格内的原生质体数(共5格),然后根据以下公式计算原生质体产量。

1.4 原生质体活力的测定
原生质体活力的测定用亚甲基蓝染色法,取5 μL原生质体溶液和染色剂2∶1混合后2 min置于显微镜下观察原生质体的显色情况。具活性的原生质体不被染色,不具活性的原生质体则呈现深蓝色。随机观察6个视野,记录染成深蓝色的原生质体个数和不被染色的原生质体个数,并根据以下公式计算原生质体活力:
1.5 数据处理
数据利用Excel 2010软件进行统计整理,用SPSS 26.0进行正交试验分析,极差分析,并用邓肯氏新复级差法(DMRT)测验差异显著。
2 结果与分析
2.1 萱草原生质体的分离
以萱草叶片和花瓣为原材料,分离出的原生质体如图1所示。叶片原生质体直径约为40~80 μm(图1A)要明显大于花瓣原生质体20~50 μm(图2B)。
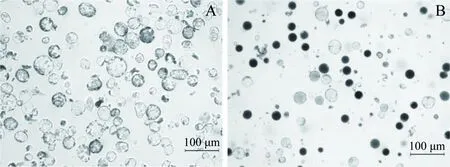
图1 萱草的原生质体Figure 1 Isolation and purification of protoplasts from leaves of H. fulva
2.2 酶浓度与酶解时间对原生质体制备的影响
酶是分离原生质体的重要影响因素,选择合适的酶种类、浓度可提高产量和活力,一般选用纤维素酶和离析酶分离原生质体。本试验采用三因素三水平正交试验设计对萱草原生质体制备所需的酶解液最佳浓度和酶解时间进行筛选。
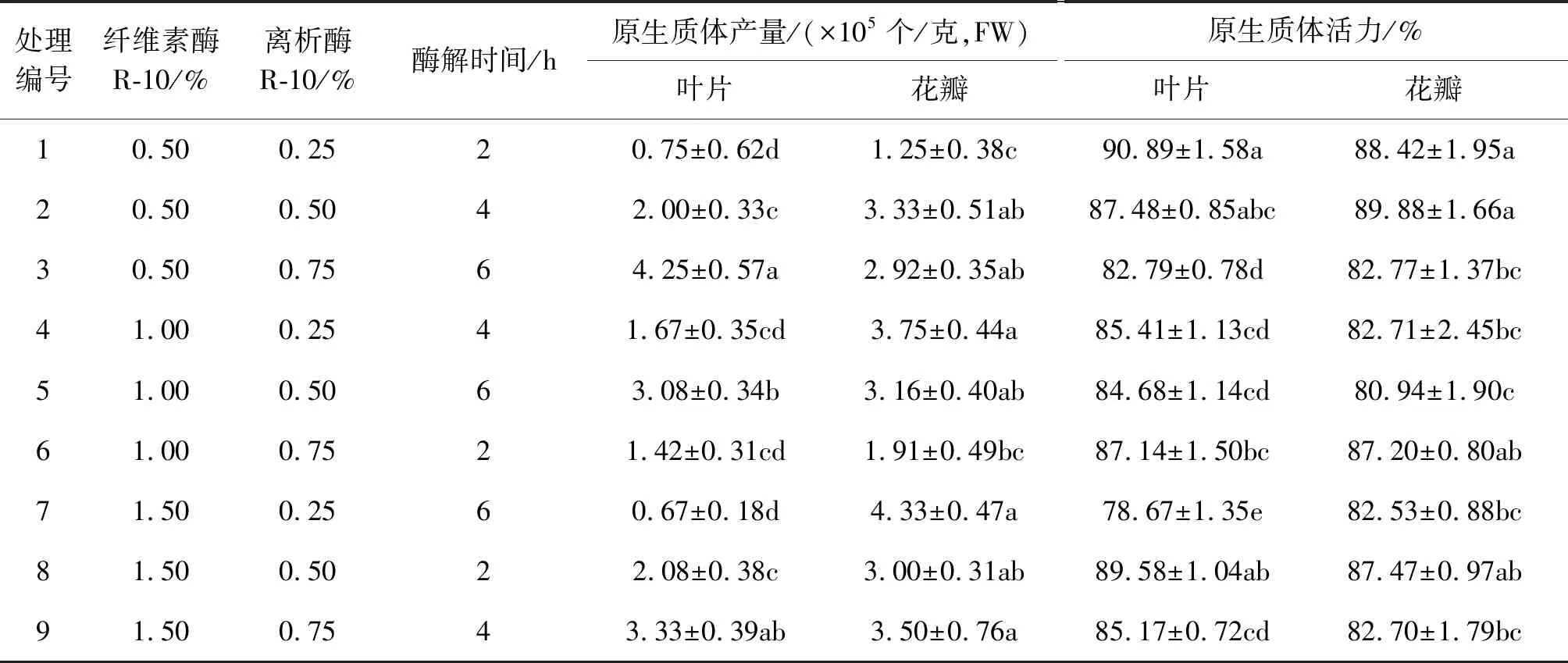
表2 萱草原生质体分离正交试验结果Table 2 The results of orthogonal test on protoplast isolation from H. fulva
正交试验结果表明,各种酶浓度都可以产生原生质体,但不同浓度酶液下分离出的原生质体产量存在显著差异(表2)。叶片在处理3中原生质体产量高达4.25×105个/克,处理1原生质体产量较低,仅0.75×105个/克,但原生质体活力最高,说明各因素不同水平对原生质体的产量和活力的影响存在较大差异;叶片与花瓣适宜的酶浓度和酶解时间不同,花瓣在处理7中分离的原生质体产量高达4.33×105个/克,但原生质体的活力一般。花瓣、叶片在试验处理水平范围内,各因素对原生质体分离效果的影响程度可通过极差(R)的大小体现。
由表3极差(R值)可知,三个因素对于叶片原生质体产量的影响顺序是:离析酶浓度>酶解时间>纤维素酶浓度。当纤维素酶浓度为0.5%(水平1)时原生质体产量最高,与其他两水平无差异,但随着纤维素酶浓度增加,产量逐渐下降。然而,随着离析酶浓度和酶解时间的增加原生质体产量在逐渐增加,当离析酶浓度达到0.75%和酶解时间6 h时产量均达到高峰,且离析酶浓度和酶解时间均对于原生质体的产量有显著的影响。故此叶片原生质体制备的最佳组合为0.5%纤维素酶+0.75%离析酶+酶解时间6 h。

表3 不同处理对萱草原生质体产量及活力影响的极差分析Table 3 Intuitive analyses of effect of different treatments on yield and viability in H. fulva
三个因素对花瓣原生质体产量的影响与叶片不同,其影响大小顺序为:酶解时间>纤维素酶浓度>离析酶浓度。随着酶解时间的增加,原生质体产量逐渐提高,当酶解时间为4 h时原生质体产量达到高峰;随着纤维素浓度逐渐增加,花瓣产生的原生质体也逐渐增高加,当纤维素浓度达到1.5%时产量到达最高。离析酶浓度各水平之间无显著差异,但随着离析酶浓度的增加,原生质体产量先上升后降低,在酶浓度为0.5%(水平2)时产量达到高峰。故花瓣原生质体制备的最佳组合为1.5%纤维素酶+0.5%离析酶+酶解时间4 h。
原生质体活力测定中,三因素对于叶片和花瓣原生质体活力的影响大小顺序均为:酶解时间>纤维素酶浓度>离析酶浓度。酶解时间和纤维素酶浓度均对萱草叶片和花瓣原生质体活力呈现出显著性差异,说明主效应存在,纤维素酶浓度和酶解时间均会对活力产生显著影响。当纤维素酶浓度、酶解时间2个因素均为低水平时,原生质体活力较高,说明纤维素酶浓度过高和酶解的时间过长均不利于原生质体活力的保持。离析酶浓度对叶片和花瓣原生质体活力的影响无显著性差异,因此离析酶浓度对原生质体活力影响较小。
2.3 渗透压调节剂对原生质体产量的影响
原生质体没有细胞壁的保护,酶解液的渗透压需要与细胞的渗透压相似才能保持其膜稳定性和活力。通常加入葡萄糖、甘露醇或山梨醇等渗透压调节剂来调节酶解液的渗透压[24]。本试验探究甘露醇、山梨醇、蔗糖、葡萄糖4种原生质体常用的渗透压调节剂对萱草原生质体产量的影响。
结果表明,4种渗透压调节剂均对叶片和花瓣原生质体产量产生了显著影响(图2)。以山梨醇为渗透压调节剂时叶片和花瓣原生质体产量均为最高。渗透压调节剂为山梨醇时,分离的叶片原生质体产量高达3.33×105个/克,而甘露醇为渗透压调节剂分离的原生质体产量略低于山梨醇,但两者产量无显著差异,因此两者皆可以作为萱草叶片原生质体提取的渗透压调节剂。与之不同的是,在花瓣原生质体的制备中,当渗透压调节剂为山梨醇时原生质体产量高达4.25×105个/克,以甘露醇为渗透压调节剂是原生质体产量仅1.83×105个/克,两者产量相差2.42×105个/克,因此以花瓣为原材料时,渗透压调节剂宜选用山梨醇。
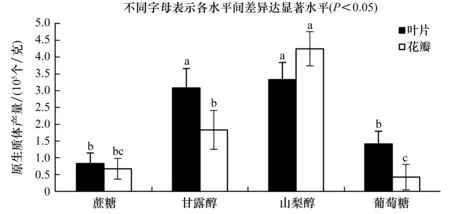
图2 渗透压调节剂种类对原生质体产量的影响Figure 2 Effect of osmolality regulator type on protoplast yield
2.4 渗透压对原生质体产量和状态的影响
适宜的渗透压浓度对原生质体的制备十分重要,过高浓度的渗透压会使原生质体失水死亡,浓度过低会使原生质体吸水胀破死亡。本试验以山梨醇为渗透压调节剂,探究6种山梨醇浓度下原生质体的产量情况及原生质体状态。

图3 渗透压调节剂浓度对原生质体产量的影响Figure 3 Effect of osmolality regulator concentration on protoplast yield
结果显示,在一定范围内,原生质体产量随着山梨醇浓度的升高而上升,当达到峰值后,随着山梨醇浓度的增加产量逐渐下降。当山梨醇浓度为0.4 mol/L时,原生质体产量达到高峰,叶片原生质体产量达到4.67×105个/克,花瓣原生质体产量达到3.22×105个/克。当山梨醇浓度为0 mol/L时,在倒置显微镜下观察到原生质体吸水胀破严重,碎片较多;当山梨醇浓度为0.8、1.0 mol/L时原生质体变形,原生质体受压不均匀,变形破裂。因此,筛选适合的山梨醇浓度对原生质体的制备很重要。山梨醇浓度为0.4 mol/L时原生质体呈规则球状,边界清晰,形态完整,并且产量最高,因此萱草原生质体制备时山梨醇适宜浓度为0.4 mol/L。
2.5 离心转速对原生质体产量和活力的影响
在相同条件下,叶片和花瓣原生质体产量随转速的增加先增加后降低的趋势,在800 r/min下,原生质体产量最高。随着离心转速的增加产量得到了提升,但破裂的细胞碎片也在增加,适宜的离心转速对原生质体的产量有显著影响。相同条件下,随着离心转速的增加原生质体活力呈现下降趋势,虽然400 r/min下原生质体活力最佳,但其产量较低,因此综合产量与活力两者原生质体在收集时离心转速应为800 r/min。

图4 离心转速对原生质体产量的影响Figure 4 Effect of centrifugal speed on protoplast yield
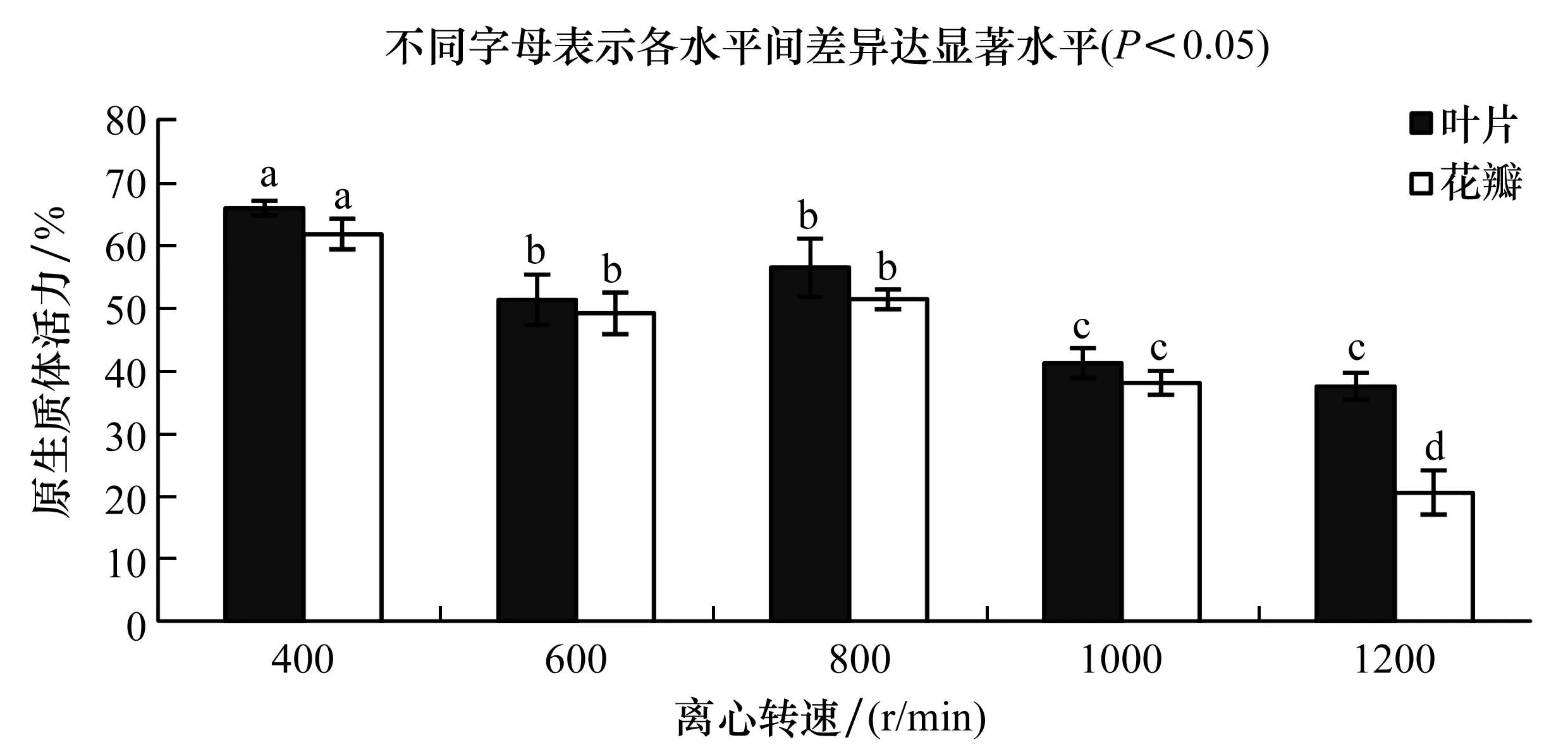
图5 离心转速对原生质体活力的影响Figure 5 Effect of centrifugal speed on the viability of protoplasts
3 讨 论
原生质体的制备是体细胞杂交的重要环节,目前已有很多相关报道,但关于萱草原生质体的分离研究还较少。单子叶植物原生质体的制备大多采用疏松易碎的愈伤组织或悬浮细胞[18]。本试验以萱草‘贵妇’叶片和花瓣为试验材料制备原生质体,探究原生质体制备中的影响因素。
(1)试验材料。花瓣作为试验材料,制备出的原生质体颜色鲜艳,便于分辨,可以清晰的观察细胞的融合,但取材时间受植物花期影响。植物组培苗叶片取材方便,生长周期稳定,可通过酶解法分离出大量的状态良好的原生质体,因此叶片是植物原生质体分离时最常用的材料。Sauve等[23]以黄花菜叶片为材料制备原生质体时,其叶片为室外采摘,虽进行了消毒,但可能消毒不彻底导致后期的污染,使用无菌苗叶片则可以避免。在试验中发现,萱草叶片原生质体的产量与叶片的幼嫩程度有很大关系,苗龄60 d的叶片比苗龄30 d嫩叶分离的原生质体产量高出很多倍。李妮娜[25]等也证实不同叶龄的棉花幼叶对原生质体得率有着显著影响,原生质体的产量随着叶龄的增加而增加,叶龄12 d的时候到达峰值,随后原生质体活力开始下降。研究中还发现,萱草花瓣制备原生质体的效率要高于萱草叶片的提取效率。叶片前期产量较低,随着时间的延长,原生质体产量逐渐提高,当酶解时间6 h时,产量达到最高。与之相反的是花瓣酶解4 h,原生质体产量就达到了最高。这可能是由于萱草单朵花期只有1 d,花瓣娇嫩,易于酶解,而叶片为50~60 d的无菌苗叶片,叶片较花瓣来说较老,也可能不同器官之间存在差异,可以进一步研究。
(2)酶解时间。酶解时间是影响原生质体产量和活力的直接因素。随着酶解时间的增加,原生质体产量也随之增加,然而酶解时间过长会导致原生质体的活力下降,与侧柏[26]研究结果一致。研究表明,叶片制备原生质体需要酶解6 h,与黄花菜研究结果一致;花瓣则仅需4 h,这与大花萱草[22]上的研究结果相似。原生质体的活力在原生质体再生培养中占据重要地位。酶解时间对原生质体产量及活力的影响还可以进一步研究。同一品种的萱草叶片和花瓣在提取原生质体时所需的酶解时间不同,这可能叶片与花瓣含糖量不同有关,可进一步研究。
(3)酶组合。在原生质体分离试验中,需要解离细胞壁和胞间层,使原生质体得以提取。植物细胞壁主要由纤维素组成,胞间层多为果胶类物质,一般采用纤维素酶和离析酶作用于细胞壁。在一定范围内,酶的作用效果随着浓度的增加而增加,当酶浓度超过一定范围,就会对细胞产生毒害作用,酶解效果就会下降[27]。研究发现随着纤维素酶浓度的升高原生质体产量逐渐减少,与东方百合[28]上的研究结果相似。在黄花菜原生质体提取中使用了3种酶,本试验选取纤维素酶与和离析酶2种酶探究酶组合对原生质体产量与活性的影响,进一步优化了原生质体提取方案。本试验酶组合是一起混合均匀后添加,酶的添加顺序和时机还可以进一步探究。
(4)渗透压调节剂及浓度。前人研究中萱草花瓣和花粉原生质体分离以0.5 mol/L甘露醇为渗透压调节剂,叶片原生质体分离采用0.6 mol/L山梨醇。在以0.4 mol/L的山梨醇为渗透压调节剂的酶液中原生质体更圆润。在山桃原生质体分离中,对比甘露醇、山梨醇、葡萄糖、蔗糖四种渗透剂的效果,发现0.55 mol/L山梨醇效果最好[29],这与本研究试验结果相似。表明合适的渗透压调节剂浓度,可以提高原生质体产量,浓度过高或过低都会导致原生质体破裂。在本试验中发现以山梨醇为渗透压调节剂的情况下,所得的原生质体产量高于以甘露醇为渗透压调节剂,在以蔗糖、葡萄糖为渗透压调节剂的情况下,所得的原生质体产量较低,可能是因为蔗糖、葡萄糖在酶解液的粘稠性较高,使得原生质体聚集在一起,在纯化时原生质体无法分离,也可能是导致产量较低的原因。
(5)离心转速。在原生质体收集过程中,适宜的离心转速不仅可以提高产量,更能保证原生质体的质量。转速过高时会降低原生质体活力,过低会减少原生质体产量,因此适宜的转速很重要,这与王珺华[30]等研究结果相似。在研究过程中发现,转速对叶片原生质体的活力影响小于花瓣,这可能与原生质体的大小有关。
4 结 论
本试验对影响萱草原生质体分离过程进行优化,获得了其原生质体制备条件的最佳参数,建立了一套高效快捷的制备体系。试验结果表明,用同一品种萱草的不同器官为原生质体制备的原材料,所需的酶浓度及酶解时间均不同。以萱草‘贵妇’叶片为原材料,其原生质体制备的最佳方案如下:
0.5%纤维素酶R-10+0.75%离析酶R-10+0.4 mol/L山梨醇,酶解时间为6 h;以花瓣为原材料的原生质体制备最佳方案:1.5%纤维素酶R-10+0.5%离析酶R-10+0.4 mol/L山梨醇,酶解时间为4 h。在原生质体纯化时,合适的离心转速为800 r/min,可以保证活性的同时提高产量。

