1例临床药师参与伊马替尼与伏立康唑联合用药的药学监护
陈晨,李霞,董艳,王永静
(1.山东大学第二医院临床药学科,山东 济南 250033;2.山东省药品不良反应监测中心,山东 济南 250014;3.山东大学第二医院血液内科,山东 济南 250033)
伊马替尼作为第一代酪氨酸激酶抑制剂,是 BCR-ABL 1 和KIT 酪氨酸激酶的强效抑制剂,目前广泛用于治疗慢性髓系白血病、费城染色体阳性的急性白血病以及胃肠道间质瘤。已有研究表明伊马替尼是治疗成人伴费城染色体阳性的急性淋巴细胞白血病的有效治疗药物之一[1]。《中国成人急性淋巴细胞白血病诊断与治疗指南(2021年版)》[2]亦推荐对于伴费城染色体阳性急性淋巴细胞白血病的老年患者以酪氨酸激酶抑制剂为基础,优先推荐持续应用,至维持治疗结束。
伊马替尼在肝脏中主要通过细胞色素 P450 3A4(CYP3A4)代谢[3],许多药物转运蛋白也参与伊马替尼的药物代谢过程,如 P-糖蛋白(P-gp)、乳腺癌耐药蛋白(BCRP)[4],由此导致伊马替尼与诸多药物存在药物相互作用。伏立康唑作为CYP3A4的抑制剂,与伊马替尼之间存在药物相互作用,但如何进行剂量调整,在药品说明书中并未明确提及,这为需要联合用药的患者带来治疗难点。本文通过临床药师参与的1例急性淋巴细胞白血病治疗的药学实践,对该患者的药物治疗方案中伊马替尼与伏立康唑联合用药开展全程药学监护,为临床药师参与药物治疗实践和开展药学服务提供参考。
1 病例资料
患者,女,72岁,因“发现贫血1月余,乏力、食欲缺乏3 d,发热1 d”于2021年10月11日入院。患者1月余前外院查体,血常规示:白细胞计数5.7×109·L-1,血红蛋白浓度97 g·L-1,血小板计数162×109·L-1。未诉特殊不适,患者未在意。3 d前患者无明显诱因出现乏力、食欲缺乏,伴左侧肋间疼痛,伴腹泻,大便呈水样便,3~4次/天,偶伴有胸闷、恶心,患者至当地医院就诊,完善血常规示:白细胞计数11.86×109·L-1,中性粒细胞百分率0.4 %,淋巴细胞百分率98.7%,中性粒细胞计数0.05×109·L-1,淋巴细胞计数11.71×109·L-1,红细胞计数2.54×1012·L-1,血红蛋白浓度72 g·L-1,血小板计数151×109·L-1;患者未行特殊处理,上述症状逐渐加重。今晨患者无明显诱因出现发热、寒战,体温最高39.0 ℃,伴胸闷,患者至我院急诊就诊,完善血常规:白细胞计数4.65×109·L-1,中性粒细胞百分率2.7%,淋巴细胞百分率91.4%,中性粒细胞计数0.13×109·L-1,淋巴细胞计数4.25×109·L-1,红细胞计数2.31×1012·L-1,血红蛋白浓度67 g·L-1,血小板计数139×109·L-1;C反应蛋白221.11 mg·L-1,给予对乙酰氨基酚1片口服后体温逐渐降至正常。现患者为进一步诊治,患者自发病来,神志清,精神一般,食欲差,睡眠质量一般,近3 d大便不成形,3~4次/天;小便偏黄,近期体重无明显改变。入院查体:体温:38.3 ℃,心率:106次/分,呼吸:18次/分,血压:109/83 mmHg。入院诊断:①贫血;②白细胞减少原因待查;③发热原因待诊;④右上肢骨折术后。
2 治疗经过
患者入院后完善相关辅助检查,血常规:白细胞计数1.82×109·L-1,血红蛋白浓度73 g·L-1,血小板计数88×109·L-1,网织红细胞百分率0.3%,网织红细胞计数6.30×109·L-1,C反应蛋白>200.0 mg·L-1↑。呼吸道病原体谱抗体+抗核抗体+抗双链DNA定量、体液免疫五项、CD55/CD59、直接Coombs、糖水试验、酸溶血试验未见明显异常。查体显示:贫血貌,全身皮肤黏膜苍白,无黄染,结膜苍白,巩膜无黄染,口唇苍白,无发绀,左肺呼吸音低,可闻及少量湿啰音,右肺呼吸音粗,未闻及干湿啰音。给予哌拉西林他唑巴坦(4.5 g,静滴,q8 h)抗感染治疗,并行骨髓穿刺进一步明确诊断。
第5天,患者偶有胸闷不适,血常规+CRP:白细胞计数3.24×109·L-1,红细胞计数2.80×1012·L-1,血红蛋白浓度82 g·L-1,血小板计数69×109·L-1,C-反应蛋白>200.0 mg·L-1;降钙素原11.350 ng·mL-1。胸部CT显示:双肺炎症。骨髓穿刺结果回报:骨髓细胞学:全片可见约85%左右的异常原始细胞,考虑急性白血病。骨髓流式免疫分型:流式结果符合急性B淋巴细胞白血病免疫表型,原始细胞占有核细胞总数约为89.13%,该群细胞表达:CD10、CD19、CD33、HLA-DR、cCD22;部分表达:CD34、CD13;不表达:CD7、CD11b、CD15、CD16、CD56、CD117、MPO。骨髓活检结果显示:(髂骨髓组织)送检骨髓穿刺组织,骨髓增生极度活跃,骨髓腔内查见弥漫分布的异型细胞,细胞较幼稚,大小较一致,核呈圆形、椭圆形,染色质较稀疏,结合免疫组化考虑急性淋巴细胞白血病。免疫组化:CD10(+)、CD117(个别细胞+)、CD19(+)、CD20(B细胞+)、CD235α(红系+)、CD3(T细胞+)、CD34(阳性细胞约占60%)、CD4(T细胞+)、CD61(巨核细胞+)、CD79α(+)、CD8(T细胞+)、MPO(粒系+)、PAX-5(+)、TDT(+)。特殊染色:网织纤维染色(+)。淋系白血病中常见融合基因:BCR-ABL1(+)。综合考虑该患者为伴费城染色体(BCR-ABL1)阳性的急性B淋巴细胞白血病,给予甲磺酸伊马替尼胶囊0.4 g,qd。
第9天查胸部CT:双肺感染性病变表现,较前范围增大,左肺上叶空洞形成。痰细菌+真菌培养结果:正常菌群;G、GM试验阴性。临床医师考虑肺部真菌感染可能性不能排除,与临床药师讨论病情后,加用注射用伏立康唑0.4 g,静滴 qd+注射用亚胺培南西司他丁钠1 g,静滴 q8 h,并将甲磺酸伊马替尼胶囊减量至0.2 g,qd。
第15天复查胸部CT:双肺感染性病变表现,左肺上叶空洞形成,空洞缩小,较前片好转。继续伏立康唑+亚胺培南西司他丁抗感染治疗。
第18天,临床医师与临床药师联合查房,将伊马替尼加量至0.3 g,qd,于第24天检测伊马替尼血药谷浓度:1 372.08 ng·mL-1,临床药师根据目前血药浓度结果建议可继续目前治疗方案。于第24~30天行COP方案化疗(环磷酰胺0.6 g·d-1第1天+长春地辛4 mg·d-1第1天+泼尼松40 mg·d-1第1~7天)。化疗过程顺利,未诉特殊不适。
3 讨论
3.1 伏立康唑与伊马替尼联合用药的必要性 国内外流行病学研究显示,血液病患者侵袭性真菌病的总体发病率呈现上升趋势。结合该患者具备侵袭性肺部真菌感染的宿主因素(急性淋巴细胞白血病初发初治)、临床特征(肺部感染,胸部CT:空洞形成),经广谱抗菌药物治疗失败(使用哌拉西林他唑巴坦治疗8 d后CRP、PCT 较前升高),该患者拟诊为侵袭性肺部曲霉病,可启动抗真菌药物的诊断驱动治疗。《2016年美国感染病学会(IDSA)曲霉病诊断处理实践指南》[5]及《热病:桑福德抗微生物治疗指南(第48版)》[6]均推荐伏立康唑为治疗侵袭性曲霉病的首选治疗(强推荐;证据质量高)。
唑类抗真菌药物可抑制 CYP3A4 活性,会降低伊马替尼的代谢,导致药物血浆水平升高[7-8]。早在2005年[9]就有人报告了一名患有慢性髓性白血病的患者同时应用伊马替尼与伏立康唑时出现了伊马替尼的血药浓度水平升高(血药浓度高达3 500~4 700 ng·mL-1)。另有研究比较唑类抗真菌药,包括酮康唑、氟康唑、伏立康唑、伊曲康唑和泊沙康唑对伊马替尼代谢的影响,发现对伊马替尼形成N-去甲基伊马替尼的抑制作用的等级顺序为酮康唑>伊曲康唑>泊沙康唑>伏立康唑>氟康唑[10]。大鼠试验显示,同时给予伊马替尼和伏立康唑后,伊马替尼的Cmax显著增加18.8%~36.8%,伊马替尼的代谢产物N-去甲基伊马替尼的Cmax降低了29.4%~55.8%[11-12]。因此,伏立康唑与伊马替尼联合用药期间,伊马替尼的血药浓度会显著提高,需要下调伊马替尼的用量。
3.2 伊马替尼的剂量调整策略 伊马替尼的常规用药剂量为0.4 g·d-1。但鉴于伏立康唑对伊马替尼的影响,临床药师建议联合用药初期减少伊马替尼的用药剂量,并进行血药浓度监测。临床医师采纳并调整伊马替尼剂量至0.2 g·d-1。用药9 d后患者无特殊不适,血象稳定,遂将伊马替尼加量至0.3 g·d-1,剂量调整5 d后送检伊马替尼血药谷浓度为1 372.08 ng·mL-1。针对伊马替尼血药浓度监测,有指南[13]推荐慢性粒细胞白血病患者的伊马替尼血药谷浓度应超过1 000 ng·mL-1,胃肠间质瘤患者的伊马替尼血药谷浓度应超过1 100 ng·mL-1,但谷浓度>3 000 ng·mL-1时与药品不良反应发生相关。目前指南中虽暂无伊马替尼治疗急性淋巴细胞白血病的血药谷浓度推荐,但结合现有指南中伊马替尼治疗其他肿瘤的血药谷浓度推荐范围,目前此次血药谷浓度已达标(1 000~3 000 ng·mL-1),临床药师建议继续当前用药方案,暂不予剂量调整,并继续密切监测病情变化及药物的不良反应,如条件允许,可继续监测伊马替尼血药谷浓度变化。
3.3 药学监护 伊马替尼常见的不良反应包括非血液学不良反应(如皮疹、乏力、恶心、腹泻、骨关节痛、肌肉痉挛、水肿、转氨酶升高等)及血液学不良反应(中性粒细胞减少、贫血、血小板减少等)[14]。监测患者临床表现、血常规(见表1)、肝功能指标(见表2)等,未见伊马替尼不良反应的发生。
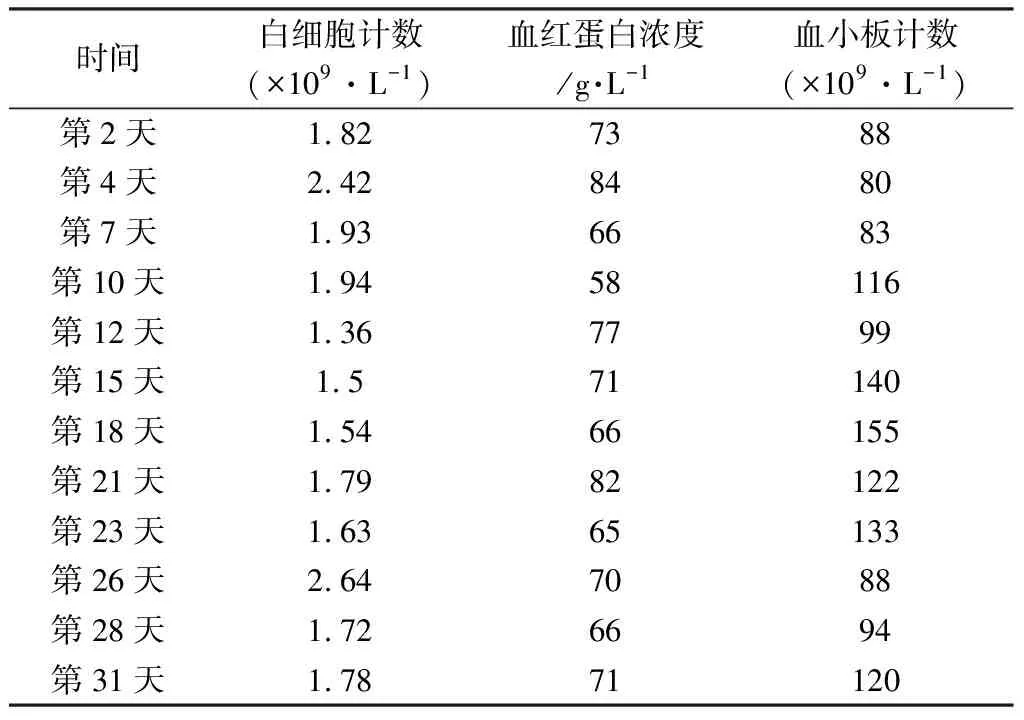
表1 住院期间患者血常规指标变化

表2 住院期间患者肝功能指标变化
伏立康唑主要由细胞色素CYP2C19代谢,因此伊马替尼对伏立康唑代谢的抑制作用较小,但仍有研究显示联合应用伊马替尼可能会升高体内伏立康唑的血药谷浓度[15]。鉴于目前我院尚无法检测伏立康唑的血药浓度,结合伏立康唑主要引起的不良反应包括幻觉、肝功能损害及视觉损害等[16]。联合用药期间,密切监测患者肝功能变化及是否出现幻视等精神症状,未见伏立康唑相关不良反应的发生。
联合用药期间,患者血象保持稳定,炎症指标明显改善(见表3),提示患者原发病及肺部感染控制良好,整体治疗方案有效。出院后可继续口服伏立康唑联合伊马替尼治疗。
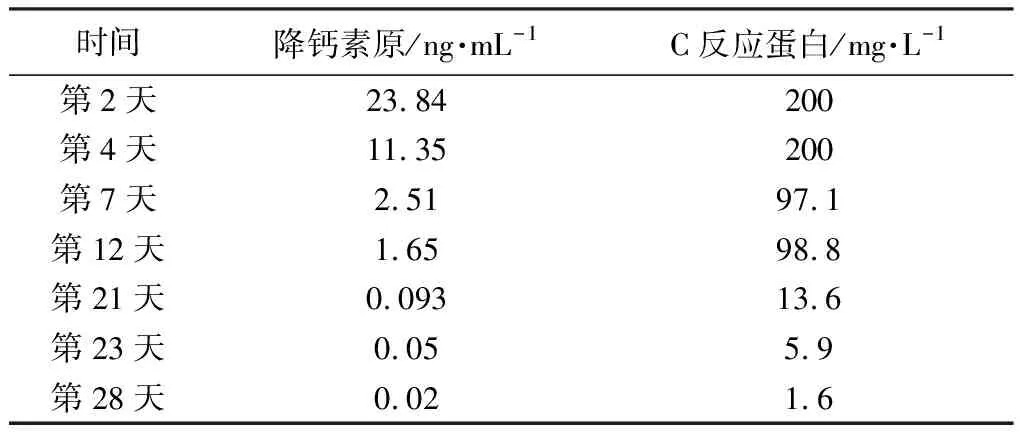
表3 炎症指标变化
4 小结
通过对此次病例的分析,临床药师建议临床医师在联合使用伏立康唑与伊马替尼治疗的过程中,注意药物相互作用,联合用药初始阶段可根据患者的病情和药物耐受情况将伊马替尼剂量减半,后续根据药学监护情况逐步提升伊马替尼的用量。必要时要进行伊马替尼的血药浓度监测,并及时根据血药浓度调整药物治疗方案,并密切监测药物不良反应,提高患者的用药安全。

