乌司他丁通过AMPK/Nrf2通路对急性肺损伤新生大鼠肺组织保护作用的实验研究
姬改娜,王彩琳
(榆林市第二医院,陕西 榆林 719000)
急性肺损伤(Acute lung injury,ALI)是由多种致病原因导致的肺部损伤,严重者可发展为急性呼吸窘迫综合征甚至死亡[1-2]。目前尚无治疗ALI的特效药物,临床上主要采取机械通气、抗生素、糖皮质激素、表面活性剂以及抗氧化剂等对症治疗方案[3-4],因此寻求有效的防治手段成为亟待解决的问题。乌司他丁(Ulinastatin,UTI)是一种广谱蛋白酶抑制剂,具有抑制纤维蛋白的分解和稳定溶酶体膜的作用,临床用于急慢性胰腺炎、急性循环衰竭等的治疗[5]。研究[6-7]表明,UTI可通过抑制细胞凋亡而减少炎性介质的释放,从而减轻组织炎性损伤。然而UTI在ALI中的研究目前鲜有报道。腺苷酸活化蛋白激酶(AMP-activated kinase,AMPK)/核因子E2相关因子2(Nuclear factor erythroid-2 related factor 2,Nrf2)信号通路在体内抵抗氧化应激和改善脂质沉积过程中发挥重要作用。Nrf2是细胞防御系统抵抗氧化应激的主要调节因子,AMPK是细胞能量稳态和炎症的中心调节剂,能够调节脂肪酸生物合成,并抑制氧化应激和炎性反应。由于Nrf2和AMPK在氧化应激和脂质代谢中的关键作用,该通路可作为治疗肝脏脂质浸润和炎症的潜在治疗靶标。因此,本研究通过观察UTI对ALI大鼠的作用,并尝试从AMPK/Nrf2信号通路探讨其可能的作用机制,期望为临床应用提供参考依据。
1 材料与方法
1.1 实验材料 ①实验动物:30只足月新生SD大鼠,购自西安交通大学实验动物中心,许可证号SYXK(陕)2020-005,常规饲养,正常昼夜循环,自由进食饮水,实验开始前适应性饲养1周。②实验试剂:乌司他丁注射液:广东天普生化医药股份有限公司,国药准字H20040505;活性氧(ROS)、超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒:上海碧云天生物技术有限公司;多聚甲醛:北京索莱宝科技有限公司;ELISA试剂盒:美国TSZ公司;总RNA提取试剂盒、逆转录试剂盒、BCA蛋白检测试剂盒:日本TAKARA公司;Nrf2、血红素加氧酶1(HO-1)、醌氧化还原酶1(NQO-1)、AMPK试剂盒、Trizol试剂:美国Invitrogen公司。
1.2 实验方法
1.2.1 ALI模型建立及分组:随机将30只大鼠分为对照组、ALI组和ALI+UTI组,每组10只。ALI组和ALI+UTI组大鼠建立高氧ALI模型:将大鼠置于玻璃高氧箱中,用钠石灰铺满底部,持续通入医用氧气,确保箱内氧浓度≥85%,持续暴露7 d以建立ALI模型,大鼠呈现明显的氧依赖性表现,活动减少、反应迟钝、精神萎靡、烦躁不安、皮肤毛发无光泽、口周发绀即建模成功。对照组全程自由呼吸常压空气。ALI+UTI组大鼠腹腔注射10 万U/kg的UTI 0.9%氯化钠溶液溶液,对照组和ALI组腹腔注射等体积的0.9%氯化钠溶液。
1.2.2 肺组织病理学观察:麻醉处死大鼠后取部分肺组织,将其置于4%多聚甲醛溶液中,经室温固定、脱水、包埋和石蜡切片,用苏木精-伊红(HE)染色,采用光学显微镜下观察肺组织病理学变化。
1.2.3 肺组织湿干(W/D)比测定:使用PBS缓冲液冲洗肺循环,分离左肺并称重,记录湿肺重量(W);将湿肺置于60 ℃烘箱中烘干48 h,再次称重,记录干肺重量(D),计算W/D值。
1.2.4 支气管肺泡灌洗液(BALF)采集:通过气管缓慢向肺内注入5 ml PBS缓冲液,缓慢抽出,反复3次,收集最后一次抽出的液体,即为BALF,4 ℃下2000 r/min离心10 min,分离上清,冻存于-80 ℃备用。
1.2.5 BALF中炎症因子表达检测:取冻存的BALF,采用酶联免疫吸附法(ELISA)检测BALF中肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)的表达水平。
1.2.6 肺组织氧化应激指标检测:取部分肺组织,称重,加入冰PBS缓冲液制备成10%的组织匀浆,离心,分离上清,ROS采用荧光酶标仪检测,SOD采用黄嘌呤氧化酶法检测,MDA采用硫代巴比妥酸法检测,所有操作均严格按照试剂盒说明书。
1.2.7 肺组织Nrf2、HO-1、NQO-1 mRNA表达水平检测:以Trizol试剂提取肺组织中RNA,应用逆转录试剂盒将总RNA逆转录为cDNA文库,以β-actin作为内参,计算Nrf2、HO-1、NQO-1 mRNA的相对表达,引物序列见表1。

表1 引物序列
1.2.8 肺组织pAMPK/AMPK、Nrf2蛋白表达水平检测:取部分肺组织,冰冷的PBS洗涤3次、剪碎、过200目筛研磨,收集研磨后的肺组织,加入裂解液,提取总蛋白,采用Western blot法按试剂盒说明书操作测定pAMPK/AMPK、Nrf2蛋白表达水平。

2 结 果
2.1 各组大鼠肺组织病理学变化 对照组大鼠肺组织结构完整,肺泡间隔均匀且壁薄,无水肿和炎性细胞浸润改变。ALI组大鼠肺组织结构紊乱、不规则,肺泡管腔增大且壁间隔增厚,出现明显的水肿,肺间质呈现弥漫性充血,有大量炎性细胞浸润。ALI+UTI组较ALI组肺组织损伤情况明显减轻,纤维渗出或炎性细胞浸润减少,肺泡排列趋于规则整齐,水肿减轻,肺泡壁变薄。见图1。

图1 各组大鼠肺组织病理学变化(HE染色,×400)
2.2 各组大鼠肺组织W/D比比较 与对照组比较,ALI组和ALI+UTI组大鼠肺组织W/D比升高(均P<0.05);与ALI组比较,ALI+UTI组大鼠的肺组织W/D比降低(均P<0.05)。见表2。
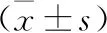
表2 各组大鼠肺组织W/D比较
2.3 各组大鼠BALF中炎性因子表达水平比较 ALI组、ALI+UTI组大鼠BALF中TNF-α、IL-1β、IL-6表达水平均高于对照组(均P<0.05);ALI+UTI组大鼠BALF中TNF-α、IL-1β、IL-6的表达水平低于ALI组(均P<0.05)。见表3。

表3 各组大鼠BALF中炎性因子表达水平比较(pg/ml)
2.4 各组大鼠肺组织氧化应激指标比较 与对照组相比,ALI组和ALI+UTI组大鼠肺组织中ROS、MDA表达显著升高、SOD表达显著降低(均P<0.05);与ALI组相比,ALI+UTI组大鼠肺组织中ROS、MDA表达显著降低、SOD表达显著升高(均P<0.05)。见表4。
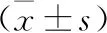
表4 各组大鼠肺组织氧化应激指标比较
2.5 各组大鼠肺组织Nrf2、HO-1、NQO-1 mRNA相对表达水平比较 对照组和ALI组大鼠肺组织中Nrf2及其下游基因HO-1和NQO-1 mRNA的相对表达水平比较无统计学差异(均P>0.05);而ALI+UTI组大鼠肺组织中Nrf2及其下游基因HO-1和NQO-1 mRNA的相对表达均显著高于对照组和ALI组(均P<0.05)。见表5。
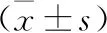
表5 各组大鼠肺组织Nrf2、HO-1、NQO-1 mRNA相对表达水平比较
2.6 各组大鼠肺组织中pAMPK/AMPK、Nrf2蛋白表达水平比较 对照组和ALI组大鼠肺组织中pAMPK/AMPK蛋白、Nrf2蛋白表达比较无统计学差异(均P>0.05);ALI+UTI组大鼠肺组织中pAMPK/AMPK蛋白、Nrf2蛋白表达高于对照组和ALI组(均P<0.05)。见表6。
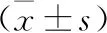
表6 各组大鼠肺组织中pAMPK/AMPK、Nrf2蛋白表达水平比较
3 讨 论
ALI为临床较为常见的呼吸系统危急重症,是由于炎性介质和效应细胞的共同作用而引发的肺实质性损伤,是全身炎症反应综合征在肺组织的表现,其主要病理特征为炎性介质迁移浸润、肺泡上皮细胞受损以及渗透性水肿,炎性介质浸润引起调控网络失控,从而导致肺泡上皮细胞和内皮细胞受损,嗜中性粒细胞在外界刺激下募集并激活,释放大量的超氧化酶和自由基,对肺泡上皮细胞和内皮细胞造成损伤,进而间接引发肺水肿[8-9]。
乌司他丁是一种从健康成年男性的新鲜尿液中分离提纯所得的糖蛋白,是一种广谱蛋白酶抑制剂,对胰蛋白酶、组织蛋白酶G、血纤维蛋白溶酶、粒细胞弹性蛋白酶、糜蛋白酶等多种炎性蛋白水解酶均具有抑制作用,可减少巨噬细胞在内毒素的刺激下释放炎性因子,从而拮抗炎症级联反应,具有抗炎、抗氧化、抗凋亡和维持内环境稳态等作用[10]。本研究采用高氧诱导建立ALI大鼠模型,发现ALI组大鼠肺组织W/D相比对照组增大,同时组织病理学观察可见ALI组大鼠肺组织结构紊乱、不规则,肺泡管腔增大且壁间隔增厚,出现明显的水肿,肺间质呈现弥漫性充血,有大量炎性细胞浸润,提示ALI建模成功;经UTI治疗后,ALI+UTI组大鼠肺组织W/D比显著降低,同时肺组织水肿减轻、肺泡排列趋于规则整齐,纤维渗出或炎性细胞浸润减少,提示UTI可显著改善ALI大鼠的肺组织损伤。炎性反应的失控、炎性因子和效应细胞的互相激活和作用,导致进一步放大的炎症级联反应与ALI的发生发展密切相关。有学者[11]研究发现,ALI大鼠肺组织中TNF-α、IL-12和IL-18等炎性因子呈现高表达,大量炎性因子进入肺组织可引起肺水肿和蛋白渗漏,造成肺损伤,而快速的控制肺部过度的炎性反应是治疗ALI的关键。Choi等[12]亦报道称,TNF-α、IL-6及弹性蛋白酶等炎症介质的生成和释放是引发ALI 的重要影响因素。既往研究[13-14]证实,UTI可抑制炎性因子TNF-α、IL-6等的释放、弹性蛋白酶的活性以及中性粒细胞与内皮细胞的黏附,阻断三者间的相互作用,从而减轻内皮损伤,抑制炎症级联反应,发挥对ALI肺损伤的保护作用。在本研究中,ALI组和ALI+UTI组大鼠BALF中TNF-α、IL-1β和IL-6的表达水平均显著高于对照组,提示炎性反应可能与ALI的发生发展有关;经UTI治疗后,ALI+UTI组大鼠BALF中TNF-α、IL-1β和IL-6的表达水平与ALI组相比显著下降,提示UTI可抑制炎性因子的释放从而发挥对ALI的治疗作用。SOD具有抗氧化和抗自由基的功能,可有效对抗机体受到氧自由基的损伤,对于抵御机体氧化应激至关重要[15-17]。本研究中,ALI组和ALI+UTI组大鼠肺组织中ROS和MDA的表达显著升高、SOD的表达显著降低,提示ALI组和ALI+UTI组大鼠体内存在明显的氧化应激损伤;与ALI组相比,ALI+UTI组大鼠肺组织中ROS和MDA的表达显著降低、SOD的表达显著升高,提示UTI可通过抵御ALI大鼠机体内的氧化应激损伤而发挥对肺组织的保护作用。
Nrf2是广泛存在于高等动物体内的转录因子,当机体内发生氧化应激反应时,Nrf2的抑制因子Keap 1构象改变而与Nrf2结合力降低,Nrf2从Keap 1上释放并与抗氧化反应元件相结合,启动下游抗氧化基因,进而抵御各种内外因素所导致的氧化应激状态[18-20]。本研究结果显示,ALI+UTI组大鼠肺组织中Nrf2及其下游基因HO-1和NQO-1 mRNA的相对表达均显著高于对照组和ALI组,提示UTI可通过激活Nrf2通路从而抵御ALI的氧化应激状态。AMPK是由三条肽链组成的丝/苏氨酸蛋白激酶,参与调节机体分解合成代谢、内皮功能、炎性反应和氧化还原反应等多项生理病理过程,是机体能量代谢的重要调控剂,有研究表明,AMPK的活化可抑制异常炎性反应和氧化应激状态。本研究通过检测AMPK/Nrf2信号通路的相关蛋白发现,ALI+UTI组大鼠肺组织中pAMPK/AMPK显著高于对照组和ALI组,同时ALI+UTI组大鼠肺组织中Nrf2蛋白的表达显著高于对照组和ALI组,提示UTI可诱导增加AMPK的磷酸化,激活AMPK/Nrf2通路,上述结果提示UTI对高氧诱导的ALI大鼠的保护作用可能与调控AMPK/Nrf2信号通路有关。
综上所述,本研究表明,UTI可通过AMPK/Nrf2通路,激活AMPK磷酸化而增强Nrf2及其下游基因的活性,有效缓解高氧诱导的ALI,UTI可作为临床治疗ALI的备选药物之一。然而,UTI是否还借助其他机制通路发挥对ALI肺组织的保护作用,仍有待进一步的研究。

