辛伐他汀对创伤性脑损伤小鼠继发性炎症抑制作用及机制研究
李张珂,马 涛,满明昊,田 博
(1.西安国际医学中心医院,陕西 西安 710100;2.空军军医大学唐都医院,陕西 西安 710038)
创伤性脑损伤(Traumatic brain injury,TBI)是战争时期及现代社会生活中一种临床常见创伤类型,具有发生率高、致残率高和病死率高的特点[1]。TBI的病理过程包括原发机械性损伤与复杂的生化代谢机制改变而起的继发性损伤,其中原发性损伤即因外力所致的脑组织挫裂伤、出血和神经元丢失等;继发性损伤的病理机制,包括代谢毒物产生、氧化应激、炎性反应和细胞凋亡等[2]。现有研究[3]表明,炎性反应与TBI后继发性脑损伤的进展密切相关,对损伤的范围与程度均有较大影响。因此,探索TBI后如何减轻继发性炎性反应,对改善患者的临床结局有重要的意义和价值。辛伐他汀是一种半合成的他汀类降脂药物,由土曲霉素降解产物衍生而来,作为一种内源性胆固醇抑制剂,可达到减少炎症因子表达的效果,实现抗炎、抗凋亡、保护神经功能、减少脑组织水肿的作用[4-5]。有研究[6]证实,辛伐他汀通过降低TLR4介导的NF-κB通路,进而抑制白细胞介素1β (IL-1β)表达水平,实现降低脑出血后过度炎性反应的效果。也有研究[7]发现,辛伐他汀对抑制平滑肌细胞增殖和转移具有积极意义,能促使内皮一氧化氮合成水平不断上升,有效调节血管紧张度和内皮功能,保护神经细胞。而在对于颅脑疾病的作用中,有研究[8-9]表明,辛伐他汀在脑出血患者的神经功能恢复过程中可以起到积极作用。然而,关于辛伐他汀在TBI后炎性反应的作用却仍不明确。鉴于此,本研究通过观察辛伐他汀对TBI小鼠预后的影响,探讨辛伐他汀对于TBI的抗炎和神经保护作用。
1 材料与方法
1.1 实验材料 36只6~8周成年雄性C57小鼠,购自空军军医大学实验动物中心,体重20~25 g。在室温23~28 ℃、湿度45%~50%、12 h明暗交替环境中适应性饲养4周。辛伐他汀(钠盐形式)购自默克公司;各种手术器械购买自西安福鑫医疗科技有限公司;0.9%氯化钠溶液购自山东鲁抗医药股份有限公司;水合氯醛购自上海谱振生物科技有限公司。
1.2 实验方法
1.2.1 分组和模型建立:将36只小鼠随机均分成三组:损伤组(TBI组)、损伤后应用辛伐他汀组(DI组)和假手术组(Sham组)。各组均以10%的水合氯醛(10 mg)麻醉小鼠,手术区消毒剃毛,并沿中轴切开头皮;在左顶叶上方开放直径约3 mm的骨窗,放置垫片与直径2 mm的撞针,在此期间注意保护硬膜的完整;进而对TBI组和DI组小鼠进行改良Feency自由落体撞击造模,小鼠俯卧固定于撞击器定位仪,40 g砝码自35 cm沿长管自由落体撞击撞针;止血后,清洗伤口后缝合头皮。Sham组的小鼠仅以相同操作开骨窗后缝合,不进行打击。若小鼠在暂发的呼吸暂停和四肢抽搐后持续昏迷2 h以上,则判断此次造模成功。
1.2.2 药物干预:选用羧甲基纤维素钠(0.5%)配置1.5 mg/ml辛伐他汀溶液,4 ℃保存。判断造模成功后,DI组小鼠立即通过腹腔注射给药,用量为20 mg/kg,Sham组和TBI组小鼠在同一时间点注射等体积量的0.9%氯化钠溶液,每24 h注射1次,连续7次。
1.2.3 神经损伤评分:TBI后第1、3、7天对各组小鼠进行行为学评分,本研究采用神经损伤评分(mNSS),依照测试量表操作,满分为18分,试验小鼠所得评分越高即说明神经损伤越重。
1.2.4 脑组织含水量检测:每组中随机取3只小鼠,处死后取左侧脑半球,过程中注意剔除脑膜和血块;称重后于烤箱中60 ℃烤至质量不再改变,再次称重,含水量即为烘烤过程中的脑组织质量之差占原质量的百分比。
1.2.5 Western blot法检测脑组织炎症信号通路相关蛋白表达:脑创伤后7 d,每组各取3只小鼠,于腹腔注射超量的戊巴比妥钠溶液(80 mg/kg)处死小鼠,分离以损伤处为圆心直径约5 mm的皮质区域,期间注意操作应快速进行;加入合适剂量的RIPA裂解液后完全匀浆,待样本彻底变性后,取等量样本进行电泳分离,等待溴酚蓝位移到胶质底部,而后电转至孔径为0.45 μm的硝酸纤维膜,即PVDF膜上;室温下,采用5%的脱脂牛奶为封闭材料,封闭2 h;进而添加一抗(TBK1,1∶1000;TLR4,1∶2000),置于4 ℃条件下孵育过夜;第2天,加入对应二抗,室温下孵育2 h后发光拍照。
1.2.6 ELISA检测脑组织IL-1β和肿瘤坏死因子α(TNF-α)的表达:于造模成功的第7天,从三组中各自随机抽选3只小鼠,用过量的戊巴比妥钠(80 mg/kg)处死小鼠,在冰台上,保证低温条件,快速分离以损伤处为中心直径5 mm皮质区域;用ELISA试剂盒的规范步骤检测脑组织TNF-α、IL-1β的表达。
1.2.7 免疫荧光检测小胶质细胞状态:各组取3只小鼠,7 d 后鼠脑整体取出后放入4%多聚甲醛溶液固定12 h,分别用20%、30%蔗糖溶液对脑组织进行脱水至其可以沉于容器底部。冰冻切片厚度定为20 μm,于冰箱中-20 ℃保存,使用时复温30 min。缓慢滴加0.3% Triton X-100溶液在切片表面,后选用10%驴血清封闭。一抗(封闭血清稀释)混合后涂片,4 ℃层析过夜,与荧光素标记的二抗混合,然后涂片。室温孵育2 h,并在避光环境下进行后续步骤。磷酸盐缓冲液(PBS)漂洗5 min,共漂洗3次,最后滴加DAPI染液,对细胞核染色、封片、避光观察。

2 结 果
2.1 辛伐他汀对TBI小鼠神经行为学的影响 Sham组小鼠在TBI后第1、3、7天的mNSS评分改变差异无统计学意义(P>0.05)。相比于Sham组,TBI组和DI组小鼠的mNSS评分显著升高(均P<0.001),与TBI组小鼠相比,DI组小鼠的评分明显降低(均P<0.001),即辛伐他汀有改善小鼠的神经功能的作用。见图1。

注:各组两两比较,*P<0.05,△P<0.01,#P<0.001
2.2 辛伐他汀对TBI小鼠脑组织含水量的影响 相较于Sham组[(76.10±0.42)%],损伤后TBI组小鼠脑组织含水量明显上升[(87.38±3.12)%,P<0.001];而对比TBI组辛伐他汀治疗能够显著降低TBI小鼠脑组织含水量[(80.75±0.98)%,P<0.05]。见图2。

注:各组两两比较,△P<0.01,#P<0.001
2.3 辛伐他汀对TBI小鼠脑组织中炎症因子表达的影响 与Sham组比较,TBI组小鼠脑组织TNF-α、IL-1β的表达上调(均P<0.001);而对比TBI组,DI组的辛伐他汀治疗可以降低小鼠脑组织中TNF-α、IL-1β的表达(均P<0.01)。见图3。

注:各组两两比较,△P<0.01,#P<0.001
2.4 辛伐他汀对TBI小鼠脑组织小胶质细胞活化的影响 术后7 d后对小鼠脑组织做免疫荧光检测TBI后脑组织中小胶质细胞的活化情况,与Sham组相比,TBI组小鼠损伤区周围组织中出现了大量活化的小胶质细胞,其特征为胞体较大突起变短,呈典型阿米巴样;而DI组的小胶质细胞相较TBI组数量上有明显减少,且出现胞体变小突起变长的现象,即辛伐他汀抑制了小胶质细胞的活化。见图4。
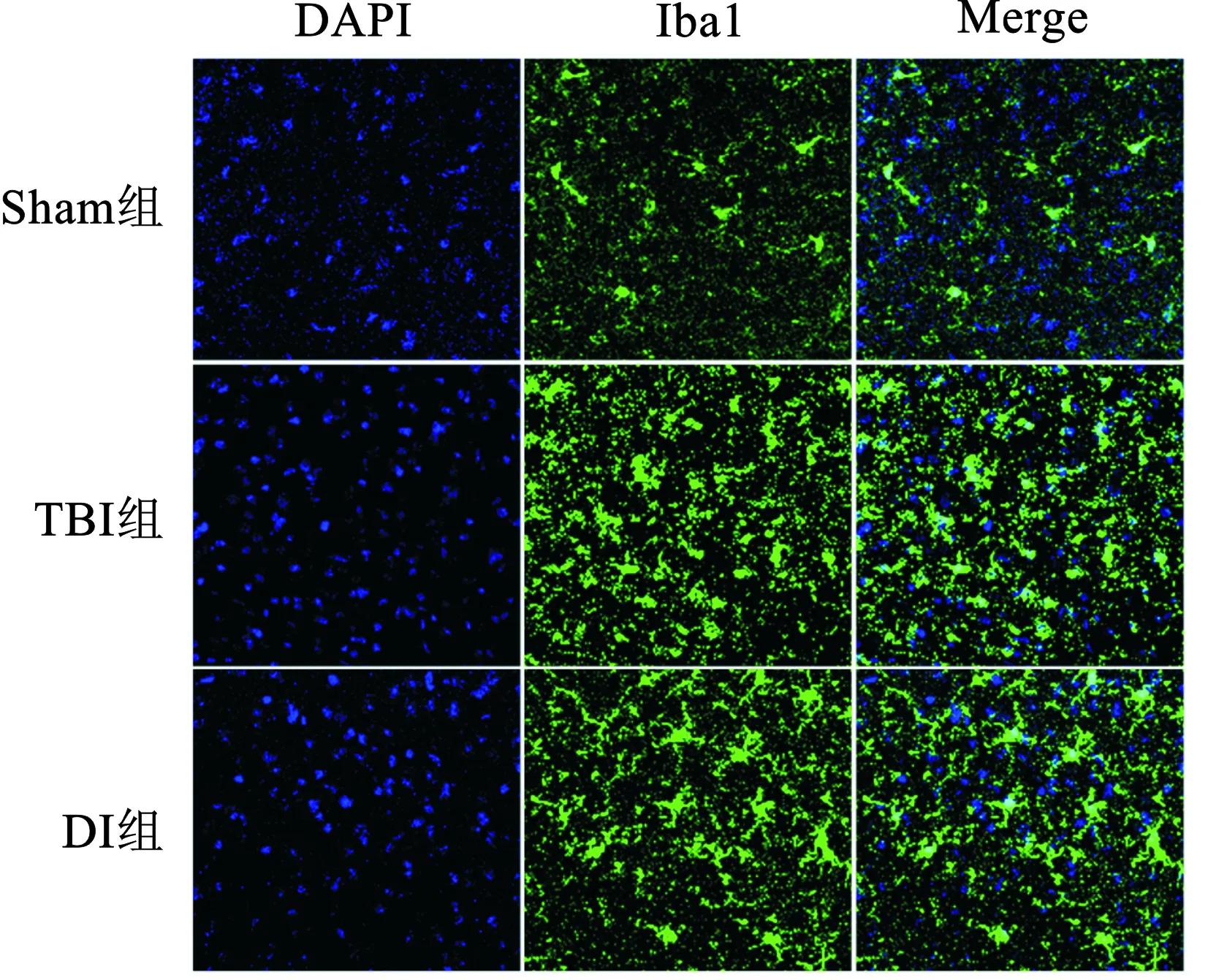
图4 三组小鼠脑组织中小胶质细胞形态比较(免疫荧光染色,×200)
2.5 辛伐他汀对TBI小鼠脑组织中炎症信号通路相关蛋白表达的影响 与Sham组比较,TBI小鼠脑组织中TBK1、TLR4蛋白表达上调(均P<0.01);相较于TBI组,DI组中的辛伐他汀治疗可以降低炎症信号通路相关的TBK1(P<0.01)、TLR4(P<0.05)蛋白含量。见图5。

注:各组两两比较, *P<0.05,△P<0.01
3 讨 论
既往报道显示,神经炎性反应的机制包括脑组织中胶质细胞激活、外周循环炎症细胞浸润和炎症细胞因子(如趋化因子、白细胞介素、肿瘤坏死因子)等介质的释放;在组织受损初期,适当的炎性反应能够清除坏死的组织细胞,为神经修复提供相宜的微环境,起到神经保护的作用[10]。然而,研究证据进一步揭示,随着小胶质细胞和星形胶质细胞的持续异常活化,小胶质细胞能够通过CD14依赖途径对神经元直接产生毒性作用,而被激活的星形胶质细胞会产生大量的神经毒性物质,通过分泌TNF-a、IL-6、ApoE以及S100β蛋白等胞外酶加重炎性反应,造成神经组织的进一步损伤;失控的神经炎性反应可加重TBI继发的脑组织水肿,导致颅内压升高,影响脑组织的供血情况,进而压迫正常的神经组织,最终导致神经元死亡,限制伤后机体的恢复和相关功能的预后[11-13]。因此,TBI后抑制或减轻炎性反应对于患者神经功能的保护及临床结局有着重要的意义[14]。
辛伐他汀作为内源性胆固醇抑制剂,是一种临床上常用的他汀类降脂药,研究[6,15-18]发现,其可改善血管内皮功能、抗血小板聚集、改善高血脂高血压、调节骨代谢水平、降低哮喘症状和抑制炎性反应。还有研究[19]证实,辛伐他汀能够显著降低IL-1、Caspase-1、IL-18及NLRP3蛋白的表达水平,具有改善阿尔茨海默小鼠的学习与记忆能力的作用。在急性脑梗死患者治疗中,辛伐他汀也有显著的疗效,可明显地降低患者神经功能损伤程度,改善患者的临床结局[20]。此外,辛伐他汀对脑动脉粥样硬化患者具有降低炎性因子水平的作用,并且在临床上联合抗栓治疗干预脑梗死效果显著,能够明显降低血脂和炎性因子含量[21-22]。然而,有关辛伐他汀对TBI后继发性炎性反应的治疗作用仍然缺少相关实验研究,因此,本实验通过研究辛伐他汀对于TBI后炎性反应相关因素的影响,探讨辛伐他汀对于TBI后炎性反应的抑制作用及机制。
本研究中,我们通过比较Sham组、TBI组和DI组中小鼠造模手术后第1、3、7 天的mNSS评分发现,造模手术后,TBI组、DI组的神经功能受到明显损害;而在用药后DI组mNSS评分较TBI组有所降低,说明辛伐他汀对小鼠的神经功能起到了一定的保护作用;进一步检测各组小鼠脑组织含水量,结果显示,相较于Sham组,TBI组的小鼠脑组织含水量有明显升高,而辛伐他汀干预后,DI组小鼠的脑组织含水量明显降低;此后我们以ELISA法对各组小鼠脑组织中炎症因子的表达水平进行检测,发现TBI组与DI组小鼠的TNF-α、IL-1β的表达水平较Sham组明显上调,对比TBI组与DI组数据,显示辛伐他汀的干预同时下调了该两种主要炎症因子TNF-α、IL-1β在DI组小鼠组织中的表达水平;进一步利用免疫荧光法观察了各组小鼠脑组织中小胶质细胞的活化程度,结果证实,与TBI组相比,应用辛伐他汀干预后,DI组小鼠脑组织中小胶质细胞的活化状态明显发生改变,其胞体变小,突起变长,提示应用辛伐他汀后可有效抑制损伤后小胶质细胞的活化状态;最后,我们以Western blot法探究炎症信号通路相关蛋白TBK1、TLR4在受损组织中的表达,数据表明,相较于Sham组,TBI组与DI组的小鼠脑组织的蛋白表达明显升高,对比TBI组,DI组小鼠的受损区域脑组织中TBK1、TLR4蛋白表达显著降低。
综上所述,本研究通过实验发现辛伐他汀可抑制TBI后小胶质细胞的活化状态,下调TBK1、TLR4等炎症信号通路相关蛋白表达,进一步降低下游TNF-α、IL-1β等炎症因子表达,抑制了过强的炎性反应,从而有效降低TBI小鼠mNSS评分,保护了小鼠伤后的神经功能,提高了小鼠的运动能力,其分子机制可能是通过降低TBI小鼠脑组织中TBK1、TLR4蛋白的表达水平实现。接下来的研究工作,应继续探索辛伐他汀作为TBI的治疗手段应用临床的可行性,以及相应的施药时机、使用剂量、持续时间对TBI后继发炎性反应疗效的影响,以期早日服务于临床实践。

