林窗凋落物化感作用对格氏栲幼苗生长的影响
晋梦然,贾梅花,肖倩茹,刘金福,沈彩霞,施友文,何中声,*
1 福建农林大学林学院,福州 350002 2 福建农林大学海峡自然保护区研究中心,福州 350002 3 生态与资源统计福建省高校重点实验室,福州 350002 4 福建省三明莘口格氏栲自然保护区服务站,三明 365000 5 福建省林业调查规划院,福州 350003
林窗是森林群落中乔木层树木个体死亡形成的空隙[1],通过改变光照强度影响植物光合作用及蛋白质合成,间接影响了植物形态特征和生理结构[2]。林窗大小是森林重要的空间特征,随林窗面积增加林下层接收光合有效辐射上升[3],加快了土壤表层水分蒸发,植物通过缩小或关闭叶片气孔以降低水分散失,降低了植物体内渗透调节物质累积[3—4],从而影响幼苗生长。大林窗较强光照可能灼伤新生叶片,对叶片组织造成不可逆的损伤,导致植物枯萎或死亡[5];郁闭的林冠层削弱了光合有效辐射强度,植物光合速率下降,植物生长相对缓慢[6]。适宜的林窗大小通过避免强光和弱光环境对幼苗生长的抑制作用,提高了植物适应性,进而促进幼苗生长[7]。因此,阐述不同林窗大小下植物生长和生理特征差异,有助于进一步理解植物在林窗中的适应策略。
林窗形成调节了森林凋落物组成和产量,改变了凋落物化感物质种类与含量[8—9]。凋落物经雨水淋溶、土壤动物和微生物作用释放化感物质并影响植物生长[10]。目前,凋落物水浸提液是研究森林化感作用的有效手段,其浓度高低直接影响幼苗生理生化进程[11]。低浓度凋落物浸提液中化感物质含量较低[12],部分化感物质氧化分解可为土壤提供养分资源,调节了幼苗光合生理过程[13]。当化感物质浓度超过幼苗耐受阈值时,可能会破坏植物细胞生物膜,导致植物体内功能系统紊乱、有害物质和防御物质失衡等,从而抑制植物生长[14—17]。凋落物化感作用通过其化感物质浓度高低调节幼苗光合与呼吸作用等抑制或促进其生长,间接影响森林植物更新[12]。林窗形成增加了光照和降水对地表凋落物分解的淋溶作用,并通过释放化感物质改变了植物体内渗透调节物质含量,进而影响了植物生长[18]。因此,探讨林窗、凋落物化感作用是否存在协同效应,及其协同效应对植物生长的影响机理,对林窗幼苗更新具有重要参考价值。
格氏栲(Castanopsiskawakamii)为中亚热带常绿阔叶高大珍稀乔木,零星分布于中国福建、江西和广西等地,福建三明有700 hm2以格氏栲为优势树种的天然林分,堪称“世界格氏栲林”[19]。目前,格氏栲林内幼苗和幼树数量较少,种群年龄结构呈“倒金字塔”型,导致林冠层破碎化严重,林窗数量逐渐增多[20]。林窗形成有利于格氏栲种子散布与幼苗更新[20—21],而凋落物化感物质对其种子萌发和幼苗生长具有高浓度抑制低浓度促进的“低促高抑”作用[22]。然而,林窗形成影响了林内光照条件[20—21],改变了凋落物化感物质的种类和含量[23],而林窗与凋落物化感作用的协同效应是否影响格氏栲幼苗生长尚未报道,限制了对林窗幼苗更新机制的理解。因此,通过模拟林窗与非林窗光照条件,探讨林窗-凋落物化感作用对格氏栲幼苗生长的影响,旨在解决:(1)格氏栲幼苗高度、渗透调节物质和叶绿素荧光特征在不同大小林窗和凋落物化感作用之间的差异性;(2)揭示适宜格氏栲幼苗生长的林窗尺度与凋落物浸提液浓度,为实现格氏栲幼苗自然更新提供理论依据。
1 试验材料与方法
1.1 研究区概况
格氏栲自然保护区位于福建省三明市郊,地理坐标为26°07′—26°10′N,117°24′—117°27′E,海拔180—604 m,年平均气温19.5℃,年平均降雨量1500 mm,属亚热带季风气候,土壤类型为酸性铁铝土。格氏栲天然林郁闭度高达0.8,林冠层平均树高15 m,平均胸径30 cm,格氏栲种群平均年龄100年左右。林内主要乔木树种有格氏栲、杉木(Cunninghamialanceolata)、木荷(Schimasuperba)、马尾松(Pinusmassoniana)、桂北木姜子(Litseasubcoriacea)等[24—25]。
1.2 林窗光照环境模拟
2018年4月于三明格氏栲保护区内,利用尼康相机D7200搭配鱼眼镜头(NIKON DX AF FISHEYE NIKKOR 10.5 mm 1∶2.8 GED)在林窗中央距离地面1 m位置垂直向上拍摄照片,采用双半球面影像法计算林窗面积[26],选择3个大林窗(≥200 m2)、3个中林窗(50—100 m2)和3个小林窗(30—50 m2),在距离林窗10 m处设置3个10 m ×10 m 的非林窗,共 12 个样地[21]。在不同大小林窗与非林窗东、南、西、北和中央五个方位设置凋落物收集框,逐月收集林窗不同方位凋落物,带回实验室置于通风处晾干备用。
2019年6月选择晴朗无云的天气,于8:30、10:00、15:00、16:30,在林窗与非林窗南北边缘及中央位置,利用泰仕照度计(TES1332A,台湾泰仕,中国台湾)测量距地表1.5 m处光照强度,共测量4 d。取3个方位平均值作为大、中、小和非林窗的光照强度,分别为40109 lux、20367 lux、11059 lux和9617 lux,计算光照强度比例约为4.17∶2.12∶1.15∶1。依据大、中、小和非林窗光照强度比例,在福建农林大学布设遮阳棚(1.43 m×1.43 m×1.95 m),且覆盖1层、2层、4层、4层黑色PVC网格布以模拟林窗光照。
1.3 凋落物浸提液制备
将凋落物按大、中、小和非林窗分别混合,烘干粉碎至1—2 cm大小,按1∶10(1 g干物质中加入10 mL蒸馏水)比例加入适量蒸馏水,常温浸泡48 h,用干净纱布过滤2次,将滤液经真空泵抽滤制备1∶10浓度浸提液[25](C1)。将原液稀释3、5和10倍,制备成1∶30(C2)、1∶50(C3)和1∶100(C4),共4种不同浓度浸提液,共得到4(林窗)×4(浓度)=16种浸提液,放入4℃冰箱中备用,每个林窗均以蒸馏水代替浸提液为对照处理(CK)。
1.4 幼苗试验
受试格氏栲幼苗由福建农林大学海峡自然保护区研究中心培养,2019年4月选取长势基本一致的格氏栲幼苗(平均幼苗高度为(58±0.4)mm),移植于30×20×18 cm的育苗盆中,每盆种植6株,缓苗2个月。缓苗结束,将育苗盆移置遮光棚培养,每盆加入100 mL凋落物浸提液,每个浓度设置3个重复,并以等量蒸馏水处理为对照,共得到4(林窗)×4(浓度)×3(重复)+4(对照)×3(重复)=60盆幼苗,共计360株幼苗。育苗基质为高压灭菌后的格氏栲天然林土壤,每盆土层厚约10 cm。每周每次补浇100 mL浸提液,定期加等量蒸馏水以保持土壤湿润。每间隔2个月用卷尺(精度1 mm)从各株幼苗基部到主茎顶部测量一次幼苗高度,记为前期、中期和后期幼苗高度,整个试验持续6个月。试验结束测量叶片可溶性蛋白质含量、可溶性糖含量、叶绿素相对含量和叶绿素荧光参数。
1.5 指标测定
1.5.1渗透物质测定
采取测量结束的幼苗叶片若干,剪碎混合后称取0.2 g于预冷研钵中,加入适量液氮充分研磨至匀浆,利用0.05 mol/L、pH 7.8的磷酸缓冲液定容至4 mL离心管,于4℃下10000 rpm冷冻离心20 min,提取上清液为待测酶液[27],利用考马斯亮蓝染色法测定可溶性蛋白质含量。另取新鲜样品0.3 g,剪碎后放入15 mL离心管,加入5 mL蒸馏水,于80℃水浴锅中分别提取30 min(提取2次),提取液过滤入25 mL容量瓶中反复冲洗试管及残渣,定容至刻度,用蒽酮法测定可溶性糖含量[28]。每个样品测定设置3次重复。
1.5.2光合荧光指标测定
选择晴朗无云的天气,于8:00—10:00,利用便携式叶绿素仪(SPAD- 502 Plus,Konica Minolta Investment Ltd.,Japan)测定叶绿素相对含量,每个重复选取3株无明显病虫害的幼苗,每株幼苗选择3片完整叶片,在每个叶片中脉两侧均匀选取3个点测量,取其平均值为叶片的叶绿素相对含量(SPAD)。采用便携式叶绿素荧光参数仪(FlourPen FP100,Ecotech Ecological Technology Ltd.,Czech Republic),将叶片置于暗反应夹进行暗适应20 min,测定初始荧光Fo(Initial fluorescence),PSⅡ潜在活力Fv/Fo(PSⅡ potential activity),PSⅡ最大光化学效率Fv/Fm(PSⅡ maximal photochemical efficiency)。每个重复选取3株测量取平均值。
1.6 林窗化感效应的综合评价
为消除量纲影响,将收集的原始数据,按正、逆、适度指标分类后[29],运用极差变化法进行无量纲化处理,将幼苗生长、生理生化指标实际值转化为[0, 1]的值;为消除极端0值的影响,调整计算公式,具体方法参考文献[30]。试验设置4种林窗类型(大林窗、中林窗、小林窗和非林窗),每个林窗设置5个凋落物浸提液浓度,每个浓度设置3个重复,共设置4(林窗)×(4(浓度)+1(对照))=20种处理,作为林窗、浓度及二者协同效应的评价值。将前、中、后期幼苗高度、可溶性蛋白、可溶性糖、叶绿素相对含量、Fo、Fv/Fo和Fv/Fm等9种作为评价指标。正向指标:前、中、后期幼苗高度、叶绿素相对含量、Fv/Fo和Fv/Fm;逆向指标:初始荧光Fo;适度指标:可溶性蛋白、可溶性糖含量。为评估林窗、凋落物浸提液浓度及二者协同作用对格氏栲幼苗生长影响的大小,利用熵值法计算林窗、凋落物浸提液浓度及二者协同作用对格氏栲幼苗生长影响的综合效应得分,具体公式参考文献[30]。
1.7 数据处理与分析
采用Excel 2016对数据进行基本处理和绘图,采用SPSS 21.0中单因素方差分析林窗、凋落物化感作用及二者协同效应对格氏栲幼苗高度、叶绿素荧光和渗透调节物质的影响(Duncan检验),采用熵值法计算不同林窗大小、凋落物化感作用及二者协同效应对幼苗生长影响的综合评价值;利用R 3.6.3中“agricolae”包分析综合评价值在林窗、凋落物化感作用和二者协同作用之间差异性[31],揭示适宜格氏栲幼苗生长的林窗尺度及浸提液浓度。
2 研究结果
2.1 林窗对格氏栲幼苗高度和生理生化指标的影响
2.1.1幼苗高度
不同林窗大小对格氏栲幼苗前、中期苗高的影响无显著差异性(P>0.05)(图1),后期中林窗幼苗高度显著高于非林窗,不同林窗间无显著差异,林窗形成提高了格氏栲幼苗高度。
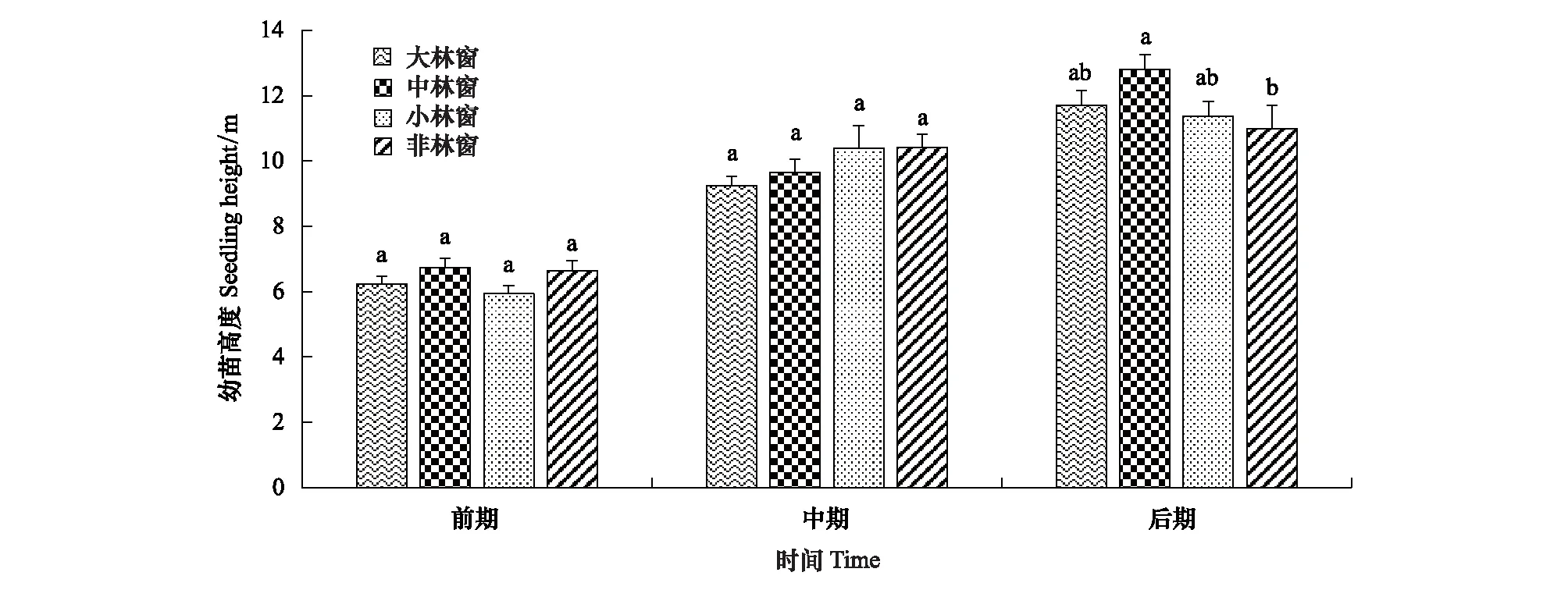
图1 林窗大小对格氏栲幼苗高度的影响Fig.1 Effects of gap sizes on the growth of C. kawakamii seedlings同一时期不同小写字母代表林窗间差异显著(P<0.05)
2.1.2幼苗渗透调节物质
小林窗格氏栲幼苗可溶性蛋白含量显著高于大林窗,可溶性糖含量显著低于其它林窗;非林窗幼苗可溶性糖含量显著高于其它林窗(图2)。
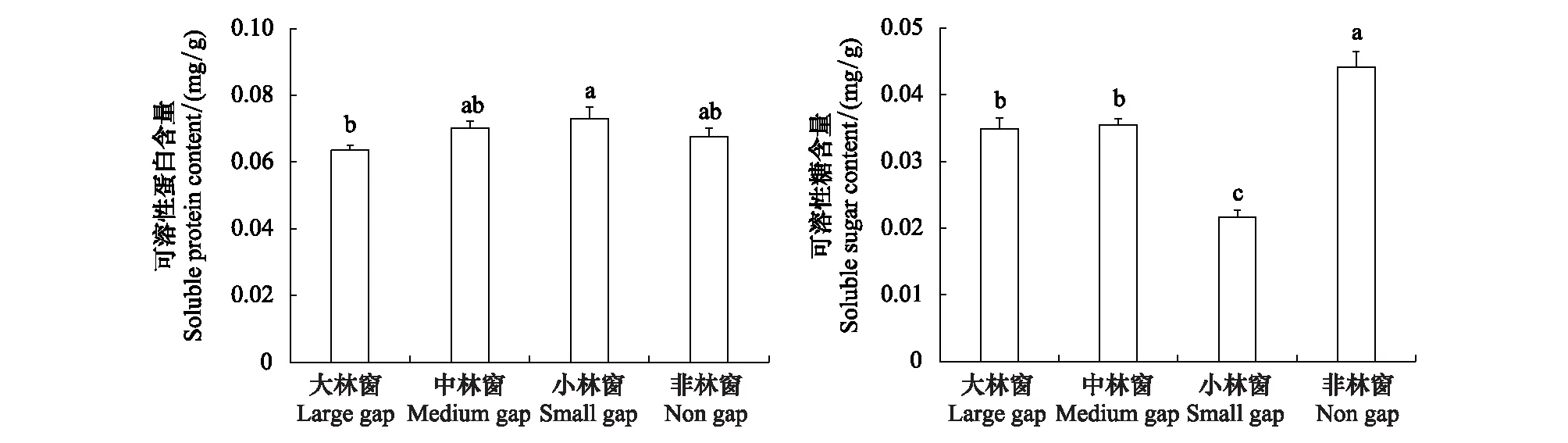
图2 林窗大小对格氏栲幼苗渗透调节物质的影响Fig.2 Effects of gap sizes on the osmotic adjustment substances in C. kawakamii seedlings不同小写字母代表各林窗间差异显著(P<0.05)
2.1.3叶绿素相对含量和荧光参数
不同大小林窗对幼苗叶绿素相对含量、Fo、Fv/Fo和Fv/Fm均有显著影响(P<0.05)(图3)。非林窗幼苗Fv/Fo显著高于其它林窗,且非林窗和小林窗幼苗叶绿素相对含量和Fv/Fm高于大、中林窗。中林窗幼苗Fv/Fo和Fv/Fm最低,Fo在中林窗最大,并显著高于非林窗。
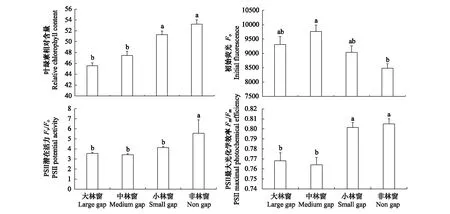
图3 林窗大小对格氏栲幼苗光合荧光指标的影响Fig.3 Effects of gap sizes on the photosynthetic fluorescence indices of C. kawakamii seedlings
2.2 凋落物化感作用对格氏栲幼苗高度和生理生化指标的影响
2.2.1幼苗高度
不同浓度凋落物浸提液对前、中期幼苗高度的影响无显著差异性(图4)。幼苗生长后期,C1浓度对幼苗高度起抑制作用,C3浓度对幼苗高度起促进作用。

图4 凋落物浸提液浓度对格氏栲幼苗高度的影响Fig.4 Effect of litter extract concentrations on the height of C. kawakamii seedlingsC1:凋落物浸提液浓度1∶10 Litter extract concentrations 1∶10;C2:凋落物浸提液浓度1∶30 Litter extract concentrations 1∶30;C3:凋落物浸提液浓度1∶50 Litter extract concentrations 1∶50;C4:凋落物浸提液浓度1∶100 Litter extract concentrations 1∶100;CK:对照 Control
2.2.2幼苗渗透调节物质
不同浓度凋落物浸提液对格氏栲幼苗可溶性蛋白含量的影响无显著差异(P>0.05)(图5)。凋落物浸提液C4浓度的幼苗可溶性蛋白和可溶性糖含量高于其它浓度,且均与CK处理间无显著差异性。
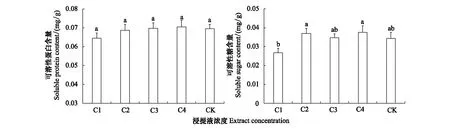
图5 凋落物浸提液浓度对格氏栲幼苗渗透调节物质的影响Fig.5 Effects of litter extract concentrations on the osmotic adjustment substances of C. kawakamii seedlings
2.2.3叶绿素相对含量和荧光参数
凋落物浸提液浓度显著影响格氏栲幼苗叶绿素相对含量、Fo、Fv/Fo和Fv/Fm(图5);C1浓度凋落物浸提液的幼苗叶绿素相对含量、Fv/Fo和Fv/Fm总体上低于其它浓度,而Fo高于其它浓度;格氏栲幼苗叶绿素相对含量在C3和C4浓度较高,而Fv/Fm在C4浓度达最小值。

图6 凋落物浸提液对格氏栲幼苗光合荧光指标的影响Fig.6 Effects of litter extract concentrations on the photosynthetic fluorescence indices of C. kawakamii seedlings
2.3 林窗-凋落物浸提液协同效应对格氏栲幼苗高度和生理生化指标的影响
2.3.1幼苗高度
不同林窗大小的格氏栲后期幼苗高度对高浓度(C1和C2)凋落物浸提液的响应具有显著差异(P<0.05),对低浓度(C3和C4)的响应无显著差异性(P>0.05)(图7)。高浓度下,中林窗幼苗高度高于其它林窗,非林窗幼苗高度最低。

图7 林窗凋落物对后期格氏栲幼苗高度的化感作用Fig.7 Allelopathic effect of forest gaps litter on the late stage height of C. kawakamii seedlings同一浓度不同小写字母代表各林窗间差异显著(P<0.05)
2.3.2幼苗渗透调节物质
林窗-凋落物浸提液浓度对幼苗可溶性蛋白和可溶性糖含量影响的结果表明(图8),高浓度(C1)凋落物浸提液下,中林窗幼苗可溶性蛋白含量较高;低浓度(C4)凋落物浸提液下,小林窗对幼苗可溶蛋白含量的影响起促进作用。不同浓度凋落物浸提液下,小林窗幼苗可溶性糖含量低于其它林窗;且除C1浓度外,非林窗幼苗的可溶性糖含量高于其它林窗。

图8 林窗凋落物对格氏栲幼苗渗透调节物质的化感作用Fig.8 Allelopathic effect of forest gaps litter on the osmotic adjustment substances of C. kawakamii seedlings
2.3.3叶绿素相对含量和荧光参数
林窗-凋落物浸提液浓度对格氏栲幼苗叶绿素荧光参数的结果表明(图9),各浓度凋落物浸提液下,随林窗面积减小,叶绿素相对含量总体呈逐渐上升趋势,在非林窗达最大值。C1浓度下幼苗Fo值随林窗面积降低呈下降趋势,在大林窗达最大值,其它浓度幼苗Fo值在中林窗较高。C1、C2和C3浓度下,非林窗幼苗Fv/Fo高于其它林窗,且在C2浓度显著高于中林窗;C4浓度下,小林窗幼苗Fv/Fo显著高于大林窗。C1和C3浓度下,大林窗幼苗Fv/Fm显著低于小林窗和非林窗;C2浓度下,非林窗幼苗Fv/Fm显著高于中林窗(图9)。

图9 林窗凋落物对格氏栲幼苗光合荧光指标的化感作用Fig.9 Allelopathic effect of forest gaps litter on the photosynthetic fluorescence indices of C. kawakamii seedlings
2.4 林窗-凋落物化感作用的交互效应对格氏栲幼苗生长影响
林窗-凋落物化感作用的单独效应对格氏栲幼苗生长的综合评价值具有显著性影响,且存在一定交互效应(F=1.76,P=0.09)(图10)。随林窗面积减小,不同浓度凋落物浸提液对格氏栲幼苗生长的影响呈先升再降后上升趋势,C3和C4浓度对格氏栲幼苗生长的促进作用高于其它浓度,C1浓度对幼苗生长的抑制作用最强。非林窗对幼苗生长的促进作用显著高于其它林窗,其次是中林窗;高浓度(1∶10和1∶30)凋落物浸提液与林窗相互作用时,中林窗对幼苗生长的促进作用最强,其次是非林窗;随凋落物浸提液浓度降低,非林窗对格氏栲幼苗生长的促进作用逐渐增强。
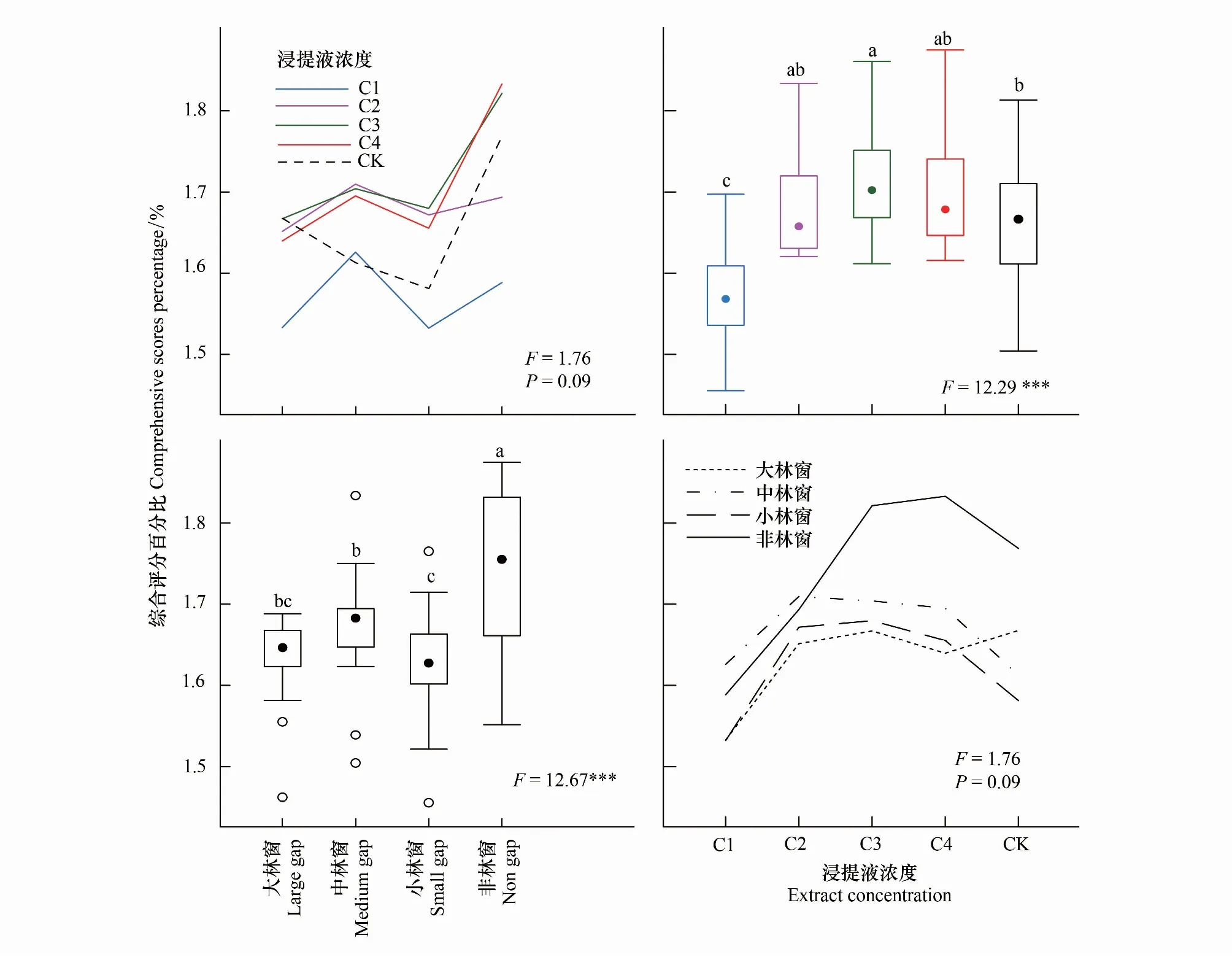
图10 林窗-凋落物化感作用交互效应对格氏栲幼苗生长的影响Fig.10 Interaction effect of forest gaps-allelopathic effect of litter on the seedlings growth of C. kawakamii
3 讨论
3.1 林窗对格氏栲幼苗生长的影响
林窗形成通过改变光照条件影响幼苗更新[6—7]。非林窗对格氏栲幼苗生长的促进作用显著高于其它林窗,可能是非林窗郁闭林分减弱了光照强度,降低了色素的光氧化对幼苗的伤害[32],导致叶绿素相对含量、Fv/Fo和Fv/Fm随林窗面积增大而降低。非林窗提高了幼苗Fv/Fo、Fv/Fm和可溶性糖含量,其幼苗生长的综合评价值也高于其它林窗(图10),可能是格氏栲幼苗属耐荫性物种,非林窗郁闭的林分环境降低了强光对叶绿素和光合反应中心的破坏[20],促使植物将吸收光能转化为可利用状态。幼苗通过提高Fv/Fo和Fv/Fm增强植物在荫蔽环境中的同化能力,促进植物对光能的吸收和转化[33],与前期对不同龄级格氏栲幼苗在弱光条件下的研究结果一致[20]。大林窗降低了幼苗Fv/Fo和Fv/Fm,且综合评价值显著低于非林窗(图10),在于大林窗接受更多太阳辐射从而使土壤表层含水量下降,在强光环境下幼苗通过关闭或缩小叶片气孔等减少水分散失,抑制了植物光合作用过程,降低了植物渗透调节物质的累积速率[34]。同时,格氏栲幼苗为适应光环境造成的生长压力,通过降低叶绿素相对含量、Fv/Fo和Fv/Fm以避免吸收过量光能,减轻了光合机构受破坏程度,从而维持了植物体内的养分平衡,这是幼苗适应环境变化采取的策略之一[20]。
3.2 凋落物化感作用对格氏栲幼苗生长的影响
森林凋落物通过雨水淋溶、物质挥发等方式释放化感物质,影响植物在不同生境中生长[10]。低浓度(1∶50和1∶100)凋落物浸提液促进格氏栲幼苗生长,其中1∶50浓度具有显著促进作用(图10),可能是低浓度化感物质积累量少,部分化感物质在土壤中转化成幼苗可利用的养分资源,提高植物根部养分资源的吸收,促进了光合作用相关物质的积累和运输,增强了幼苗抗逆性[17, 35—36]。凋落物分解改善了土壤养分状况,并通过微生物作用促使凋落物释放水解胞外酶,为植物提供养分资源[36],降低了植物生长压力。幼苗通过提高叶片可溶性糖含量、叶绿素相对含量和Fv/Fm等生长特性将光合产物储藏,以维持植物正常的光合作用,从而促进了暗反应阶段CO2固定[34]。高浓度(1∶10和1∶30)凋落物浸提液抑制幼苗生长,1∶10浓度起显著抑制作用(图10),可能是凋落物浸提液化感物质随时间积累,化感物质含量高于幼苗承受范围,损伤了幼苗根系细胞组织和类囊体薄膜,PSⅡ光合反应中心受损,降低了幼苗光合速率,从而抑制了幼苗生长[14, 16]。高浓度凋落物浸提液对格氏栲幼苗可溶性糖、可溶性蛋白、叶绿素相对含量、Fv/Fo和Fv/Fm的抑制作用,也证实了这一观点。
3.3 林窗和凋落物化感作用的协同效应对格氏栲幼苗生长的影响
林窗通过调节森林光照和水分资源等[6],改变了凋落物分解释放化感物质进程[23],且与凋落物化感效应共同作用于植物生长。不同林窗尺度下,凋落物浸提液1∶50浓度格氏栲幼苗生长的综合评价值总体较高,而非林窗1∶100浓度最高(图10),可能是林窗改变了林下光照和水热条件,影响了凋落物淋溶分解过程[8],进而影响凋落物化感物质的种类和含量,减弱了化感作用对格氏栲幼苗生长的毒害[22]。大林窗和小林窗抑制了格氏栲幼苗生长(图10),可能是大林窗较强的有效光合辐射致使叶片PSⅡ反应中心出现可逆性失活,幼苗不能及时、有效运输和耗散吸收的光能[34]。同时,大林窗强光直接照射地表,导致土壤表层易产生干旱的环境条件,减弱了土壤动物和微生物活性,降低了凋落物分解速率[37],进而抑制格氏栲幼苗生长。小林窗郁闭的林冠层,降低了林下植物光资源的获取[38],减弱了植物光合作用进程,抑制了凋落物单宁和总酚的降解[37]。格氏栲幼苗通过降低叶绿素相对含量,提高可溶性蛋白和可溶性糖含量等储藏更多光合作用产物,以应对林窗-凋落物化感共同作用带来的不利影响。高浓度(1∶10和1∶30)凋落物浸提液与林窗相互作用下,中林窗促进了格氏栲幼苗生长(图10),可能是中林窗林冠层具有遮荫和截流作用,林下层适宜的光照强度和温度促进凋落物高分子结构体解体[23, 37],导致部分化感物质被分解成植物根系可利用的养分资源[36]。同时,中林窗适宜的光照强度,刺激了植物气孔开放,提高了植物光合速率,间接提高了植物对养分资源的转化和吸收[7, 39]。低浓度(1∶50和1∶100)浸提液与林窗相互作用下,非林窗显著促进幼苗生长(图10),在于非林窗郁闭的林冠层削弱了太阳辐射强度,降低了林地表层水分蒸发速率,林下稳定的生存环境加快凋落物分解释放化感物质的速率[18],促进了植物新陈代谢进程[40]。当凋落物浸提液浓度超过自身所能承受范围后[17,28],非林窗幼苗通过提高可溶性蛋白和可溶性糖含量等储藏营养物质,降低了凋落物化感作用对自身的毒害[33]。非林窗格氏栲幼苗也通过提高叶绿素相对含量将吸收的光资源转化成自身可利用养分[34],减弱了凋落物化感效应对格氏栲幼苗生长的抑制作用。综上,适宜的林窗面积与凋落物化感作用通过调节幼苗叶绿素荧光特性、可溶性蛋白和可溶性糖等应对胁迫带来的不利影响,从而影响幼苗天然更新。
4 结论
林窗通过改善林内光照条件影响凋落物化感物质的释放,并通过凋落物浸提液浓度或林窗-凋落物浸提液共同作用于格氏栲幼苗生长。非林窗郁闭的林冠层通过降低林内光照条件显著促进格氏栲幼苗生长,且低浓度的凋落物浸提液(1∶50)直接促进幼苗生长。林窗-高浓度(1∶10和1∶30)凋落物浸提液共同作用时,中林窗对格氏栲幼苗生长具有促进作用;林窗-低浓度(1∶50和1∶100)凋落物浸提液共同作用时,非林窗对幼苗生长的促进作用高于其它林窗。可见,林窗与凋落物化感作用存在一定的交互效应,且中林窗降低了高浓度浸提液对幼苗生长的负效应,有助于促进格氏栲幼苗天然更新。

