干酪乳杆菌抗LPS诱导的奶牛乳腺上皮细胞炎性损伤作用及机制
李 可,杨 明,田梦悦,贾 丽,梁艳艳,马玉忠
(河北农业大学 动物医学院,河北 保定 071001)
奶牛乳房炎是世界范围内最常见的奶牛疾病,是乳腺组织受到各种病原菌侵袭及理化因素刺激而发生的炎症反应,该病可导致奶牛乳房发生显著病变,如发红、肿胀、发热、疼痛[1]。奶牛乳房炎对奶牛养殖业造成严重的经济损失,包括乳产量和乳品质下降,奶牛淘汰率增加,预防治疗费用激增等[2]。据统计,在泌乳期间,奶牛1个乳头感染会导致产奶量下降10%~12%[3]。革兰阴性菌是引起奶牛乳房炎重要的环境病原体,脂多糖(LPS)作为革兰阴性菌主要的致病毒素,进入机体后能激活细胞相关信号通路,促进多种细胞因子特别是炎性因子的表达和释放,引起机体一系列炎症反应[4-5]。目前,使用抗生素仍然是预防和治疗奶牛乳房炎的主要方法,但药物长期广泛地使用会导致细菌耐药性和乳制品药物残留的问题,严重危害人类健康[6]。因此,寻找安全、有效的奶牛乳房炎无抗替代药物已是大势所趋。
益生菌作为一类对机体有益的活性微生物,具有安全性高、无药物残留、不产生耐药性及无污染等优点,近年来已成为预防和治疗奶牛乳房炎的热门话题[7-8]。目前,关于益生菌在奶牛乳房炎的应用主要集中在体内治疗方面,而揭示作用机制的研究较少。本试验以干酪乳杆菌为材料,从分子层面探讨干酪乳杆菌的抗炎作用,以期为干酪乳杆菌防治奶牛乳房炎提供依据。
1 材料与方法
1.1 菌株干酪乳杆菌(Lactobacilluscasei,L.casei)购自上海保藏生物技术中心(SHBCC),菌种编号为ATCC393。
1.2 主要试剂LPS、RIPA高效裂解液、CCK-8试剂盒、BCA蛋白浓度测定试剂盒、BCIP/NBT底物显色试剂盒购自北京索莱宝科技有限公司;DMEM/F12培养基购自Gibco公司;胎牛血清购自杭州四季青公司;总RNA提取试剂盒、逆转录试剂盒购自北京康为公司;2× Fast Super EvaGreen qPCR Mastermix购自US Everbright公司;cytokeratin-18、p-IкBα、IкBα、p-p65、p65、β-actin购自北京博奥森生物技术有限公司。
1.3 奶牛乳腺上皮细胞原代培养及免疫荧光鉴定无菌采集健康泌乳期奶牛乳腺组织,使用含双抗(200 U/mL)的PBS洗净组织残留的乳汁,按照组织块贴壁法培养奶牛乳腺上皮细胞:将乳腺腺泡组织剪成1 mm3左右的小块,用含双抗的PBS反复冲洗后浸于含10% 胎牛血清的DMEM/F12培养基中,使用眼科镊将组织块均匀接种在培养瓶内,5% CO2、37℃倒置培养6 h后,缓慢加入少量培养基进行常规培养传代,并用酶消化法去除成纤维细胞污染。将纯化后的细胞接种在24孔细胞板中,待密度达到70%时,弃掉培养基,PBS清洗后依次进行固定、通透、封闭、抗体和DAPI孵育等操作,封片后使用荧光倒置显微镜观察。
1.4 CCK-8法检测干酪乳杆菌对奶牛乳腺上皮细胞活力的影响将奶牛乳腺上皮细胞按每孔5×104个接种于96孔板中,5% CO2、37℃培养12 h。用无血清DMEM/F12培养基将干酪乳杆菌稀释至103,104,105,106,107CFU/mL,与细胞共培养3 h后,每孔添加10 μL CCK-8溶液,于CO2培养箱中孵育2 h,测定各孔处的D450 nm值。细胞活力计算公式:细胞活力(%)=(干酪乳杆菌处理组D值-空白组D值)/(对照组D值-空白组D值)×100%。
1.5 试验分组及处理使用含10% 胎牛血清的DMEM/F12培养基培养奶牛乳腺上皮细胞,待长势良好后进行如下处理:对照组(Control),先加入无血清培养基培养3 h后,更换新的无血清培养基继续培养8 h;LPS处理组(LPS),先加入无血清培养基培养3 h后,更换含有1 mg/L的LPS无血清培养基继续培养8 h;低、中、高剂量处理组(Low、Mid、Hig),各组分别加入混有1.0×104,1.0×105,1.0×106CFU/mL干酪乳杆菌的无血清培养基处理3 h后,更换含有1 mg/L的LPS无血清培养基继续培养8 h。
1.6 实时荧光定量PCR检测奶牛乳腺上皮细胞相关炎性因子mRNA表达使用PBS将处理完毕的奶牛乳腺上皮细胞清洗3次后,按照RNA提取试剂盒说明提取各组细胞总RNA,用NanoDrop 超微量分光光度计对各组RNA浓度和纯度进行检测。使用逆转录试剂盒将总RNA反转录成cDNA,并用LightCycler96荧光定量PCR仪扩增样本cDNA,记录各孔荧光信号达到阈值时的循环次数(Ct值),采用2-△△Ct计算目标基因mRNA表达量。反应程序:预变性95℃ 300 s;3步法扩增,95℃ 5 s;60℃ 30 s,72℃ 15 s,40个循环;溶解,95℃ 10 s,65℃ 60 s,97℃ 1 s;冷却,37℃ 30 s。所用引物由生工生物工程(上海)股份有限公司合成,具体序列见表1。

表1 引物信息
1.7 Western blot 检测奶牛乳腺上皮细胞NF-κB信号通路关键蛋白表达用PBS将处理完毕的奶牛乳腺上皮细胞清洗3次,根据孔中细胞量加入RIPA高效裂解液(含PMSF和磷酸酶抑制剂)提取总蛋白,按照BCA蛋白浓度测定试剂盒说明测定浓度。使用SDS-PAGE分离蛋白样品,依次进行转膜、封闭、抗体孵育等操作后,按照BCIP/NBT底物显色试剂盒说明进行显色处理,并用Image J 记录条带灰度值。
1.8 统计分析试验数据采用SPSS 21.0软件进行One-way ANOVA分析,P<0.05表示有显著性差异。使用GraphPad Prism 8.0绘制图表。
2 结果
2.1 奶牛乳腺上皮细胞形态观察及角蛋白-18免疫荧光鉴定光学显微镜下,纯化后的细胞互相挤压,呈铺路石或鹅卵石样排列(图1A)。荧光显微镜下观察,可见奶牛乳腺上皮细胞胞浆发出特异性绿色荧光(图1B),细胞核蓝染(图1C),图像融合后可见蓝染的细胞核位于胞质中(图1D),确定所获细胞为奶牛乳腺上皮细胞。
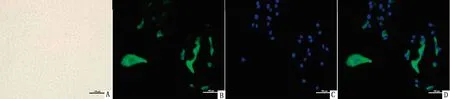
A.纯化后的奶牛乳腺上皮细胞;B.角蛋白-18阳性;C.DAPI复染细胞核;D.合并B和C后的图像;标尺=100 μm
2.2 不同浓度的干酪乳杆菌对奶牛乳腺上皮细胞活力的影响干酪乳杆菌预处理3 h后,各组益生菌无明显增殖,培养基清澈透明,细胞形态正常。使用CCK-8法测量干酪乳杆菌各浓度处理组细胞活力,结果如图2所示,与对照组相比,各浓度干酪乳杆菌对奶牛乳腺上皮细胞活力无显著影响(P>0.05),其中103,107CFU/mL的干酪乳杆菌处理细胞后,细胞活力略有下降,而104,105,106CFU/mL浓度组细胞活力略有上升。后续试验选择104,105,106CFU/mL作为低、中、高处理剂量。
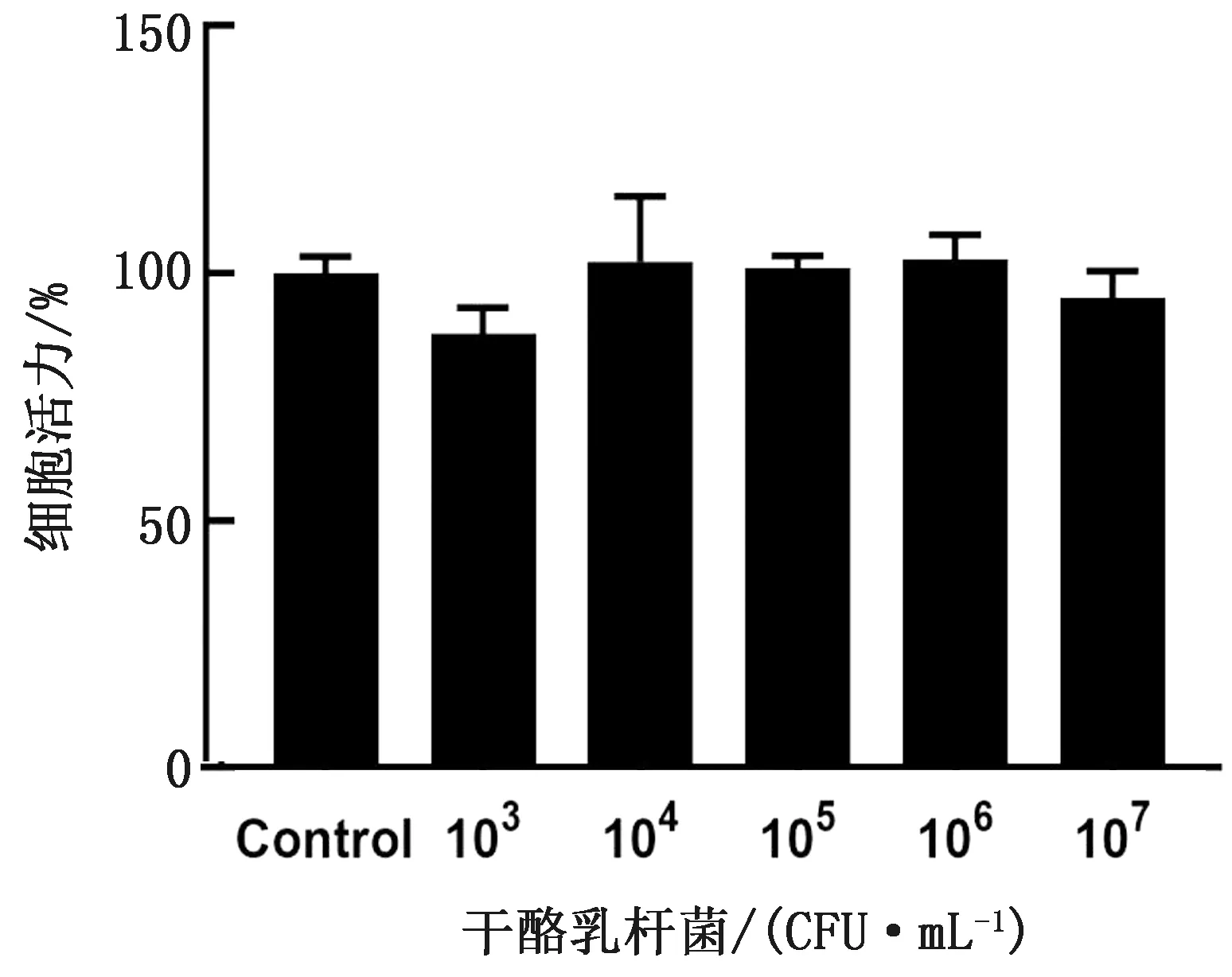
图2 干酪乳杆菌对奶牛乳腺上皮细胞活力的影响
2.3 干酪乳杆菌对各组细胞 IL-1β、IL-6、IL-8、TNF-α mRNA表达的影响结果显示,LPS组与对照组相比,显著提高了IL-1β、IL-6、IL-8、TNF-α mRNA的表达(P<0.01)。由图3A、B所示,与LPS组相比,中、高剂量处理组显著降低了IL-1β和IL-6 mRNA的表达(P<0.01),低剂量处理组IL-1β和IL-6 mRNA的表达也出现了下降,但差异不显著(P>0.05)。由图3C、D所示,与LPS组相比,低、中、高剂量处理组均显著降低了IL-8和TNF-α mRNA的表达(P<0.05)。
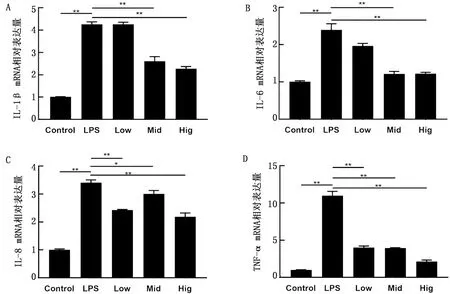
A~D.各处理组IL-1β、IL-6、IL-8、TNF-α mRNA表达量;*代表差异显著(P<0.05);**代表差异极显著(P<0.01)。下同
2.4 干酪乳杆菌对各组细胞 p-IкBα、IкBα、p-p65、p65 蛋白表达的影响由图4B、C可知,LPS组与对照组相比,显著提高了IкBα和p65蛋白的磷酸化水平(P<0.05)。与LPS组相比,低、中、高剂量处理组IкBα和p65蛋白的磷酸化水平均显著降低(P<0.05),且后者呈现一定的浓度依赖性。
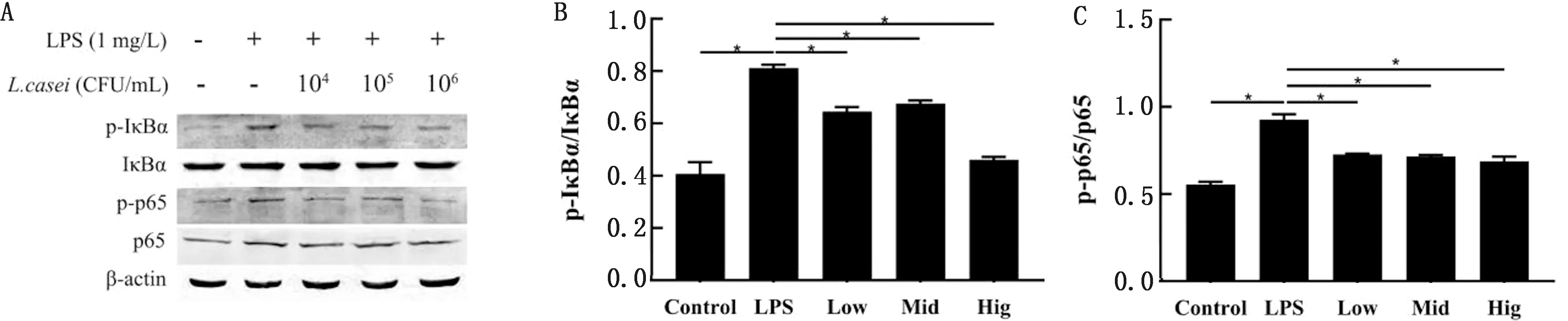
A.p-IкBα、IкBα、p-p65、p65蛋白条带;B.p-IкBα/IкBα;C.p-p65/p65
3 讨论
奶牛乳房炎一直是养殖场兽医人员防控的重点疾病,也是阻碍养殖场收益增长的一大难题,然而目前尚未找到有效的无抗防治方法[9]。干酪乳杆菌是最早被批准用于饲料添加剂的益生菌之一,具有调节肠道菌群比例、完善消化机能及促进机体免疫的作用,广泛应用于动物生产活动中[10]。近年来,随着对益生菌研究和应用的深入,益生菌更多潜在的有研究表明,炎性介质的过度表达和分泌与奶牛乳房炎发病密切相关[13]。当病原菌特别是革兰阴性菌侵入奶牛乳腺组织后,在免疫系统和酶系统的共同作用下,细菌的细胞壁结构被破坏并释放出LPS。LPS可诱导IL-1、IL-6、IL-8、TNF-α 等促炎因子的表达和释放,进而激活局部凝血系统,造成局部微循环障碍,产生炎性损伤[14]。炎性因子表达和分泌的减少可作为缓解炎性损伤的重要指标[15]。NF-κB是细胞内多条信号通路的交汇中心,参与细胞应激、增殖、凋亡等多种生理活动,特别在调控细胞促炎基因方面发挥重要的作用[16]。NF-κB未激活时,与胞浆内的IκB互相结合,此时前者入核定位信号被覆盖而无生物活性。当上游信号因子如IKK等被激活后,使IκB先后发生磷酸化和泛素化而被酶体降解,并解除对NF-κB的抑制作用。此时,自由的NF-κB被磷酸化后进入胞核,与NF-κB结合位点的基因结合,诱导IL-1β、1L-6、TNF-α等炎性因子的转录和表达,发挥促炎及其他复杂的生物作用[17-18]。在本试验中,使用LPS处理奶牛乳腺上皮细胞后NF-κB p65和IκBα 磷酸化水平显著升高,说明NF-κB信号通路被激活,而提前使用105,106,107CFU/mL的干酪乳杆菌预处理细胞能显著降低p65和IκBα的磷酸化水平,抑制下游基因的调控与表达。与此同时,1 mg/L的LPS可显著增加奶牛乳腺上皮细胞IL-1β、IL-6、IL-8、TNF-α mRNA表达量,使用105,106CFU/mL的干酪乳杆菌预处理细胞显著抑制了4种炎性因子mRNA的表达上调,表明干酪乳杆菌对奶牛乳腺上皮细胞炎性模型发挥抗炎作用可能是通过抑制NF-κB信号通路实现的。
干酪乳杆菌在繁殖过程中能分泌多种物质,包括胞外多糖(EPS)、乳酸、短链脂肪酸、一氧化氮(NO)和细菌素[19-20]。徐志敏等[21]发现使用干酪乳杆菌EPS处理巨噬细胞能降低NO和TNF-α 的分泌,发挥抗炎作用。LING等[22]发现益生菌产生的丁酸是发挥益生作用的关键物质。本试验中,奶牛乳腺上皮细胞炎性模型在干酪乳杆菌菌体及分泌物的干预下,表现出良好的抗炎效果。尽管干酪乳杆菌中发挥抗炎作用的关键物质有待进一步探究,但本研究仍为益生菌防治奶牛乳房炎以及后续微生态制剂菌种的选择和开发提供了新的思路。

