2021皮肤红斑狼疮的诊断、治疗和长期管理指南
翻译:姚文鑫
首都医科大学附属北京世纪坛医院药学部,北京 100038
红斑狼疮(lupus erythematosus ,LE)是一种慢性炎症性自身免疫性疾病,该病分型较多,包括系统性红斑狼疮(systemic lupus erythematosus,SLE)和皮肤红斑狼疮(cutaneous lupus erythematosus,CLE)。SLE通常累及多个器官和系统,而CLE主要涉及皮肤和黏膜。根据临床表现、组织病理学特点以及血液检查结果的不同,可进一步分为几种不同的亚型。由于分类复杂且一些亚型发生率较低,CLE的准确诊断特别是诊断一些不常见的亚型,对于皮肤科医生、风湿科医生和其他治疗LE患者的医生具有临床挑战。另一方面,与SLE不同,迄今为止除了羟氯喹(hydroxychloroquine,HCQ),还未有其他药物和治疗性干预获批用于CLE的治疗,但经验性以及超说明书使用的治疗很常见,包括局部治疗和全身治疗。
1 研究背景
2017年,欧洲皮肤病学论坛(European Dermatology Forum,EDF)和欧洲皮肤病与性病学会(European Academy of Dermatology and Venereology,EADV)联合发布了皮肤红斑狼疮的治疗指南(S2k guideline for treatment of cutaneous lupus erythematosus)[1]。然而,该指南的目标读者是狼疮领域研究专家而不是皮肤科医生,并且该指南中未提到如何诊断CLE及其相关亚型。同样在2017年,亚洲皮肤病性病学会(Asian Academy of Dermatology and Venereology,AADV) 基于综合评述提出亚洲CLE管理建议[2]。2019年末,中华医学会皮肤性病学分会(Chinese Society of Dermatology,CSD)红斑狼疮研究中心更新发布了中文版CLE诊疗指南,其中展示了不同CLE亚型的典型图片,便于读者对CLE的临床表现有更直观的印象[3]。近些年,随着临床研究的不断发展,越来越多的新证据和新建议需要纳入指南。制订本指南的目的,是为给皮肤科医生和风湿科医生提供一个结合循证证据和专家意见的诊断、治疗和长期管理CLE的实践指南。
2 研究方法
基于2017年EDF和EADV的治疗指南[1]、AADV的管理建议[2]以及2019年CSD的诊疗指南[3],本研究旨在制定一个更新、更全面的CLE诊断、治疗和长期管理指南。
CSD委员兼CSD红斑狼疮研究中心主任的陆前进教授,提出并发起了与亚洲皮肤科学会(Asian Dermatological Association ,ADA)、AADV合作。2021年3~6月,来自亚洲、美洲、欧洲等16个国家或地区的25名皮肤科医生、7名风湿科医生、1名红斑狼疮领域专家和2名方法学家被提名担任指南委员会委员。作为拥有丰富指南指定经验的专家,陈耀龙教授以方法学顾问的角色参与指南制定工作。拥有CLE和SLE临床实践及临床试验经验的龙海教授在全面回顾文献的基础上起草了本指南初稿,并负责收集来自所有委员的评论、建议和补充意见,组织对主要问题的讨论直至最终完成修订。
由于大多数CLE治疗措施的临床证据有限,指南委员会全体委员均同意根据专家共识和证据来制定本指南。本指南参考了卫生保健实践指南的报告条目(国际RIGHT工作组)制定的清单[4],并在国际实践指南注册平台注册(http://www.guidelinesregistry. org, Registration No.IPGRP-2021CN189)。在小组讨论之前,将指南初稿分发给指南委员会的每位专家进行预览。截至2021年6月底,收集了意见、建议和补充意见,并对指南中包括CLE的鉴别诊断(见表1)和治疗路径(见图1)的各个部分进行了进一步的讨论和修订,其中包括提交建议草案、相关证据、公开讨论、初始投票、修订建议,必要时进行最终投票。关于讨论,内部证据和外部证据均考虑在内。收集每项建议的投票结果:①强共识:投票通过率在90%及以上的建议。②共识:投票通过率在70%~89%的建议。所有建议的投票通过率均在80%以上。

图1 CLE治疗路径图

表1 CLE的鉴别诊断
3 分类
CLE按照临床表现、组织病理学特点和血液检查可分为四大类:急性CLE(acute cutaneous lupus erythematosus,ACLE)、亚急性CLE(subacute cutaneous lupus erythematosus,SCLE)、 慢 性CLE(chronic cutaneous lupus erythematosus,CCLE)和间 歇 性CLE(intermittent cutaneous lupus erythematosus,ICLE)。其中,在SLE患者中,ACLE患者常见皮肤和黏膜表现,并伴有其他器官或系统损伤,也有部分患者不表现其他器官受累[5]。高达50%的SCLE患者符合SLE的诊断标准,但SCLE患者通常只有轻微的全身症状[6]。约有20%的SCLE患者倾向于发展为干燥综合征[7]。CCLE包括几种亚型,如盘状LE(discoid lupus erythematosus,DLE)、疣状LE(verrucous lupus erythematosus,VLE)、深在性LE(lupus erythematosus profundus,LEP)、冻疮样LE(chilblain lupus erythematosus,CHLE)和Blaschko线状LE(Blaschko linear lupus erythematosus,BLLE)。ICLE是一个特殊的类别,专指肿胀性LE(tumid lupus erythematosus,TLE),是LE中对光最敏感的一个亚型,其会优先发生在阳光照射的部位。CLE各亚型的典型皮肤临床表现见图2。
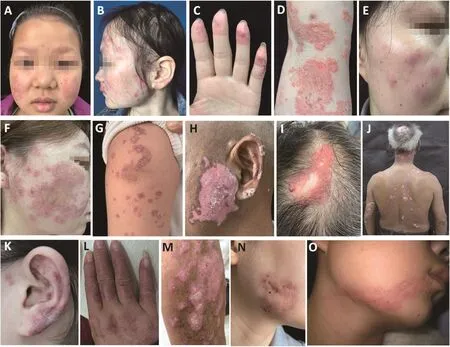
图2 CLE各亚型的代表性皮肤损
值得注意的是,CLE有时可与其他免疫相关疾病同时存在,如与扁平苔藓[8]、皮肌炎[9]、抗磷脂综合征(antiphospholipid syndrome,APS)[10]或其他自身免疫性疾病共存,即被定义为重叠综合征。
4 CLE的诊断与临床评估
目前,对于CLE的各亚型尚未有标准化的诊断标准。CLE的诊断应综合考虑病史、临床表现、实验室检查和皮肤活检。直接免疫荧光(direct immunofluorescence,DIF)通常有助于疾病诊断。不同CLE亚型的鉴别存在差异(见表1)。近年来,基于人工智能的智能手机应用平台被开发出来,用以辅助对CLE的诊断和分类[11-12]。
值得注意的是,在确诊CLE前,排除皮损以外的其他器官损害是必要的,因为ACLE、DLE和VLE甚至LEP的皮损可能是SLE患者临床表现的一部分。有必要通过病史采集、体格检查、血清抗体检测[抗核抗体(antinuclear antibody,ANA)、抗双链DNA(dsDNA)、抗Sm抗体和其他抗可提取核抗原(extractable nuclear antigen,ENA)抗体]、实验室检查[全血细胞计数、尿常规、尿蛋白-肌酐比值、红细胞沉降率(erythrocyte sedimentation rate,ESR)和补体C3和C4]全面评估所有器官和系统。一种新发现的表观遗传生物标记物(全血细胞中IFI44L基因启动子去甲基化),在SLE的诊断上已显示出高灵敏度和高特异性(均在90%以上)[13]。通过高分辨率熔解-定量聚合酶链反应(HRM-qPCR)检测,IFI44L基因甲基化生物标志物检测可以成为区分SLE和DLE的潜在实验室检测方法,当25%甲基化为临界值时,该检测的灵敏度为96.00%,特异性为72.55%,阳性预测值为77.42%,阴性预测值为94.87%[14]。
在明确CLE诊断后,对疾病活动和损害的临床评估有助于确定治疗策略,同时有助于评估未来每次随访的治疗效果。皮肤红斑狼疮疾病面积和严重程度指数(cutaneous lupus erythematosus disease area and severity index,CLASI)是在2005年开发的一种临床测量工具,是首个用于评估CLE患者疾病活动和损害的工具[15-16]。该工具对于临床研究的总体有用,但其评分方法无法对某些CLE亚型进行准确评估[17]。例如,CLASI活性评分仅由红斑和鳞片/肥大评分组成,因此不能反映水肿、浸润或皮下结节的严重程度,而水肿、浸润或皮下结节是LET和LEP的重要特征,也是评价其疾病活性的必要条件。因此,作为CLASI的改进版本,修订的皮肤红斑狼疮疾病面积和严重程度指数(RCLASI)考虑了不同CLE亚型的更多临床特征[15-16]。一系列可靠性研究证实了RCLASI的有效性和适用性,在临床研究中,RCLASI比CLASI更适合于临床评价不同疾病亚型的CLE活性和损伤[15-16]。本指南共识97%建议在诊断CLE前排除SLE;97%建议在开始治疗前和治疗期间的每次随访时适当评估CLE的疾病活动和损害。
5 CLE的治疗
由于CLE的高临床异质性,其治疗应个体化。建议对CLE进行长期治疗管理。对患者进行危险因素、保护措施和长期随访的必要性教育,是获得更好临床治疗结果的基础。关于治疗CLE的局部用药、全身用药的使用建议,以及孕妇和儿童等特殊患者群体用药的注意事项如下。
5.1 CLE的危险因素和保护措施
(1)紫外线:紫外线是引发LE各种亚型患者皮肤症状的环境因素之一,特别是LET和SCLE,对500多例患者的光测试研究证明了这一点[18-22]。一项随机、双盲、赋形剂对照研究证实,在25例患有不同亚型CLE的患者中,使用高度保护的广谱防晒霜(防晒系数60)可防止紫外线诱导的皮肤损伤。同样,一项单中心、前瞻性、开放性研究提示,使用具有极高防晒系数(50+或60)的广谱脂质体防晒霜可以预防CLE患者因紫外线引起的损伤[19,21]。此外,值得注意的是,避免直接暴露在阳光下和经常使用防晒霜的人(如CLE患者),其血清25羟基维生素D水平全年低于正常值[23-25]。本指南共识97%建议所有CLE患者对紫外线和阳光照射进行防护,包括避免无保护的户外活动、寻找阴凉处、穿防晒衣和使用防晒霜;建议防止紫外线照射作为CLE患者的治疗方法;建议长期防晒的患者补充维生素D。
(2)吸烟:一项对来自欧洲14个国家的838例CLE患者的横断面研究,分析了吸烟行为对CLE的影响[26]。其数据显示,吸烟对CLE疾病严重程度和抗疟药[HCQ和氯喹(chloroquine,CQ)]的疗效均有负面影响。一项纳入1398例CLE患者的Meta分析显示,吸烟与使用抗疟药物对患者皮肤状况的下降比例相关,戒烟可以促进CLE的皮肤改善[27]。此外,在一项纳入102例CLE患者的多中心、前瞻性病例对照研究中证实,吸烟是影响LE皮肤表现的一项危险因素[28]。一项对215例CLE患者的描述性分析显示,吸烟与CLE患病风险升高和疾病活动性增加相关[29]。本指南共识全票建议所有CLE患者戒烟。
(3)药物:药源性CLE(DI-CLE)可分为两大类,即药源性SCLE(DI-SCLE)和慢性皮肤药源性 LE(CCDILE)[30]。DI-SCLE是最常见的亚型,多见于老年女性患者[31]。2篇综述汇总了205例DI-SCLE患者诱导药物情况,其诱导药物可分为10类以上,主要是质子泵抑制剂、抗高血压药(如钙通道阻滞剂、β受体阻滞剂、血管紧张素转换酶抑制药和利尿剂)和抗真菌药[31-32]。CCDILE较为罕见,通常与氟尿嘧啶和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抑制剂有关[33-34]。一项回顾性观察研究,使用世界卫生组织(WHO)全球个体病例安全报告数据库VigiBase,总结了1967年~2019年6月期间记录的1994例DI-CLE患者的临床数据,其中包括130多个国家的药品监管部门收集的报告[35]。该分析确定了94种与DICLE相关的药物,其中报告DI-CLE病例数量最多的药物包括:抗肿瘤坏死因子生物制剂(如依那西普、阿达木单抗和英夫利西单抗)、质子泵抑制剂(如奥美拉唑)和特比萘酚[35]。本指南共识全票建议应详细了解CLE患者用药史,特别是SCLE和LET患者。
(4)Koebner现象:CLE患者在发生外伤、抓伤、手术疤痕、接触性皮炎、受到衣服的压力、接触液氮或暴露于强光、感染或高温后,偶尔会出现Koebner现象[36-40]。本指南共识88%建议,如果CLE患者曾出现Koebner现象,除非是必要的或不可避免的或其收益超过风险的情况,否则应避免创伤、手术、冷冻治疗和皮肤的有创激光治疗。
(5)激素:由于担心潜在的负面影响,女性LE患者很少使用外源性雌激素,而2项随机研究以及1项系统性综述和Meta分析显示,使用雌激素不会增加狼疮进展的风险[41-43]。目前尚未找到有关CLE患者使用外源性雌激素的数据。
(6)放射治疗:目前,结缔组织疾病不是放射治疗(radiotherapy,RT)的绝对禁忌症[44-45],且很少有研究表明RT可能是CLE的触发因素[46-47]。
5.2 CLE的局部治疗
5.2.1 外用糖皮质激素和皮损内注射糖皮质激素
多个随机对照试验(randomized controlled trial,RCT)强调局部类固醇治疗作为CLE的首选治疗方法。2017年,Cochrane系统评价数据库纳入了5项DLE治疗的RCT[48]。一项涉及78例DLE患者的RCT研究,比较了强效糖皮质激素乳膏(0.05%氟轻松)与弱效糖皮质激素乳膏(1%氢化可的松),结果表明局部使用强效糖皮质激素在治疗DLE皮损方面比弱效糖皮质激素更优(27%vs10%)[49]。Barikbin 等[50]开展了一项研究,比较了0.1%戊酸倍他米松乳膏与1%吡美莫司乳膏治疗面部DLE的疗效,结果显示0.1%戊酸倍他米松乳膏组的皮损严重程度改善了73%,其与1%吡美莫司乳膏组的改善相似。另一项研究中,Pothinamthong等[51]采用改良的CLASI评分进行评估,泰国的DLE患者用0.05%丙酸氯倍他索乳膏局部治疗6周,其疾病活动性比使用0.1%他莫昔芬软膏的改善更优(CLASI评分与基线相比的平均变化:5.29vs3.52)。由于其常见不良反应包括:萎缩、毛细血管扩张和类固醇引起的酒渣鼻,局部应用糖皮质激素时应间歇性使用,并且连续使用不应超过几周。通常建议使用2周,且只在周末使用[52]。头部皮损的患者可能需要延长局部使用类固醇的时间[52]。作为一种经验性治疗,皮损内注射曲安奈德可能对局部难治性DLE患者有益[53-55]。
本指南共识94%建议短期(最多几周)局部应用糖皮质激素作为CLE皮损(头皮皮损除外)的一线治疗,头皮皮损可能需要长期外用糖皮质激素治疗;97%建议皮损内注射糖皮质激素治疗局部难治性DLE。
5.2.2 钙调磷酸酶抑制剂
外用钙调磷酸酶抑制剂为CLE局部治疗提供了另一种选择,包括0.03%和0.1%他克莫司软膏和1%吡美莫司乳膏。与外用糖皮质激素相比,外用钙调磷酸酶抑制剂有更好的安全性,无需担心类固醇带来的如皮肤萎缩、毛细血管扩张和色素沉着等不良反应。Kuhn等[56]进行了一项随机、双盲、多中心、赋形剂对照试验,来评估0.1%他克莫司软膏治疗CLE皮损的临床疗效。参与研究的有不同CLE亚型的30例患者,分别用0.1%他克莫司软膏和赋形剂治疗2个选定的皮损部位,每天2次,持续12周治疗。与赋形剂对照治疗的CLE皮损组相比,0.1%他克莫司软膏治疗的皮损组有较好改善,尤其是急性、水肿性、非角化过度CLE皮损的患者,如LET[56]。而比较21例泰国DLE患者0.05%丙酸氯倍他索软膏与0.1%他克莫司软膏的临床疗效,虽然0.05%丙酸氯倍他索软膏组优于0.1%他克莫司软膏组,但两组对疾病活动性均有所改善[51]。一项RCT研究纳入41例唇部DLE患者,其中22例患者使用0.03%他克莫司软膏治疗,19例患者使用0.1%曲安奈德乳膏治疗。治疗3周后,他克莫司软膏组20例患者和曲安奈德软膏组19例患者完成了研究,结果显示完全缓解率分别为70%和89.5%。两组患者在完全缓解率或糜烂和红斑减少方面无统计学差异[57]。一项纳入18例CLE耐药患者的回顾性研究提示,0.05%丙酸氯倍他索软膏联合0.3%他克莫司软膏的复方制剂优于单药0.1%他克莫司软膏或0.05%丙酸氯倍他索软膏治疗[58]。相关研究比较了1%吡美莫司乳膏和0.1%戊酸倍他米松乳膏分别治疗DLE患者8周的疗效[50]。结果表明,两组患者DLE疾病活动分别下降了84%和73%,无统计学差异[50]。其他研究也证实了1%吡美莫司乳膏治疗CLE患者的临床疗效[59-60]。
本指南共识94%建议将钙调磷酸酶抑制剂作为局部治疗DLE和其他活动性病变、水肿性CLE,尤其是面部皮损的备选一线治疗。
5.2.3 外用类维生素A类药物
类维生素A类药物包括他扎罗汀凝胶、0.05%维A酸乳膏和0.025%维A酸凝胶,尚无RCT研究测试其治疗CLE的临床疗效。但已有一系列病例报道显示其在CLE肥厚性病变特别是VLE中的疗效[61-63]。这些患者病例大多数对外用糖皮质激素或钙调磷酸酶抑制剂无效,而外用类维生素A类药物治疗的临床疗效较好[62-63]。本指南共识全票建议外用类维生素A类药物作为VLE和其他CLE角化过度皮损的二线治疗,特别是对外用糖皮质激素或外用钙调磷酸酶抑制剂无效的患者。
5.2.4 脉冲染料激光(pulsed dye laser,PDL)
PDL可以选择性地破坏血管,并且通过作用于红细胞内的氧合血红蛋白在真皮上部产生凝血作用。PDL已被报道用于治疗难治性DLE皮损,推测其治疗效果可能会抑制DLE皮损的炎症反应。一项随机、双盲、对照临床研究纳入9例患者的48个DLE皮损,研究提示在传统治疗的基础上合并595nm PDL治疗,可以改善DLE的红斑、质地和整体皮肤状况[64]。相关研究病例也表明PDL治疗CLE患者有良好的临床疗效和安全性[65-75]。本指南共识84%建议当传统的局部和全身药物治疗失败后,将PDL作为难治性、非活动性DLE患者的四线治疗。需要特别注意,PDL治疗必须由有资质的皮肤科医生进行。
5.3 CLE的全身治疗
5.3.1 抗疟药
抗疟药长期以来被认定为所有CLE亚型的全身治疗一线用药,目前已有3项与CLE相关的RCT研究。一项由Yokogawa等[76]进行的随机、双盲、安慰剂对照的Ⅲ期临床研究,纳入103例活动性CLE患者(CLASI评分≥4),该研究对HCQ治疗CLE皮损的疗效进行了评估。16周双盲期后,研究人员总体评估显示,尽管两组在第16周时CLASI评分与基线资料改善相比无统计学差异,但HCQ组“好转”和“显著好转”患者的比例明显高于安慰剂组(分别为51.4%和8.7%);其他次要终点,如中心照片评估、患者整体评估、Skindex-29评分和研究者整体评估均支持HCQ的临床疗效。Ruzicka等[77]比较了HCQ和阿维A在不同CLE亚型中的作用。经过8周的治疗,30例接受HCQ治疗的患者中有50%的患者病情好转,而28例接受阿维A治疗的患者有46%病情好转。阿维A酸组的不良反应发生率更高,有4例患者需要中止阿维A治疗。Bezerra等[78]比较了氯法齐明和CQ的临床疗效。氯法齐明组16例患者中有12例(75%)患者对该药临床疗效良好,CQ组17例患者中14例(82.4%)患者对该药临床疗效良好。18.8%使用氯法齐明治疗的患者和41.2%使用CQ治疗的患者完全缓解,但无统计学差异。根据对欧洲皮肤红斑狼疮学会(European Society of Cutaneous Lupus Erythematosus,EUSCLE)核心调查问卷的分析,1002例患者中HCQ和CQ的使用率分别为56.7%和30.8%,有效率分别为81.5%和86.9%[79]。在一项回顾性研究中,评估了HCQ对35例日本CLE患者的临床疗效,到16周时,87%的患者出现完全或部分缓解,54.3%的患者完全改善[80]。值得注意的是,CCLE往往比ACLE需要更多的恢复时间,在16周时CCLE患者的部分或无改善率更高。本指南共识全票建议将抗疟药物,尤其是HCQ,作为所有存在泛发或严重皮损的CLE患者的一线全身治疗用药。
视网膜病变是HCQ和CQ的主要毒性,也是其使用的禁忌症。根据一项回顾性研究,评估2361例连续接受HCQ治疗至少5年的患者的数据,美国眼科学会得出一个结论,即HCQ每日剂量≤5.0mg/kg,使用长达10年的HCQ相关视网膜毒性的患者用药风险较低[81]。出于对安全性的考虑,美国眼科学会还建议CQ的最大日剂量应≤2.3mg/kg[82]。患者应在治疗的前6个月内接受眼底基础检查。已患有黄斑变性、肾功能不全(肾小球滤过率<60ml/min)、正在服用他莫昔芬、HCQ每日剂量>5mg/kg可增加视网膜的病变风险。因此,这些患者从治疗开始就应每年进行眼底检查,没有相关风险因素的患者建议在HCQ或CQ治疗开始5年后每年进行眼底检查[82-83]。为了避免不可逆的视网膜病变的风险,本指南共识94%建议HCQ每日剂量≤5mg/kg实际体重或CQ每日剂量为≤2.3mg/kg真实体重患者不要使用HCQ和CQ联合治疗;建议患者在开始使用HCQ或CQ治疗前以及开始治疗5年内,每年进行1次眼科检查,在存在视网膜病变风险因素的情况下开始治疗,应每年进行眼科检查。
对于HCQ或CQ单一疗法难治的病例,可加用奎纳克林。在一项纳入128例患者的前瞻性队列研究中,15例使用HCQ治疗无效的患者中有67%的患者在使用HCQ联合奎纳克林治疗后开始改善,研究显示活动性评分中位数(四分位数)从6.0(4.8~8.3)下降到3.0(0.75~5.0),而视网膜病变的风险并未增加[84]。对于HCQ单药治疗无效的病例,本指南共识91%建议如果有使用奎纳克林经验的临床医生可用该药作为附加疗法。
出于安全考虑,应注意的是,大剂量抗疟药可以诱发葡萄糖-6-磷酸脱氢酶(glucose 6-phosphate dehydrogenase,G6PD)缺乏症患者的急性溶血危象,其发病率在非洲、亚洲和地中海人群中最高[85]。本指南共识88%建议在抗疟药治疗前检查G6PD活性(如有该检查)。
5.3.2 糖皮质激素
在EUSCLE进行的一项前瞻性、横断面、多中心研究中,全身使用糖皮质激素对413例使用该疗法的CLE患者中的94.3%有效,其临床疗效高于用于CLE治疗的所有其他全身治疗药物[79]。全身使用糖皮质激素治疗通常从小剂量开始到中剂量,如泼尼松0.5mg/(kg·d),在疾病控制后逐渐减量,最终停药[86-87]。为了避免常见的不良反应,如库欣综合征、感染、消化性溃疡、骨质疏松症和白内障[88],不建议对没有全身损伤的CLE患者进行长期糖皮质激素维持治疗[89]。本指南共识97%建议对于严重或泛发的CLE患者和全身损伤的CLE患者全身使用糖皮质激素联合抗疟药作为一线治疗。全票建议,当CLE得到控制时,逐渐减量并最终停止全身使用糖皮质激素。在减量期间和停用糖皮质激素后,全票建议继续使用抗疟药或其他糖皮质激素保留剂治疗。为了降低糖皮质激素相关不良反应的风险,全票建议对无全身损伤的CLE患者不进行长期糖皮质激素维持治疗。
5.3.3 沙利度胺和来那度胺
4项无对照试验研究了沙利度胺对几种CLE亚型患者(包括DLE)的临床疗效,结果显示沙利度胺治疗后缓解率较高(98%~100%)[90-92]。同样,在观察性研究和病例系列中报告了高应答率(67%~100%)[93-94]。Cuadrado 等[94]评估了沙利度胺对48例严重CLE患者的临床疗效,对抗疟药、泼尼松龙、甲氨蝶呤(methotrexate,MTX)、硫唑嘌呤和/或环孢素无反应。经过沙利度胺治疗后,29例(60%)完全缓解,10例(21%)部分缓解,9例(19%)无缓解。13例(27%)发生周围神经病变,其中11例经肌电图确诊。相关回顾性研究显示[95],神经系统不良反应的发生率更高。有高达50%~70%使用沙利度胺治疗的患者出现神经症状或神经病变,通过对周围神经进行电生理检查确诊。本指南共识88%建议沙利度胺作为难治性CLE的二线治疗药物,尤其是DLE和SCLE,最好与抗疟药联用。
作为沙利度胺的结构类似物,来那度胺的不良反应发生率较低,尤其是神经病变。在亚组分析中,Cortes-Hernandez等[96]发现,来那度胺治疗14例难治性CLE患者后,有12例完全缓解,其中DLE和SCLE比LEP达到完全缓解所需的时间更短。相关研究表明[97],LEP患者对来那度胺治疗无反应。也有人担心来那度胺可能诱发LE[98]。本指南共识97%建议不要使用来那度胺治疗CLE。
5.3.4 类维生素A类药物
1996年,美国皮肤病学会(American Academy of Dermatology)指南建议将类维生素A类药物作为CLE的二线全身治疗[99]。Ruzicka等[77]于1992年进行了一项随机、双盲、多中心临床研究,分别比较阿维A(50mg/d)和HCQ(400mg/d)对28例和30例CLE患者的临床疗效。13例(46%)接受阿维A治疗的患者和15例(50%)接受HCQ治疗的患者总体得到了改善。此外,相关报道提示[100-101],口服异维A酸可有效治疗难治性SCLE。对于VLE和/或CLE肥厚性皮损,散发病例报告显示阿维A或异维A酸有较好的临床治疗效果[102-103]。
阿维A和异维A酸治疗CLE的推荐日剂量为0.2~1.0mg/kg。患者通常需要服用2~6周才能达到治疗反应[104]。但是,停用类维生素A类药物后不久就会出现CLE复发[100-101]。本指南共识全票建议全身使用类维生素A类药物作为难治性CLE的二线治疗,特别是角化过度皮损和VLE,最好联合抗疟药。
5.3.5 氨苯砜
氨苯砜主要用于治疗大疱性LE(BSLE)[105],也用于治疗常规治疗效果不好的DLE和SCLE[106-107]。欧洲风湿病联盟(EULAR)推荐,氨苯砜(100mg/d)单独使用或联合泼尼松使用是BSLE的首选治疗方法[108]。一项对34例CLE患者的回顾性分析表明[109],氨苯砜对超过50%的CLE患者有效。Ujiie等[110]的研究中,有11例患者使用氨苯砜成功治疗了LEP。本指南共识97%建议氨苯砜作为难治性CLE的二线治疗,特别是CLE大疱性皮损或BSLE,最好联合抗疟药和全身使用糖皮质激素。
出于对安全性的考虑,不建议G6PD缺乏症患者使用氨苯砜,以避免其严重不良反应之一的溶血性贫血。相关研究证实[111],在用氨苯砜治疗的麻风病患者中,HLA-B*13∶01与氨苯砜超敏反应综合征的发展有关,氨苯砜超敏反应综合征是该药物可致命的不良反应。因此,不推荐携带HLA-B*13∶01等位基因的患者使用氨苯砜。在中国人中约有2%~20%的人携带HLA-B*13∶01等位基因,在日本人中约有1.5%,在印度人中约有1%~12%,在东南亚人中约有2%~4%,而在欧洲人和非洲人中基本不存在[111]。本指南共识全票建议,为了降低其严重不良反应的风险,在氨苯砜治疗开始前检查G6PD活性和HLA-B*13∶01等位基因。全票建议从低剂量(50mg/d)开始使用氨苯砜,并根据治疗反应和不良反应情况调整剂量。氨苯砜的剂量上限不得超过1.5mg/(kg·d)。
5.3.6 MTX
一项系统评价[95,112-114],包含了1项RCT和2项观察MTX治疗CLE的观察性试验。在纳入41例SLE患者的RCT研究中[112],比较MTX和CQ对SLE皮肤临床表现的疗效和安全性,两组患者治疗24周后皮损均有良好改善,组间比较无统计学差异,提示低剂量MTX和CQ同样有效。在2项观察性研究中,大多数患者得到了改善。对43例CLE患者的回顾性分析显示[115],MTX降低了疾病活动,98%接受MTX治疗的患者皮损有所改善;此外,这些患者中有15例在之后从静脉注射MTX转为皮下注射,表现出相似的治疗效果。在另一项回顾性分析中[114],每周接受10~25mg MTX治疗的12例CLE患者中有10例患者显著改善,而2例患者对此治疗无反应。本指南共识97%建议低剂量MTX作为难治性CLE,特别是SCLE的二线治疗,通常每周剂量低于15或20mg,最好是皮下注射给药。
MTX的不良反应主要是脱发和氨基转移酶升高[116]。建议补充叶酸以减少MTX导致肝酶升高的不良反应[117-118]。安全性方面,一项大规模回顾性分析[119],纳入了风湿性疾病患者在内的2093例口服MTX患者和949例皮下注射MTX患者。结果显示,尽管皮下给药剂量高于口服MTX,但皮下注射MTX中性粒细胞减少率降低趋势不明显,并且氨基转移酶的发生率略高于口服MTX。此外,经随访发现,其皮下注射MTX的持续使用率高于口服MTX,提示皮下注射MTX具有更好的耐受性。本指南共识91%建议每周摄入5~10mg叶酸,以减少使用MTX治疗期间带来的不良反应。全票建议在长期使用MTX期间定期监测全血细胞计数和血清肝酶水平。
5.3.7 霉酚酸酯(mycophenolate mofetil,MMF)和其他免疫抑制剂
目前缺乏免疫抑制剂(如MMF、硫唑嘌呤、环磷酰胺和环孢素)在CLE中应用的RCT研究。尽管如此,MMF联合HCQ和/或全身糖皮质激素治疗难治性CLE的疗效已被反复报道[120-122]。一项回顾性分析[121],评估了24例抗疟药耐药的CLE患者,结果表明MMF耐受性良好,可作为CLE标准治疗的有效附加治疗。24例患者中,MMF的起始剂量从每天500~1000mg不等,增加到每天2750mg的平均剂量,结果提示所有患者出现完全或部分反应,平均临床反应时间为2.76个月。本指南共识全票建议MMF作为难治性CLE的第三线治疗,最好与抗疟药联合使用。97%建议MMF起始剂量为500mg,每日2次,以后可以根据治疗反应和不良反应调整剂量。
口服后,MMF被完全代谢为其活性成份霉酚酸(mycophenolic acid,MPA)。Kreuter 等[122]通过口服霉酚酸钠肠溶片(一种提供MPA的制剂)治疗了10例难治性SCLE患者,给药剂量为1440mg/d,进行了为期3个月的单药治疗之后CLASI评分改善,但这些初步数据仍需要大量样本的支持。本指南共识97%建议将MPA作为MMF的替代选择。
硫唑嘌呤、环磷酰胺和环孢素主要用于SLE的治疗。这些药物在CLE治疗中的临床证据不足。本指南共识97%建议对于不伴有全身损伤的CLE患者,不推荐使用硫唑嘌呤、环磷酰胺和环孢素治疗。
5.3.8 贝利尤单抗
贝利尤单抗是选择性靶向可溶性人B细胞活化因子(BAFF,也称为B淋巴细胞刺激因子或BLyS)的单克隆抗体,其治疗SLE的临床疗效和安全性已获得相关多中心RCT试验和真实世界研究的证据支持。然而,目前尚还没有针对CLE治疗的RCT研究。相关报告显示[123],贝利尤单抗对16例常规治疗无效的CLE患者有效。一项贝利尤单抗的Ⅲ期临床随机安慰剂对照试验中,纳入来自中国、日本和韩国的677例SLE患者,安慰剂组初始皮肤黏膜BILAG评分为A或B的患者在52周治疗后改善了44.3%,贝利尤单抗组改善了57.8%(P=0.025),提示贝利尤单抗对SLE皮肤和黏膜病变有良好治疗效果[124]。本指南共识全票建议贝利尤单抗作为四线治疗药物,用于活动性SLE患者的泛发、难治性CLE皮损,尤其是在全身使用糖皮质激素减量过程中反复复发的ACLE患者。
5.4 妊娠期CLE药物治疗
CLE患者的妊娠期药物治疗应基本遵循2017年EULAR女性SLE指南[125]。HCQ是一种在妊娠期经过安全性测试的药物。一项随机、安慰剂对照研究纳入了20例患有SLE(n=17)或DLE(n=3)的妊娠期患者,该研究提示HCQ在控制疾病活动和预防妊娠期狼疮发作方面的有益作用,以及其良好的安全性,即不会损害孕妇及其新生儿的健康[126]。对于SLE患者,如果狼疮活动得到很好的控制,妊娠期通常会继续使用低剂量泼尼松作为维持治疗,并建议定期随访[127-128]。本指南共识97%建议将HCQ联合或不联合小剂量泼尼松作为妊娠期CLE患者的一线维持治疗。
妊娠期使用任何效价强度的外用糖皮质激素都不会增加早产、胎儿死亡、出生缺陷或低Apgar评分的风险[129]。然而,妊娠期使用强效或超强效外用糖皮质激素造成非常大的累积剂量,这可能与低出生体重相关[129]。本指南共识97%建议外用糖皮质激素作为妊娠期CLE患者的一线治疗,强效和超强效糖皮质激素除外。
用标准剂量治疗时,外用钙调磷酸酶抑制剂(即他克莫司和吡美莫司)通过皮肤屏障的吸收有限[130]。据报道[131],根据出生时从脐带采集的血液测量,产妇血液中50%~70%的他克莫司通过胎盘屏障。然而,目前尚未见临床证据可用于评估妊娠期CLE患者外用他克莫司治疗的临床疗效和安全性。本指南共识中88%的委员认为,无法为处在妊娠期的CLE患者外用钙调磷酸酶抑制剂提出建议。
由于已知或可能的致畸性,妊娠及计划妊娠的患者应避免使用MPA和MTX[125]。类维生素A类药物和沙利度胺具有明确的致畸作用,计划妊娠或妊娠期的女性禁用[132-133]。在全身使用类维生素A类药物治疗期间,以及异维A酸停药后3个月内或阿维A停药后2年内应避免妊娠。母乳喂养期间不允许使用异维A酸。由于类维生素A类药物具有致畸作用,禁止全身使用类维生素A类药物治疗妊娠期患者或计划妊娠的患者。在全身使用类维生素A治疗期间以及停止治疗后的一段时间(异维A酸:3个月;阿维A:2年),本指南共识全票强烈建议应有效避孕。由于沙利度胺、MTX、MMF和MPA的致畸作用,禁止使用这些药物治疗妊娠患者或计划妊娠的患者。在使用这些致畸药物治疗期间,全票强烈建议应有效避孕。
5.5 儿童CLE药物治疗
目前尚缺少儿童CLE局部和全身治疗的临床证据。对于患有CLE的儿童,治疗药物应调整剂量,尽可能不影响生长发育。临床实践中常用外用糖皮质激素和口服HCQ。由于MMF的不良反应,不建议其在没有全身损伤的儿童CLE患者中长期使用,只将其用于难治性CLE的治疗[134]。儿童不应使用沙利度胺,除非作为对常规治疗无效的CLE的抢救治疗。周围神经病变是其常见的剂量依赖性不良反应,12岁以上的儿童可能比年纪更小的患儿更容易出现这种不良反应[135-136]。本指南共识97%建议外用糖皮质激素作为儿童CLE(尤其是局部CLE)的一线治疗。全票建议将HCQ作为儿童CLE的一线全身治疗方案。
5.6 CLE的手术治疗
尽管CCLE皮损很少通过手术治疗,但有少数报告,在继续使用抗疟药、全身糖皮质激素和沙利度胺治疗的同时,通过手术切除皮损并植皮,成功治疗了顽固性皮损。2例对常规治疗耐药的CHLE患者[137],接受手术切除皮损后,从腹部获得全厚皮片移植。术后7年(病例1)和3年(病例2),手术区域均未见复发,尽管皮损仍存在于切除不充分和未手术的区域。据相关报道[138],对包括全身糖皮质激素和MMF在内的传统治疗方法耐药的DLE病例也采用了类似的手术治疗。然而,在停用免疫抑制剂几个月后DLE复发,通过二次手术切除和植皮,联合全身糖皮质激素和MMF维持治疗,再次成功清除皮损。此方法是用手术切除病理性表皮和真皮,且皮肤移植物来自未暴露于阳光下的解剖区域。在影响美观的区域,当患者采用局部和全身治疗的传统疗法失败或无法耐受时,本指南共识84%建议手术切除皮损后使用腹部全厚皮片移植作为四线治疗方法,治疗CCLE的难治性局部皮损,尤其是DLE、VLE和CHLE。这种手术治疗必须与抗疟药物和/或全身糖皮质激素药物治疗相结合。
6 CLE患者的监测
由于CLE具有慢性和复发性的疾病特点,需要长期对患者进行疾病监测。疾病管理的频率可以根据疾病的严重程度和活动性、患者的临床状况以及药物和治疗反应进行调整。
6.1 临床和实验室评估
对于CLE疾病活动性和皮损的临床评估,采用CLASI评分工具及其改进版RCLASI已广泛用于临床试验[15-16]。与CLASI相比,RCLASI考虑到了CLE各亚型更详细的临床特征,是比CLASI更好的选择。
基础的实验室评估包括:全血细胞计数、ESR、血肌酐、尿常规、尿蛋白/肌酐比值、血清补体C3和C4水平、血清25羟基维生素D水平、血清钙和钾以及血清白蛋白。在治疗前和定期每6~12个月或复发时检查血清自身抗体,有助于早期识别SLE进展或与其他结缔组织疾病共存的重叠综合征。这些自身抗体包括ANA、一系列抗ENA抗体、狼疮抗凝物和抗磷脂抗体(抗心磷脂抗体和抗β2-糖蛋白1抗体)。应警惕治疗药物的不良反应,包括抗疟药、糖皮质激素、MTX、沙利度胺和类维生素A类等治疗药物。本指南共识97%建议在每次随访中酌情评估疾病活动、皮损和其他器官损伤、生活质量、合并症和可能的不良事件。
6.2 孕前评估
孕前评估是将狼疮患者母婴并发症风险降至最低,并且可以改善高危妊娠预后的重要步骤[139]。对高危妊娠进行筛查,包括未控制的狼疮、过去半年内系统性发作或严重狼疮发作、未控制的高血压、既往严重先兆子痫、严重肺动脉高压、器官衰竭、Hellp综合征(溶血、肝酶升高和血小板减少)、过去6个月内卒中、有产科并发症史、APS、每日需要使用超过10mg的糖皮质激素以及抗SSA或抗SSB抗体阳性。此外,肌酐清除率低于40ml/min是相对禁忌症。
实验室评估包括全血细胞计数、凝血试验、血清氨基转移酶、血肌酐、尿沉渣(白细胞尿、血尿)、尿蛋白(尿蛋白与肌酐比值或24h尿蛋白定量)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)、梅毒血清反应(TPHAVDRL)、血清弓形虫和麻疹抗体、狼疮抗凝物和抗磷脂抗体、血清抗SSA、抗SSB和抗dsDNA抗体、补体(C3和C4)、促甲状腺激素和抗甲状腺过氧化物酶抗体以及血清HCQ水平(如果条件允许)[140]。
本指南共识97%建议产科医生和皮肤科医生或风湿科医生对计划妊娠的CLE患者的狼疮控制、妊娠的其他危险因素和药物使用进行孕前评估。
6.3 妊娠评估
所有患有CLE的孕妇应通过多学科评估,密切监测。通常情况下,应在妊娠期每月进行1次监测,在妊娠结束时和围产期进行更频繁的监测,可根据患者的妊娠状况和不良产科病史进行单独调整(如果条件允许)。狼疮活动性的临床评估和实验室检查通常每2~3个月进行1次。妊娠期每3个月常规进行超声监测。对于有APS或抗磷脂抗体或狼疮抗凝物的患者,建议在妊娠22周时对子宫进行多普勒超声检查,并分别在28周和36周时进行脐带多普勒超声,对羊水量和胎儿生物学参数进行评估。对于抗SSA和/或抗SSB阳性的患者,建议在16~24周期间至少每2周进行1次胎儿超声心动图筛查,如果这些患者有房室传导阻滞病史或患者的同胞患有新生儿红斑狼疮,则应每周进行1次筛查[141]。在围产期,由皮肤科医生或风湿科医生就狼疮的治疗进行一次咨询对患者是有益的。本指南共识全票建议产科医生和皮肤科医生或风湿科医生定期、密切监测CLE患者怀孕期间的健康状况。全票建议由皮肤科医生或风湿科医生在围产期进行狼疮管理咨询。
6.4 CLE向SLE的进展
如果患者被诊断为CLE,并在之后随访期间达到SLE的EULAR/ACR分类标准,则认为患者发展为SLE[142]。不列颠群岛狼疮评估组疾病活动指数(BILAG-2004)和系统性红斑狼疮疾病活动指数2000(SLEDAI-2K)可分别用于确定进展为SLE的CLE患者的全身损伤程度和疾病活动度[143-144]。本指南共识94%建议对所有CLE患者进行定期随访时对SLE进行常规筛查。
6.5 停止治疗
CCLE是一种慢性、复发性疾病,通常需要长期治疗。对于ACLE、SCLE和ICLE,即使狼疮皮损已经消退,通常也建议使用抗疟药进行维持治疗,并且需要长期随访和监测。目前,尚未有证据支持CLE的终身治疗或设定停止维持治疗的时间点。尽管如此,对于接受全身糖皮质激素治疗的患者,建议在CLE得到控制的前提下,逐渐减少糖皮质激素用量之后停药,以减少不良反应的发生。本指南共识全票建议在CLE皮损得到控制后逐渐减少全身糖皮质激素的剂量,之后停用全身糖皮质激素,不建议对CLE患者进行全身糖皮质激素的长期维持治疗。
7 小结
CLE可分为ACLE、SCLE、CCLE和ICLE,其诊断主要基于对临床表现和组织病理学特征的评估。活检皮肤的DIF和一系列实验室检查,包括血清自身抗体,如ANA、ENA和抗磷脂抗体,可能有助于诊断和鉴别诊断。评估全身损伤对于排除SLE的诊断是必要的,并且应该是CLE患者随访期间疾病监测的关键部分。作为所有CLE患者疾病管理的基础,患者教育和长期随访对帮助监测疾病活动性、全身损伤、合并症和可能出现的不良事件是必要的。
CLE有多种治疗方法,但只有少量得到高质量临床证据的支持,如RCT研究。对于局部CLE皮损,外用糖皮质激素和外用钙调磷酸酶抑制剂是首选治疗方案。对于泛发或严重的CLE皮损和/或对局部治疗有抗性的病例,可以在局部治疗的基础上联合包括抗疟药和/或短期全身糖皮质激素等治疗。值得注意的是,抗疟药是所有类型CLE的一线全身治疗药物,也可用于妊娠患者和儿童患者。二线治疗选择包括沙利度胺、类维生素A类药物、氨苯砜和MTX,而MMF被认为是三线治疗药物。最后,PDL治疗和手术可以作为局部难治性皮损的四线治疗,而贝利尤单抗可用作活动性SLE患者泛发CLE皮损的四线治疗或糖皮质激素减量过程中的复发ACLE。尽管如此,大多数这些治疗措施仍然需要来自Ⅲ期临床试验的高质量证据,以证明其在CLE的各种亚型中的有效性、安全性和临床实践价值。
原文刊载于:Journal of Autoimmunity 123 (2021) 102707.doi.org/10.1016/j.jaut.2021.102707
原文作者:Qianjin Lu,Hai Long,Steven Chow,Syarief Hidayat,Retno Danarti,Yulianto Listiawan,Danqi Deng,Qing Guo,Hong Fang,Juan Tao,Ming Zhao,Leihong Xiang,Nan Che,Fen Li,Hongjun Zhao,Chak Sing Lau, Fong Cheng Ip,King Man Ho, Arnelfa C. Paliza,Chan Vicheth,Kiran Godse,Soyun Cho,Chew Swee Seow, Yoshiki Miyachi,Tran Hau Khang,Rataporn Ungpakorn,Hassan Galadari, Rashmikant Shah, Kehu Yang,Youwen Zhou, Carlo Selmi, Amr H. Sawalha, Xuan Zhang, Yaolong Chen, Chrang-Shi Lin
Correspondence:qianlu5860@pumcderm.cams.cn (Q.Lu),dr.hailong@csu.edu.cn (H.Long), chenyaolong@vip.163.com(Y.Chen), linskintaiwan@gmail.com (C.-S. Lin)

