血浆组织因子微粒、脱-γ-羧基凝血酶原、神经元特异性烯醇化酶在胃癌患者血液高凝状态中的临床价值
李莹莹,朱晓东,冯兴勇,余 洁,邹佳华△
湖北省黄冈市中心医院:1.肿瘤内科;2.胃肠外科,湖北黄冈 438000
肿瘤患者血液的高凝状态可能是由肿瘤细胞损伤血管内皮,产生局部炎症反应,以及肿瘤细胞释放组织因子和癌前促凝物质引起的[1]。近年来的研究发现,血液高凝状态对机体的损伤不仅体现为可导致血栓形成,还可通过刺激血管内皮、促进血管生成、增加血小板活性、调节免疫和改变血流动力学等促进肿瘤细胞的生长和扩散。因此,通过检测相关指标的变化,及时发现凝血功能异常,并及时治疗,从而预防肿瘤患者动静脉血栓形成,延长患者生存时间,改善其生活质量[2]。组织因子作为外源性凝血通路的启动子,存在于细胞颗粒表面,形成组织因子微粒(TF-MPs),其表面的磷脂酰丝氨酸和组织因子具有较强的促凝活性[3]。维生素K缺乏或抗体-Ⅱ诱导产生的凝血酶原是一种缺乏凝血活性的异常凝血酶原,又称为脱-γ-羧基凝血酶原(DCP)[4]。此外,血清神经元特异性烯醇化酶(NSE)水平可能与肿瘤患者相关凝血指标的变化存在一定的关联[5]。有研究发现,NSE水平的升高是血液高凝状态发生的风险因素[6]。本研究主要探讨了TF-MPs、DCP、NSE与胃癌患者血液高凝状态的关系,同时分析了上述3项指标对胃癌患者血液高凝状态的诊断价值,旨在为临床防治胃癌患者血液高凝状态提供一定的参考依据。
1 资料与方法
1.1一般资料 选取2018年1月至2021年1月本院就诊的Ⅲ~Ⅳ期不可手术治疗的晚期胃癌患者作为研究对象。纳入标准:(1)通过病理检查确诊为胃癌;(2)近30 d内未使用过抗凝、化疗药物或血液制品;(3)近30 d内未接受过局部放疗;(4)一般资料完整。排除标准:(1)合并严重肝、肾损伤;(2)合并对凝血功能产生影响的自身免疫性疾病;(3)合并对凝血功能产生影响的遗传或获得性血液系统疾病;(4)不配合研究;(5)因各种原因退出研究。按纳入与排除标准选取符合条件的患者86例,其中男47例,女39例;年龄50~82岁,平均(63.12±10.22)岁。参照传统凝血功能检测结果分为高凝组38例和非高凝组48例。满足下列2项者可诊断为高凝状态[7]:(1)凝血酶原时间缩短>3 s;(2)活化部分凝血活酶时间缩短>3 s;(3)纤维蛋白原>4 g/dL;(4)D二聚体>300 μg/L;(5)血小板计数>30×109/L。高凝组中男19例,女19例;年龄52~80岁,平均(64.03±10.17)岁。非高凝组中男28例,女20例;年龄53~82岁,平均(63.06±10.02)岁,两组性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。所有研究对象均自愿参与本研究,本研究经本院医学伦理委员会批准。
1.2检测方法
1.2.1TF-MPs检测 入院后第1天,取两组空腹静脉血5 mL置于离心管中,并以160×g离心20 min,获得富血小板血浆,吸取2/3上层血浆再以1 000×g离心20 min,取上清液获得乏血小板血浆。将异硫氰酸荧光素(FITC)标记的抗膜联蛋白V(AnnexinⅤ)抗体(艾美捷科技有限公司)和藻红蛋白(PE)标记的抗CD142抗体(上海瑞齐生物技术有限公司)添加到50 μL乏血小板血浆中,在室温下孵育30 min,然后加入1 mL磷酸盐缓冲液,采用流式细胞仪(贝克曼库尔特公司)检测。样品上机前用0.1~1.0 μm的标准进行前向角设门,门中收集的微粒通过FITC和PE荧光强度进行分析。TF-MPs定义为直径0.1~1.0 μm且CD142+/AnnexinⅤ+的微粒。
1.2.2DCP、NSE检测 入院后第1天,采集两组患者的血液标本,4 ℃低温条件下离心,取上清液,—80 ℃储存,采用酶联免疫吸附试验(ELISA)检测DCP、NSE水平。
2 结 果
2.1两组TF-MPs、DCP、NSE水平比较 高凝组的TF-MPs、DCP、NSE水平均高于非高凝组,差异有统计学意义(P<0.05)。见表1。

表1 两组TF-MPs、DCP、NSE水平比较
2.2胃癌患者血液高凝状态的危险因素分析 以血液高凝状态(定义“高凝组”=1,“非高凝组”=2)作为因变量,TF-MPs、DCP、NSE水平作为自变量进行多元线性回归分析,结果显示,TF-MPs、DCP、NSE水平升高为胃癌患者血液高凝状态的独立危险因素(P<0.05)。见表2。
2.3TF-MPs、DCP、NSE诊断胃癌患者血液高凝状态的ROC曲线分析 TF-MPs、DCP、NSE诊断胃癌患者血液高凝状态的效能见表3和图1。
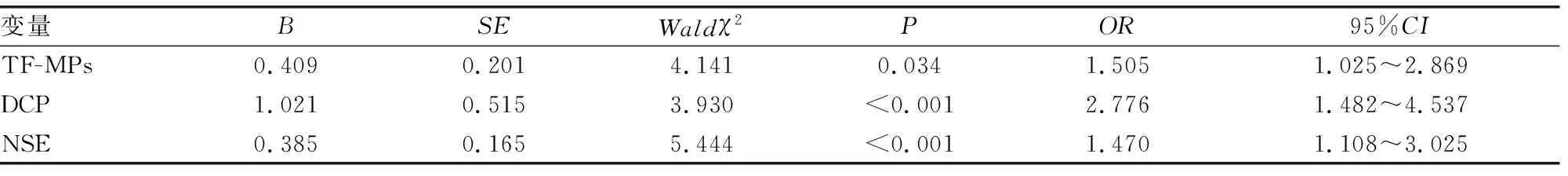
表2 胃癌患者血液高凝状态的危险因素分析

表3 TF-MPs、DCP、NSE诊断胃癌患者血液高凝状态的效能
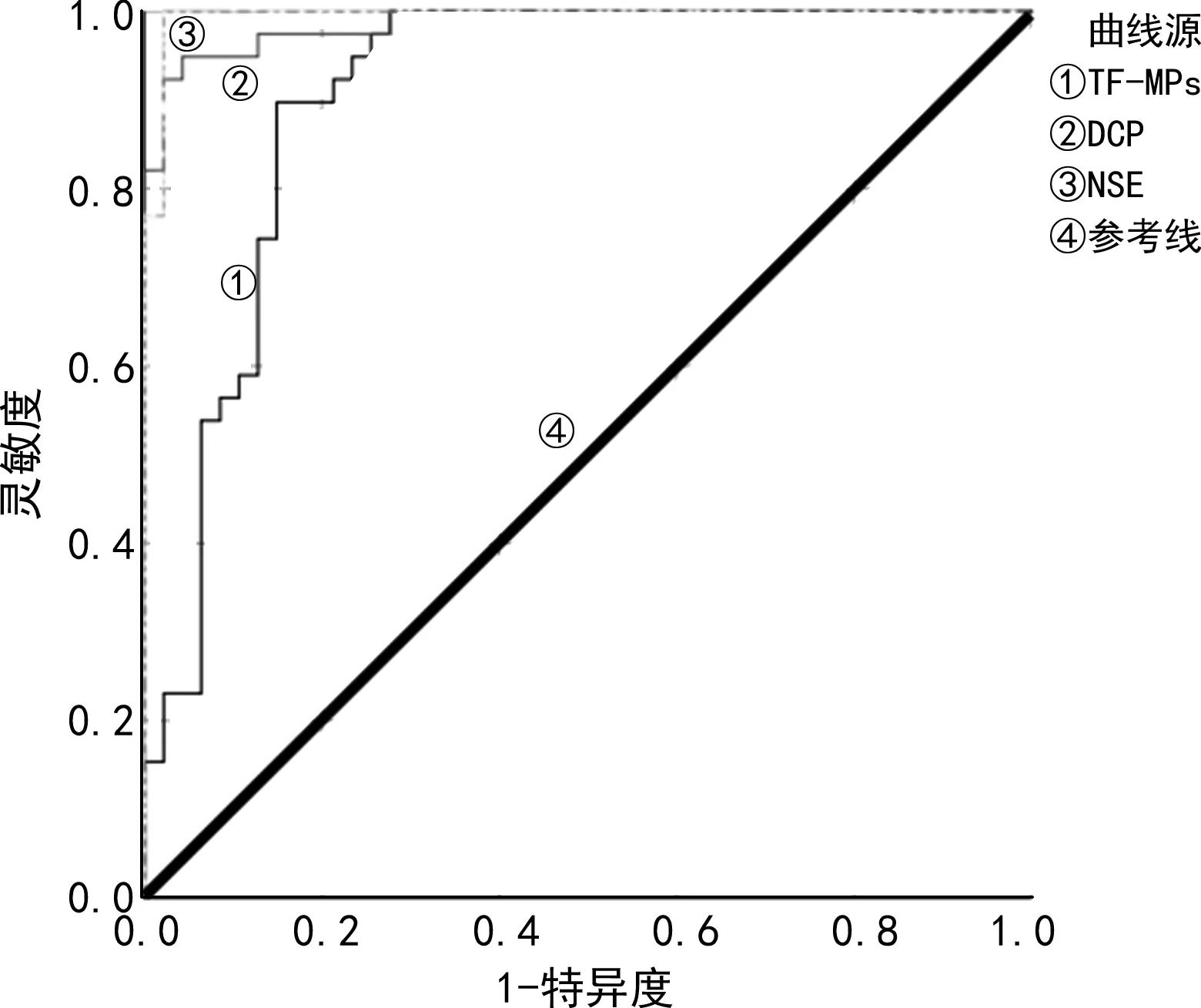
图1 TF-MPs、DCP、NSE诊断胃癌患者血液高凝状态的ROC曲线
3 讨 论
血液高凝状态也叫血栓前状态,表现为止血与抗血栓平衡状态失调,凝血功能增强,易形成血栓。血液高凝状态存在于诸多疾病的发展过程中,可遗传或后天获得。根据血液高凝状态的病理机制,可分为原发性和继发性血液高凝状态,后者在临床上非常常见[7]。据统计,15%左右的肿瘤患者在疾病发展过程中存在显性的静脉血栓栓塞。尸检发现肿瘤患者血栓形成的发生率更高,已成为恶性肿瘤患者死亡的第二大原因[8]。因此,及时诊断和纠正血液高凝状态对提高恶性肿瘤患者的生存率具有十分重要的临床意义。
组织因子以微粒为载体形成TF-MPs,与丝氨酸蛋白酶因子Ⅶ/Ⅶa结合形成双分子复合物,在凝血因子Ⅷ的作用下激活凝血因子Ⅹ转化为凝血因子Ⅹa,将凝血酶原转化为凝血酶,在血栓形成中起着非常重要的作用[9]。NSE是糖酵解酶烯醇化酶的细胞特异性同工酶,分布于神经元和神经内分泌细胞。在胃肠道和胰腺神经内分泌肿瘤患者的血清中升高,对上述疾病的诊断和预后评估有重要的临床意义[10]。然而,目前很少有关于NSE与胃癌血液高凝状态的研究。与正常凝血酶原相比,DCP的γ-羧基谷氨酸结构中谷氨酸残基不能完全羧基化为γ-羧基谷氨酸,使其失去正常的凝血功能[11]。
本研究结果显示,高凝组的TF-MPs、DCP、NSE水平均高于非高凝组(P<0.05),提示TF-MPs、DCP、NSE水平对胃癌患者的血液高凝状态有一定的影响,进一步回归分析结果发现,TF-MPs、DCP、NSE水平升高为胃癌患者血液高凝状态的独立危险因素(P<0.05),提示上述指标可作为预测胃癌患者血液高凝状态的指标。TF-MPs是组织因子和微粒的组合,在结合后,其开始产生凝血级联反应,这在外源性凝血途径中非常重要。在健康人体内,游离组织因子水平很低,促凝活性很弱;当组织因子和微粒结合时,提供了一个带负电荷的磷脂酰丝氨酸的反应平台,组织因子的促凝活性大幅度提升,体内促凝-抗凝平衡被打破,出现血液高凝状态[12]。在肿瘤合并静脉血栓栓塞的研究中,发现体内存在高水平的TF-MPs[13]。在正常状态下,凝血酶原由肝细胞微粒体的内质网产生,其前体的近N端功能区域有10个谷氨酸残基,在γ-谷氨酰羧化酶的作用下转化为γ-羧化谷氨酸,即形成具有凝血功能的凝血酶原,这一过程需维生素K的参与。当维生素K缺乏或谷氨酰羧化酶的功能减弱时,这种未羧化的谷氨酸残基可大量产生并释放入血[14]。临床检测到的DCP正是这种凝血酶原前体,不具有凝血功能。DCP产生越多,患者的凝血功能越差[15]。此外,有研究发现,NSE与活化部分凝血活酶时间、D-二聚体水平呈正相关[16]。ROC曲线分析结果显示,TF-MPs、DCP、NSE诊断胃癌患者血液高凝状态的AUC均大于0.9,说明上述指标对于诊断胃癌患者血液高凝状态具有较高的准确性。
综上所述,处于血液高凝状态的胃癌患者TF-MPs、DCP、NSE水平会升高,且上述指标对于诊断胃癌患者血液高凝状态具有较高的准确性。

