基于miR-106b-5p调控CCND1基因研究幽门螺杆菌促进食管癌细胞增殖的功能机制
沈晓雯,黄琳玲,蒋林燕,沈红梅
江苏省南通市第二人民医院检验科,江苏南通 226001
食管癌是我国常见的消化道恶性肿瘤之一,早期诊断难度大,容易发生浸润和转移,即使接受较为全面的综合治疗,整体预后仍不佳,很多患者死于局部复发或远处转移[1-2]。食管癌的发病与遗传因素、环境因素、饮食因素等有关,近些年有学者提出幽门螺杆菌(Hp)感染可能是食管癌发病的危险因素,食管癌患者Hp感染率明显高于慢性食管炎患者及食管不典型增生患者,且Hp感染与食管癌的恶性程度相关[3-4]。但目前关于Hp感染是否参与食管癌发生、发展尚缺乏细胞实验证据,相关的分子机制也不十分清楚。微小核糖核酸(miR)-106b-5p在食管癌、胃癌、肺癌等多种恶性肿瘤中发挥抑癌作用,原癌基因细胞周期蛋白D1(CCND1)是miR-106-5p的潜在靶基因之一[5-7]。一项胃黏膜病变相关的细胞实验证实,Hp脂多糖对miR-106b-5p的表达具有抑制作用,提示Hp可能削弱miR-106b-5p的抑癌作用,进而参与胃癌或食管癌等恶性肿瘤的发生[8]。基于此,本研究将以miR-106b-5p/CCND1途径为切入点,系统探讨Hp感染调控食管癌细胞增殖的作用机制,旨在为深入认识Hp感染导致食管癌发病的分子机制提供依据。
1 资料与方法
1.1一般资料 收集2019年6月至2021年10月在本院手术切除的食管癌标本46份,标本来源患者中男28例,女18例;年龄41~72岁,平均(62.93±11.44)岁。纳入标准:(1)经病理检查诊断为食管癌;(2)按要求留取组织标本;(3)未接受过放化疗或其他肿瘤相关治疗。排除标准:(1)既往有其他恶性肿瘤病史;(2)合并自身免疫性疾病。本研究获得本院医学伦理委员会批准,取得患者知情同意。
1.2细胞株及菌株来源 食管癌TE-1细胞株(STR鉴定正确,批号C6946)及Hp标准菌株NCTC11637(批号R4601603)均购自美国菌种保藏中心,Hp菌液的水平为1×108CFU/mL。
1.3仪器与试剂 阴性对照(NC)序列及miR-106b-5p模拟物(序列:5′-TAGACGTGACAGTCGTGAAAT-3′)均购于吉玛公司(中国), MTS法细胞活力检测试剂盒购于Promega公司(丹麦),miR提取试剂盒、miR cDNA第一链合成试剂盒、miR荧光定量检测试剂盒购于天根生化科技(北京)有限公司,CCND1、β-actin特异性一抗购于美国CST实业有限公司。
1.4方法
1.4.1食管癌Hp感染的检测 取食管癌组织、制作石蜡切片,用快速脲酶法和Warthin-Starry银染法进行Hp检测,两种检测方法均为阳性则判断为Hp阳性,反之则为Hp阴性。
1.4.2细胞培养及干预 TE-1细胞在含有10%胎牛血清的培养基中常规贴壁培养,用0.25%胰蛋白酶常规消化,扩增传代后进行分组干预,具体如下:对照组用不含菌株和药物的培养基处理;Hp组在培养基中加入Hp菌液,使细胞与细菌比例达到1∶100;miR-NC组转染NC序列;miR-106b-5p组转染miR-106b-5p模拟物;miR-NC+Hp组转染NC序列的同时在培养基中加入Hp菌液(细胞与细菌比例为1∶100);miR-106b-5p+Hp组转染miR-106b-5p模拟物的同时在培养基中加入Hp菌液(细胞与细菌比例为1∶100)。每组均连续干预24 h,设置5次重复。
1.4.3MTS法检测细胞活力 TE-1细胞接种在96孔培养板内,分组干预24 h后采用MTS法进行细胞活力的检测,按照试剂盒说明书在每个培养孔内加入20 μL检测液,继续培养4 h后在酶标仪上检测吸光度值(A)490。
1.4.4流式细胞术检测细胞周期 TE-1细胞接种在培养皿内,分组干预24 h后用胰蛋白酶消化收集细胞,取5×105个细胞与10 μL PI溶液混合,染色后在流式细胞仪上进行细胞周期分析,计算G0/G1期、S期、G2/M期的比例。
1.4.5荧光定量聚合酶链反应(PCR)法检测miR-106b-5p的表达水平 取食管癌组织及分组干预24 h后的TE-1细胞,采用miR提取试剂盒提取组织及细胞中的miR,采用miR cDNA第一链合成试剂盒将miR反转录为cDNA,采用miR荧光定量检测试剂盒对cDNA中的miR-106b-5p表达水平进行检测,检测的体系参照试剂盒进行配制,分别使用miR-106b-5p引物(上游引物序列:5′-TATGCGTAGCTTAGCTAT-3′;下游引物为试剂盒内通用引物)和U6引物(上游引物序列:5′-ACTATGCTATATGCTAGCT-3′;下游引物序列:5′-TATCGTAGCTAGTATAC-3′)。检测程序为95 ℃预变性3 min,95 ℃15 s、60 ℃34 s,重复40个循环,程序结束后生成循环曲线及循环阈值(Ct),以U6为内参,代入2-ΔΔCt计算miR-106b-5p的表达水平。
1.4.6免疫印迹法检测CCND1表达水平 取食管癌组织及分组干预24 h后的TE-1细胞,采用免疫印迹法进行细胞活力的检测,裂解细胞得到蛋白后,将蛋白加入到聚丙烯酰胺凝胶中并按照Western blot流程进行电泳、电转膜、封闭、孵育一抗及二抗,最后在凝胶成像系统内显影得到CCND1、β-actin的蛋白条带,扫描条带的灰度值,以β-actin为内参,计算CCND1的表达水平。
1.4.7双荧光素酶报告基因实验检测miR-106b-5p靶向CCND1 TE-1细胞接种在24孔培养板内,将CCND1的双荧光素酶报告基因转染至细胞内,然后按照miR-NC组和miR-106b-5p组的干预方式分别转染NC序列和miR-106b-5p模拟物,48 h后采用双荧光素酶报告基因检测系统对细胞中的萤火虫荧光活力及海肾荧光活力进行检测,计算报告基因的荧光活力,荧光值=萤火虫荧光活力/海肾荧光活力。
2 结 果
2.1Hp阳性及阴性的食管癌组织中miR-106b-5p、CCND1表达水平的比较 共收集46例食管癌患者食管癌组织,其中Hp阳性33例,Hp阴性13例。Hp阳性患者与Hp阴性患者年龄及性别比较,差异无统计学意义(P>0.05)。Hp阳性患者食管癌组织中miR-106b-5p的表达水平低于Hp阴性患者,CCND1的表达水平高于Hp阴性患者,差异有统计学意义(P<0.05)。见表1、图1。
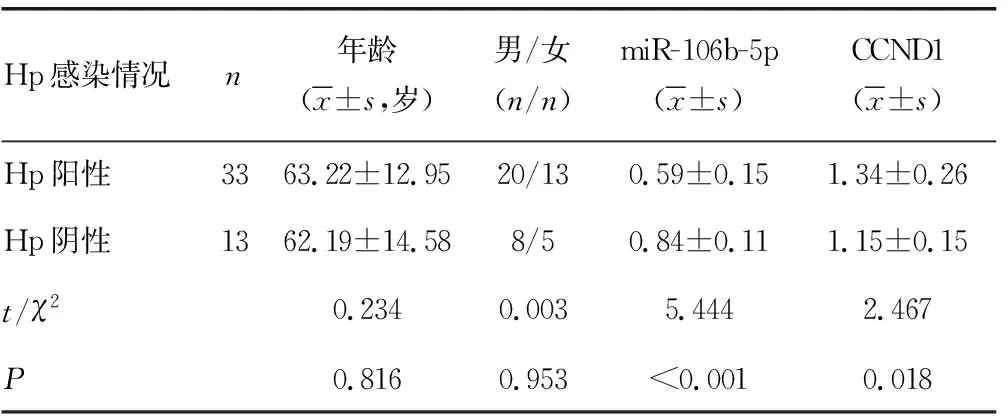
表1 Hp阳性及阴性患者一般资料及食管癌组织中miR-106b-5p、CCND1表达水平比较

图1 Hp阳性及阴性的食管癌组织中CCND1的
2.2食管癌组织中miR-106b-5p与CCND1表达水平的相关分析 Pearson相关分析结果显示,食管癌组织中miR-106b-5p的表达水平与CCND1的表达水平呈负相关(r=-0.414,P=0.004)。
2.3Hp感染对TE-1细胞增殖及细胞周期的影响 Hp组的A490水平及S期、G2/M期比例高于对照组,G0/G1期比例低于对照组,差异有统计学意义(P<0.05)。见表2、图2。

表2 Hp组与对照组A490与细胞周期比例比较
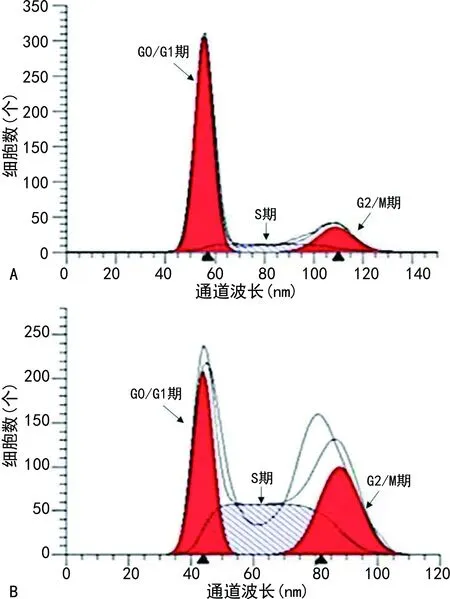
注:A为对照组;B为Hp组。
2.4Hp感染对TE-1细胞中miR-106b-5p、CCND1表达水平的影响 Hp组TE-1细胞中miR-106b-5p的表达水平低于对照组,CCND1的表达水平高于对照组,差异有统计学意义(P<0.05)。见表3、图3。

表3 Hp组与对照组TE-1细胞中miR-106b-5p、CCND1表达水平比较
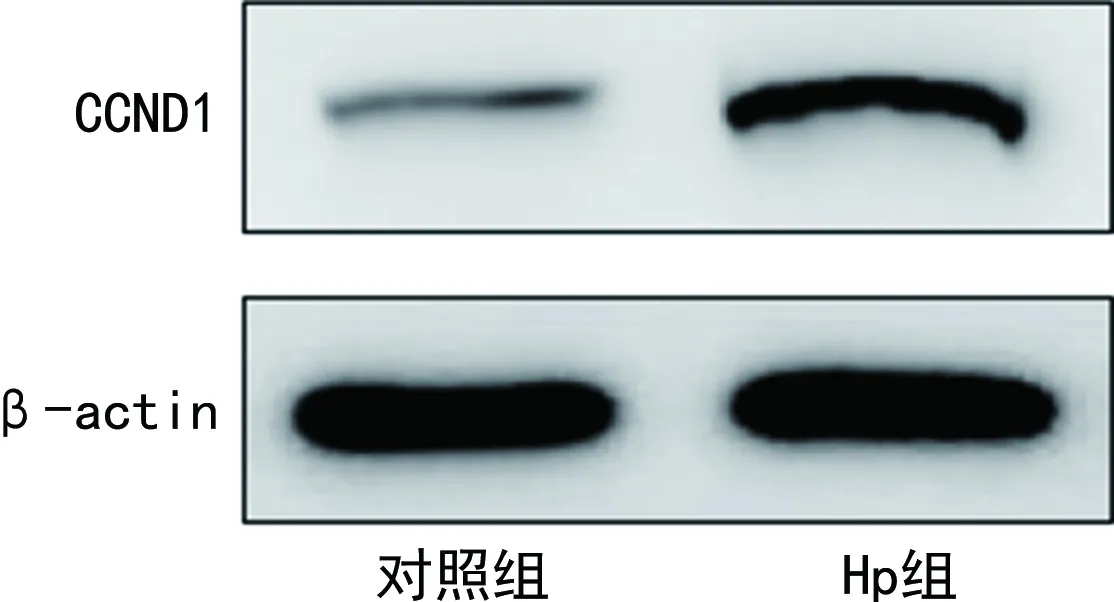
图3 Hp组与对照组TE-1细胞中CCND1的免疫印迹图
2.5TE-1细胞中miR-106b-5p靶向CCND1 miR-106b-5p组TE-1细胞中野生型CCND1报告基因的荧光值低于对照组,差异有统计学意义(P<0.05)。miR-106b-5p组TE-1细胞中突变型CCND1报告基因的荧光值与对照组比较,差异无统计学意义(P>0.05)。见表4。

表4 miR-106b-5p组与对照组CCND1报告基因荧光值比较
2.6过表达miR-106b-5p对Hp感染TE-1细胞中CCND1表达的影响 miR-NC+Hp组TE-1细胞中miR-106b-5p的表达水平低于miR-NC组,CCND1的表达水平高于miR-NC组,差异有统计学意义(P<0.05);miR-106b-5p+Hp组TE-1细胞中miR-106b-5p的表达水平高于miR-NC+Hp组,CCND1的表达水平低于miR-NC+Hp组,差异有统计学意义(P<0.05)。见表5、 图4。

表5 miR-NC+Hp组、miR-NC组和miR-106b-5p+Hp组 miR-106b-5p、CCND1表达水平比较
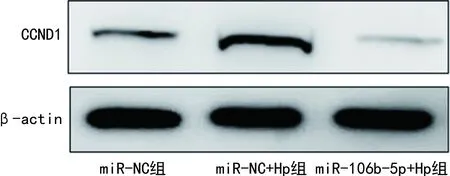
图4 miR-NC+Hp组、miR-NC组和miR-106b-5p+Hp组CCND1的免疫印迹图
2.7过表达miR-106b-5p对Hp感染TE-1细胞增殖及细胞周期的影响 miR-NC+Hp组TE-1细胞的A490水平及S期、G2/M期比例高于miR-NC组,G0/G1期比例低于miR-NC组,差异有统计学意义(P<0.05);miR-106b-5p+Hp组TE-1细胞的A490水平及S期、G2/M期比例低于miR-NC+Hp组,G0/G1期比例高于miR-NC+Hp组,差异有统计学意义(P<0.05)。见表6、图5。

表6 miR-NC+Hp组、miR-NC组和miR-106b-5p+Hp组A490及细胞周期比例比较

注:A为miR-NC组;B为miR-NC+Hp组;C为miR-106b-5p+Hp组。
3 讨 论
Hp是一种在胃黏膜内定植的微需氧革兰阴性菌,国内姜红梅等[4]和陶茂淮等[3]通过横断面研究证实食管癌组织中Hp的感染率高于食管炎组织、食管不典型增生组织,且Hp感染与食管癌的恶性程度有关。POLYZOS 等[9]及LV等[10]的研究结果表明Hp感染是食管癌发病的危险因素之一。DOORAKKERS等[11]通过队列研究证实根除Hp能明显降低食管癌的发病风险。以上结果表明Hp感染与食管癌发病有关,但尚缺乏Hp感染促进食管癌发生、发展的直接细胞实验证据。
胃癌相关的细胞实验研究结果表明, Hp感染胃癌细胞或Hp脂多糖刺激胃癌细胞均可促进胃癌细胞的增殖、加速胃癌细胞的细胞周期进程[12-13]。本研究进行了Hp感染食管癌TE-1细胞的实验,与未感染Hp的对照组TE-1细胞比较,Hp组TE-1细胞的增殖增强,细胞周期S期、G2/M期比例增加,表明Hp感染促进了食管癌细胞的增殖,同时加速了细胞周期进入S期和G2/M期。在此基础上,本研究继续深入探讨Hp感染促进食管癌细胞增殖的分子机制。
CCND1是调控细胞周期进程的关键蛋白,在食管癌、胃癌、结直肠癌等消化道恶性肿瘤中均呈高表达,且与肿瘤的病理进展、预后不良有关[14-16]。目前,研究认为具有抑癌作用的miR-106b-5p是CCND1潜在的上游调控分子,食管癌中miR-106b-5p表达降低会削弱其靶向抑制CCND1表达的作用,进而使CCND1表达增加、细胞周期加速、细胞增殖增强[15]。本研究在手术切除的食管癌组织中检测了miR-106b-5p、CCND1的表达及Hp的感染情况,与Hp阴性食管癌组织比较,Hp阳性食管癌组织中miR-106b-5p的表达水平降低,CCND1表达水平增加,且miR-106b-5p与CCND1的表达呈负相关,表明Hp感染可能通过调控miR-106b-5p/CCND1途径参与食管癌的发生、发展。因此,本研究在细胞实验中进一步以miR-106b-5p靶向调控CCND1为基础,探讨Hp感染促进食管癌发生、发展的机制。
本研究结果显示,在Hp感染的食管癌TE-1细胞中miR-106b-5p的表达水平降低、CCND1表达水平增加,与Hp感染的食管癌组织中miR-106b-5p及CCND1的变化趋势一致。同时本研究还通过双荧光素酶报告基因实验证实miR-106b-5p组野生型CCND1报告基因的荧光值降低,表明miR-106b-5p直接靶向调控CCND1,与食管癌组织中miR-106b-5p表达与CCND1呈负相关的结果吻合。miR-106b-5p的抑癌作用已经在多种恶性肿瘤细胞中得到证实[17-18],本研究进一步探讨了miR-106b-5p在Hp感染促进食管癌细胞增殖及细胞周期进程中的作用。在Hp感染的同时转染miR-106b-5p的模拟物,逆转Hp抑制miR-106b-5p表达的作用后,CCND1的表达水平降低,细胞增殖减弱,细胞周期G0/G1期的比例增加,表明过表达miR-106b-5p削弱了Hp对食管癌细胞的调控作用,抑制了细胞增殖,使细胞周期停滞于G0/G1期并下调CCND1的表达水平。这也提示Hp感染对食管癌细胞的调控作用与其调节miR-106b-5p及CCND1的表达有关。
综上所述,Hp感染食管癌细胞后促进细胞增殖、加速细胞周期,这一作用与调控miR-106b-5p/CCND1途径有关。Hp感染能够抑制miR-106b-5p表达,削弱miR-106b-5p对CCND1的靶向抑制作用,进而使CCND1表达增加、细胞周期加速。

