血清kruppel样因子4、可溶性p选择素在子痫前期中的临床应用价值
沈 娟,王泯蓉△,李思吟
电子科技大学医学院附属绵阳医院/四川省绵阳市中心医院:1.妇产科;2.风湿免疫科,四川绵阳 621000
子痫前期是临床常见的妊娠并发症,是导致孕产妇及围生儿发生不良结局的重要原因之一[1]。目前,临床主要通过药物治疗来控制病情、延长孕周,尽可能地保证母婴的生命安全,如果患者的治疗效果不佳,则需要终止妊娠,该病严重危害患者的身心健康[2]。kruppel样因子4(KLF4)是锌指样转录因子(KLF)家族的成员之一,在机体的细胞增殖、迁移、分化等过程中发挥重要的作用,影响多种疾病的发生与发展[3]。既往研究发现,KLF4在食管鳞状细胞癌患者中呈低表达,并且与患者预后密切相关[4]。可溶性p选择素(Ps)是血小板活化的特异性指标之一,能够反映机体的凝血功能[5]。既往研究发现,大动脉粥样硬化型脑梗死患者血清Ps水平升高,并且与该病发生、发展密切相关[6]。但是目前关于血清KLF4、Ps与子痫前期的相关研究尚少。因此,本研究主要探讨了血清KLF4、Ps对子痫前期的预测价值,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2019年6月至2021年6月本院收治并确诊的116例子痫前期患者作为研究对象,根据疾病严重程度分为轻度组(62例)、重度组(54例)。轻度组年龄20~38岁,平均(34.67±1.63)岁;重度组年龄20~38岁,平均(34.12±1.57)岁。(1)纳入标准:①符合《妇产科学》[7]中的子痫前期诊断标准;②年龄≥20岁;③均为单胎妊娠。(2)排除标准:①合并心、肝、肾功能不全;②合并恶性肿瘤或免疫系统疾病;③合并甲状腺疾病,包括甲状腺功能亢进症、甲状腺功能减退症等;④流产或终止妊娠;⑤既往有精神病史或认知功能障碍;⑥依从性差或不能配合本次研究。另外选取40例同期来本院体检的健康孕妇作为对照组,年龄20~38岁,平均(30.29±1.51)岁。本研究经本院医学伦理委员会审核批准,患者及家属知情同意。
1.2方法
1.2.1资料收集 收集3组研究对象的临床资料,包括年龄、体质量指数(BMI)、孕周、孕次、产次、糖尿病史、高血压史。
1.2.2血清KLF4、Ps水平检测 采集所有研究对象的清晨空腹肘静脉血6 mL,室温下静置0.5 h后,3 000 r/min离心10 min,取上清液,放置于-80 ℃冰箱保存备用,采用酶联免疫吸附试验检测血清KLF4、Ps水平。所有试剂盒均购于上海纪宁生物科技有限公司,具体操作均按照试剂盒说明书进行。
1.2.3子痫前期严重程度判定[8]轻度:妊娠20周后出现血压≥140/90 mm Hg,随机尿蛋白(+)或尿蛋白≥0.3 g/24 h,如果无蛋白尿则需要合并下列任何一项并发症,包括血小板计数降低、肝功能损害、肾功能损害、肺水肿、中枢神经功能异常。重度:血压≥160/110 mm Hg,或尿蛋白>2.0 g/24 h,有持续性头痛、上腹部疼痛、少尿、血清转氨酶水平升高、肺水肿、血肌酐水平升高等并发症之一。
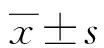
2 结 果
2.1轻度组、重度组、对照组基线资料比较 3组孕妇BMI、孕周、孕次、产次、有糖尿病史比例比较,差异无统计学意义(P>0.05)。3组孕妇年龄>35岁、有高血压史比例比较,差异有统计学意义(P<0.05)。见表1。
2.2轻度组、重度组、对照组血清KLF4、Ps水平比较 血清KLF4水平在重度组、轻度组、对照组中依次升高,血清Ps水平在重度组、轻度组、对照组中依次降低,两两比较差异均有统计学意义(P<0.05)。见表2。
2.3血清KLF4、Ps对子痫前期的预测价值 血清KLF4、Ps联合检测预测子痫前期的曲线下面积(AUC)为0.921,明显大于单项指标检测的AUC(P<0.05)。见表3、图1。
2.4发生子痫前期的多因素Logistic回归分析 将是否发生子痫前期作为因变量(否=0、是=1),将表1及表2中差异有统计学意义(P<0.05)的因素作为自变量进行多因素Logistic回归分析,结果显示年龄>35岁、有高血压史、KLF4水平降低、Ps水平升高是发生子痫前期的危险因素(P<0.05)。见表4。
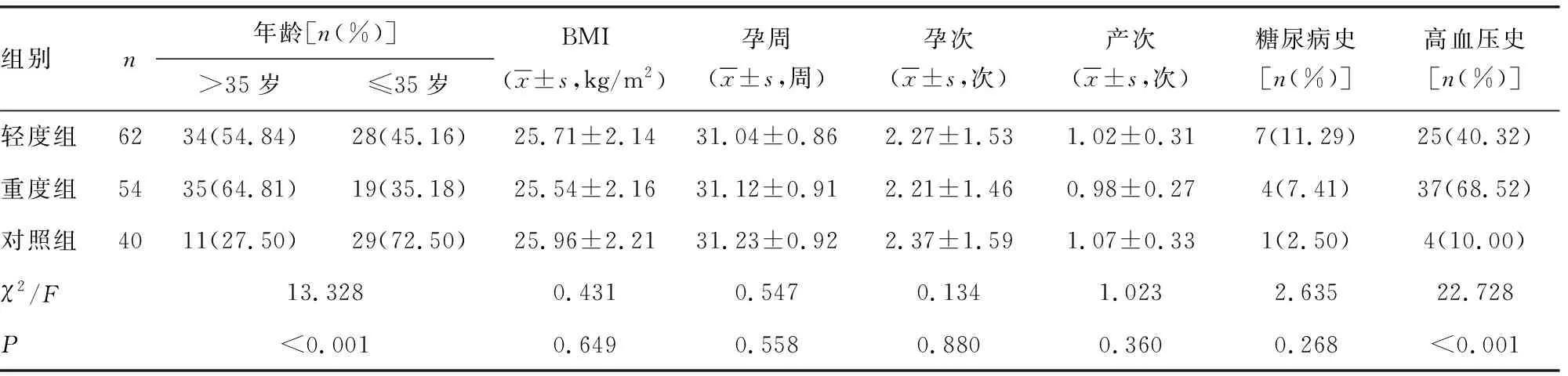
表1 轻度组、重度组、对照组基线资料比较
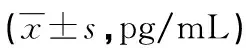
表2 轻度组、重度组、对照组血清KLF4、Ps水平比较
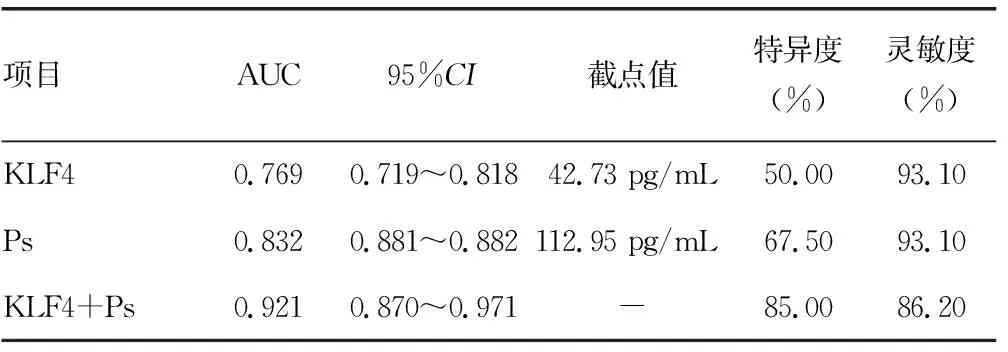
表3 血清KLF4、Ps对子痫前期的预测价值
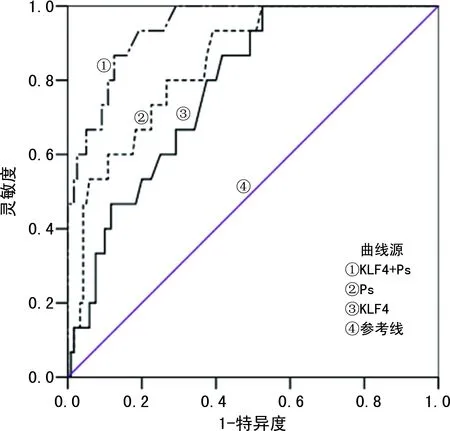
图1 血清KLF4、Ps对子痫前期的预测价值
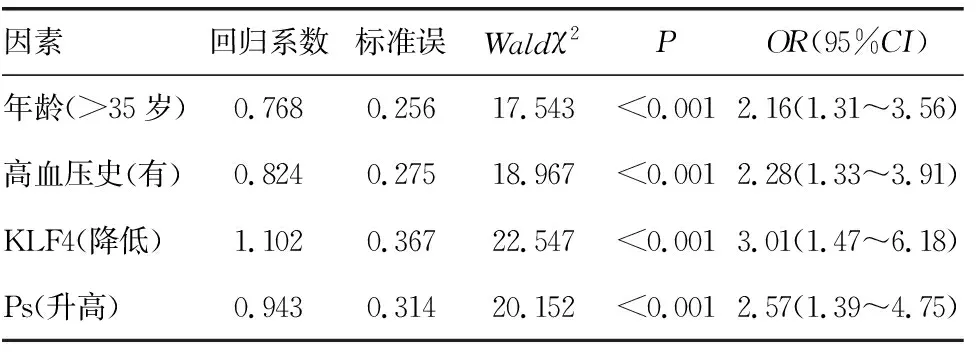
表4 发生子痫前期的多因素Logistic回归分析
3 讨 论
子痫前期是妊娠期特有的一种多系统进展性疾病,常发生在妊娠20周以后,发病率为2%~8%,临床表现为头痛、视力模糊、高血压、蛋白尿等,其发病机制尚不明确,可能与遗传、子宫-胎盘血管结构异常、血管内皮细胞受损等多种因素有关[9-10]。近年来,随着我国“三孩”政策的开放,女性生育年龄推迟,子痫前期的发病率有明显上升的趋势,严重危害孕妇和胎儿的健康[11]。目前,临床上常用24 h尿蛋白定量来早期诊断子痫前期,但是其操作周期长、标本保存不当容易使结果出现误差、特异性较差,不能及时、准确地诊断子痫前期,存在一定的局限性[12]。因此,寻找合适的实验室指标用于早期诊断子痫前期,以指导及时对患者进行干预和治疗具有重要的临床意义。
本研究主要探讨血清KLF4、Ps对子痫前期的预测价值,结果显示血清KLF4水平在重度组、轻度组、对照组中依次升高(P<0.05),提示血清KLF4水平在子痫前期患者中呈低表达,可能参与其发病过程。KLF4位于染色体9p31,由470个氨基酸残基组成,相对分子质量为55×103,其特异性的C末端DNA结合基序,促使其能够参与机体的单核细胞活化、心脏重塑、脂肪形成等多个生理过程[13-14]。KLF4作为人体自身免疫过程中重要的转录因子,在胃肠道上皮组织、胸腺细胞、T淋巴细胞中均有表达,能够参与机体细胞的增殖、迁移、分化等过程[15]。近年来,相关研究发现,KLF4能够抑制炎症因子和趋化因子的分泌,减轻全身性炎症反应,同时对血管内皮细胞具有保护作用[16]。当机体血清KLF4水平降低时,血管内皮受损,从而促进血管痉挛,血压升高,诱发子痫前期。
本研究结果显示,血清Ps水平在重度组、轻度组、对照组中依次降低(P<0.05),提示血清Ps水平在子痫前期患者中呈高表达,其水平越高病情越严重。矫永庆等[17]研究发现,血清Ps水平在脑胶质瘤患者中升高,并且与疾病严重程度有关。Ps是细胞黏附分子选择素成员之一,相对分子质量为140×103,在血小板α颗粒和血管内皮细胞Weibel-Palade体上均有表达,能够促进血栓素A2释放入血,抑制前列环素、一氧化氮的扩血管作用[18]。Ps在正常情况下处于静止状态,当机体血小板被活化时,血清Ps水平升高,参与机体的炎症反应、血栓形成、免疫损伤等病理过程[19]。同时,Ps能够介导血小板、血管内皮细胞与单核细胞、中性粒细胞之间的黏附作用,加剧机体的炎症反应,造成血管内皮细胞损伤,从而参与子痫前期的发病过程。ROC曲线分析结果显示,血清KLF4、Ps预测子痫前期的AUC(95%CI)分别为0.769(0.719~0.818)、0.832(0.881~0.882),截点值分别为42.73、112.95 pg/mL,二者联合检测预测子痫前期的AUC(95%CI)为0.921(0.870~0.971)。这提示血清KLF4、Ps能够作为预测子痫前期的实验室指标,且二者联合检测的预测效能优于单项指标。多因素Logistic回归分析结果显示,年龄>35岁、有高血压史、KLF4水平降低、Ps水平升高是发生子痫前期的危险因素(P<0.05)。周隽等[20]研究发现,孕期合并高血压会增加子痫前期的发生风险,与本研究结果一致。高血压会引起血管内皮损伤,诱发全身小动脉痉挛,最终导致子痫前期发生。
综上所述,KLF4水平降低、Ps水平升高是发生子痫前期的危险因素,KLF4、Ps均可作为预测子痫前期的实验室指标,且二者联合检测的预测价值更高。

