术前超声微血流分级预测肝细胞癌微血管侵犯的价值
马国杰 方晶晶 杨现奎 贺晓
肿瘤物理消融方式及外科手术虽能延长HCC患者生存时间,但复发风险较高,且与肿瘤大小、肿瘤病理分级、手术方式、微血管侵犯(MVI)等因素有关;尤其是MVI,已被证实是HCC复发转移的危险因素[1]。有研究表明,影像学及AFP联合检测已成为术前无创评估HCC患者MVI的有效手段[2]。但既往研究大多致力于探索肿瘤数量、大小、边缘状态、包膜完整度等影像学特征在HCC患者MVI预测方面的意义,关于术前超声微血流分级对HCC患者MVI的预测效能尚不明确。因此,本研究初步探究术前超声微血流分级预测HCC患者MVI的价值。
资料与方法
一、一般资料
纳入2018年8月至2021年8月鹤煤总医院收治的HCC患者138例,根据手术病理结果将患者分为有MVI组60例和无MVI组78例。获院伦理委员会审核。纳入标准:①诊断符合《原发性肝癌诊疗规范(2017年版)》[3];②术前7 d内行常规超声检查,超声检查及术中标本均未发现肉眼可见的血管内癌栓;③Child-Pugh A级128例,B级10例。排除标准:复发性肿瘤;多发性肿瘤;Child-Pugh C级;既往接受过肝动脉化疗栓塞、放疗等干预。
二、方法
选择彩色多普勒超声诊断仪(PHILIPS EPIQ7C)。常规超声检查记录肿瘤大小、数目、低回声晕环、内部回声情况。选取病灶最大切面行微血流成像检查,并存储静态图像及动态图像5~10 s。超声对比剂选择SonoVue(意大利Bracco),机械指数低于0.1,动态范围维持50~60 dB,注射对比剂时启动计时器。超声微血流成像观察肝肿瘤血管分级及肝肿瘤血管分布情况。采用Alder-score定量评价方式行肝肿瘤血管分级,0级:肿块内未出现血流信号;Ⅰ级:肿块内见细短棒状或点状血管1或2个;Ⅱ级:肿块内见点状血管3或4个,或1支较长血管(其长超过或接近肿块半径)穿入病灶;Ⅲ级:肿块内见点状血管5个以上,或有2支较长血管。肝肿瘤血管分布包括中央血流、周边血流及混合血流(中央及周边血流)。超声造影观察瘤周强化、肿瘤边缘、廓清时相情况及始增、达峰和廓清时间。显微镜下于血管腔内(被内皮细胞衬覆)发现癌细胞巢团视为MVI,按照MVI程度分为有MVI组和无MVI组,M1[MVI不超过5个,且在近癌旁肝组织区域(不超过1 cm)发生]和M2[MVI超过5个,或在远癌旁肝组织区域(超过1 cm)发生]视为有MVI组,M0(未见MVI)视为无MVI组[4]。
免疫荧光法(试剂盒由安徽省易丰合医疗科技有限公司提供)测定AFP。
三、统计学方法

结 果
一、两组临床特征比较
结果有MVI组血清AFP水平≥400 μg/L占比较无MVI组更高(P<0.05),见表1。
二、两组影像学特征比较
结果有MVI组肿瘤>5 cm、微血流分级为Ⅲ级、肿瘤边缘不光滑和瘤周强化的占比显著高于无MVI组(P<0.05),见表2,图1。

表1 两组临床特征比较[例(%)]
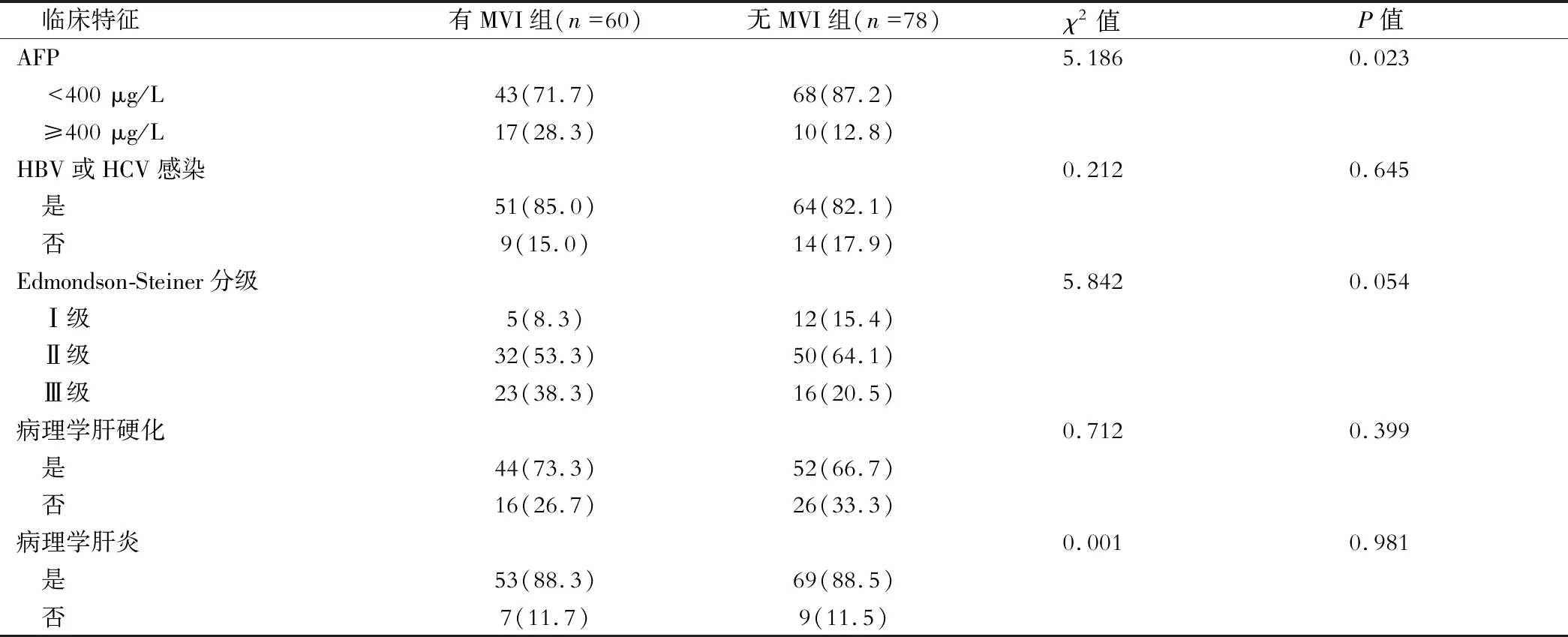
续表1

表2 两组影像学特征比较

A:79岁女性HCC患者,既往有消化道肿瘤病史,肝脏彩超检查显示肝右叶见不均质中等回声,周边低回声晕环绕,内部及周边出现条状及点状血流信号;B:58岁男性HCC患者,既往有乙型肝炎病史,肝脏彩超检查显示肝右叶可见不均质低回声,周边可见环状血流信号
三、多因素分析
血清AFP水平、肿瘤大小、微血流分级、肿瘤边缘不光滑和瘤周强化是HCC患者MVI的独立预测因素(P<0.05),见表3。

表3 多因素分析HCC患者MVI的影响因素
四、血清AFP水平联合影像学特征预测MVI的效能分析
血清AFP水平联合影像学特征(包括肿瘤大小、微血流分级、肿瘤边缘不光滑和瘤周强化)预测MVI的AUC为0.954(95%CI=0.912~0.996,P<0.01),约登指数、敏感度、特异度和准确度分别为0.907、93.3%、97.4%和95.7%。
讨 论
研究表明,MVI与HCC患者不良预后(复发风险增加、远期生存率下降)密切相关[5],是HCC患者术后转移复发的危险因素[6]。HCC患者MVI发生率高达15.0%~57.1%,与诊断标准、标本取材等有关[7]。本研究中,138例HCC患者中有60例出现MVI,发生率为43.5%,与报道结论吻合。虽然既往研究表明,部分CT及MRI征象对MVI有预测价值,但仅有肿瘤直径、包膜类型、结节类型是普遍认可的征象,这些征象单独应用预测效能并不高[8]。
本研究中,AFP≥400 μg/L是患者出现MVI的独立危险因素,与李文萃等[9]报道结论相似。血清AFP水平能反映HCC恶性程度,其水平越高,肿瘤分化程度及恶性程度越高,侵袭性越强,MVI风险越高。本研究中,肿瘤大小是MVI发生的独立危险因素,与张菊珍等[10]报道结论一致。胡月雷等[11]的研究结果也显示,肿瘤直径>5.0 cm是MVI出现的独立预测因素。肿瘤直径越大,周边肝组织越多,微血管数量也相应增加,MVI风险也越大。但童林等[12]发现肿瘤大小并不是MVI出现的危险因素,可能与样本量大小等因素有关。
本研究结果显示,微血流分级为Ⅲ级是MVI出现的独立危险因素,与Matsumoto等[13]报道结论一致。Reginelli等[14]也指出,超声微血流成像中血流高分级是MVI出现的风险因子。超声微血流成像中血流分级数增加的机制可能反映了存在MVI的HCC患者血供动态灌注变化。通常肿瘤周围微小癌栓会阻塞微小门静脉分支,导致局部门静脉供血缺少或减少,引发动脉代偿性灌注,故超声微血流成像中表现为血流分级数增加。
本研究结果显示,瘤周强化是MVI出现的危险因素,提示超声造影瘤周强化对HCC患者MVI具有预测意义。研究表明,瘤周强化对MVI具有重要的预测作用[15]。肿瘤周围区域门静脉分支遭侵犯时,因癌栓阻塞作用会导致门静脉灌注减少,促使肝动脉灌注增加,瘤周血流呈高灌注状态,故表现为瘤周高增强区。可见,动脉期瘤周强化属于肿瘤周围血流动力学改变结果,往往提示代偿性肝动脉高灌注。肿瘤边缘不光滑是肿瘤向外突破包膜并侵入非肿瘤性肝实质的结果,朱永健等[16]报道边缘不光滑对预测MVI有重要价值。本研究结果显示,肿瘤边缘不光滑是MVI出现的危险因素,与上述报道吻合。出现MVI时,肿瘤边缘组织可能受到侵犯,因此会导致肿瘤边缘不光滑。可见,肿瘤边缘不光滑往往预示肿瘤具有侵袭性生物学行为,故可用于术前提示存在MVI。
HCC患者AFP、肿瘤大小、肿瘤边缘不光滑、瘤周强化、超声微血流成像的血流分级与MVI的内在关系较为复杂,任何一个单一因素预测HCC患者MVI较为困难。本研究将术前超声肿瘤>5 cm、微血流分级为Ⅲ级、肿瘤边缘不光滑、瘤周强化与血清AFP≥400 μg/L相结合,联合预测HCC患者MVI,发现其敏感度和特异度分别为93.3%和97.4%,提示联合预测效能较高。
综上所述,除血清AFP水平、肿瘤大小、肿瘤边缘不光滑和瘤周强化外,术前超声微血流分级对预测HCC患者MVI也有一定价值,上述指标联合检测可提高预测效能。但本研究未分析术前超声微血流分级对HCC患者预后的预测价值,今后应继续深入探究。
利益冲突声明:所有作者均声明不存在利益冲突。

