新型改良低预充体外循环系统在成人心脏外科手术中有效性的随机对照试验方案
高思哲,周 纯,闫姝洁,滕 媛,刘 刚,王 茜,王 建,楼 松,胡 强,高国栋,于 坤,吉冰洋
自2010 年起,本中心通过整合改良微创管路、迷你停搏液、负压辅助静脉引流(vacuum-assist venous drainage, VAVD)装置等建立了改良低预充体外循 环(extracorporeal circulation,ECC) 系 统——FUWAI-SAVE 系统,并通过回顾性研究证实在成人心脏外科手术中采用该系统可以显著减少患者围ECC 期血制品使用和术后胸腔引流量、缩短术后机械通气时间[1-2]等。 基于本中心既往围术期数据,在探究心脏外科手术患者输血危险因素的过程中发现患者年龄、性别、体重、术种、术前基本状况等变量具有一定影响[3-4],并尝试建立了阜外围ECC 期输血风险分层预测评分(FUWAI-SAVE 评分)。 评分内容包含:年龄、性别、体表面积、术前血红蛋白、手术方式、纽约心功能分级、急诊手术及二次手术。 低风险患者输血概率低于30%,即使施加临床干预,输血率降低的临床意义并不明显;高风险患者输血概率可达60%以上,进行临床干预可能影响预后;中风险患者输血概率为30%~60%,积极进行临床干预很有可能提高患者预后。 除此之外,既往研究已证实:ECC 管路会增加血液与体外异物表面的接触面积,激活白细胞、内皮细胞和血小板[5];ECC 晚期可能由于缺血-再灌注损伤、内毒素血症、凝血功能障碍和肝素/鱼精蛋白反应等加剧全身炎症反应[6],导致术后死亡率及并发症发生率增高[7]。
因此,本研究旨在以前瞻性随机对照的方式,探究FUWAI-SAVE 系统是否能够降低患者围ECC 期红细胞输注率并分析该系统对患者全身炎症反应的影响情况,从而验证其有效性与安全性。
1 资料与方法
1.1 研究设计 本研究是一项单中心单盲随机对照试验(试验注册编号:ChiCTR2100050488),纳入行ECC 下心脏手术患者,随机分为干预组与对照组,分别接受FUWAI-SAVE 系统和常规ECC 系统行ECC 下心脏手术,评价FUWAI-SAVE 系统与常规ECC 系统相比,在成人心脏外科血制品输注风险患者中应用的实效性。 本试验获得阜外医院伦理委员会的批准(伦理编号:2021-1486)。 研究流程见流程图(图1)。
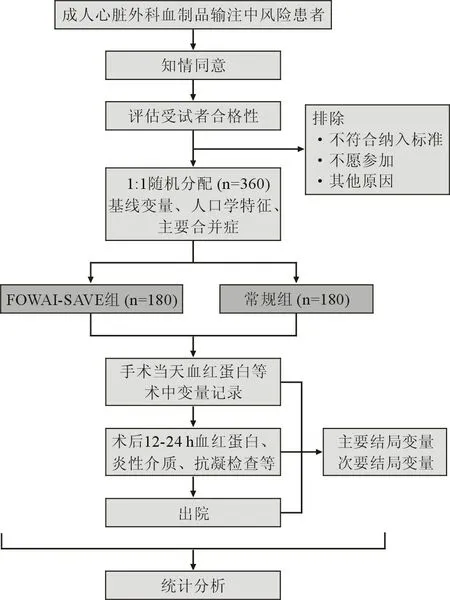
图1 研究流程图
1.2 研究对象与知情同意
1.2.1 入选标准 ①由各种病因引起进行ECC 下心脏直视手术;②年龄≥18 岁;③FUWAI-SAVE 评分14~18 分(表1);④受试者签署书面知情同意。

表1 阜外改良低预充体外循环系统评分
1.2.2 排除标准 ①1 个月内参加过其他临床试验,且经评估对本研究有较大影响;②体重<40 kg;③既往对ECC 管路、血液回收器械有过敏史者;④行心脏移植或心肺联合移植;⑤行急诊手术;⑥行二次开胸手术;⑦行杂交手术;⑧行需要进行深低温ECC 的大血管手术;⑨行胸腔镜辅助手术;⑩有精神性疾病或病史者、吸毒者、艾滋病、梅毒、乙肝、丙肝病毒阳性患者;患有严重贫血、感染、肿瘤、活动出血、严重的肝脏、肺脏、肾脏疾病者;以及其他情况经研究者判断认为不适合入组者。
1.2.3 知情同意 试验开始之前,研究者必须向受试者或其监护人以书面文字形式说明该临床试验的详细情况,包括试验性质、试验目的、试验内容、预期疗效、已知的、可以预见的风险和可能发生的不良事件及应对措施等,向其或其法定代理人提供完整、全面、易于理解,且经伦理委员会批准的知情同意书内容及说明,并回答患者提出的相关问题。 在受试者充分理解本试验并签署知情同意书后,方可入选。知情同意书由被授权的研究医师与受试者本人或其监护人共同签署,一式两份,双方各保存一份。
1.3 干预措施 干预措施为进行ECC 下心脏直视手术所用ECC 系统[2],干预组患者接受FUWAISAVE 系统,对照组患者接受常规ECC 系统行ECC下心脏外科手术。
1.3.1 FUWAI-SAVE 系统 应用改良低预充管道连接整合动脉微栓滤器的氧合器及微量停搏液灌注管路。 停搏液中钾离子浓度600 mmol/L,晶体∶血液为1 ∶30,同时使用VAVD 装置给回流室施加负压;FUWAI-SAVE 系统动静脉管路内径均为3/8 英寸,动脉管路长140 cm,静脉管路长125 cm,主泵管长77 cm,管路总长度342 cm,静态预充量750 ml。
1.3.2 常规ECC 系统 应用常规管道连接普通氧合器、分离式动脉微栓滤器及1 ∶4 氧合血心脏停搏灌注管路,停搏液为改良托马斯停搏液(钾离子浓度100 mmol/L,晶体∶血液为1 ∶4);该系统动脉管路内径3/8 英寸,长度165 cm,静脉管路内径1/2 英寸,长度185 cm,主泵管长度193 cm,氧合器出口至动脉微栓滤器之间管路内径3/8 英寸,长度120 cm,总长度663 cm,静态预充量1 250 ml。
分别吸取5 mL溶液于两个无菌细口三角瓶中,分别加入无菌的MRS培养基和ATB培养基,然后再添加终浓度为10%vol的乙醇和终浓度为10 mg/LSO2的亚硫酸溶液。25℃厌氧培养48 h,取培养液镜检并革兰氏染色为阳性后,继续上述条件转接3次。
1.4 血制品输注指征
1.4.1 围ECC 期红细胞输注指征 ①ECC 后患者血红蛋白(hemoglobin, Hb)<80 g/L 输注红细胞;②ECC 期间患者Hb<60 g/L,或存在脑缺血风险的患者Hb<70 g/L 应当输红细胞;③对心肺功能受限、活动出血、实验室或临床参数(如混合静脉血氧饱和度、心电图或超声心动图)等提示存在重要脏器缺血,可考虑输注红细胞适当提高患者Hb 水平;④当患者Hb>100 g/L 时,除非新发生重要脏器缺血,不需要输红细胞。
1.4.1 血小板输注指征 当患者血小板计数(platelet, Plt)<50×109/L 且有出血时,输注血小板。
1.4.3 新鲜冰冻血浆输注指征 ①凝血酶原时间(prothrombin time,PT)>1.5 倍正常值或>17 s、国际标准化比值>1.6、活化部分凝血酶时间(activated partial thromboplastin time, APPT)>2 倍正常值,合并出血;②大量输入库存全血或浓缩红细胞后(出血量或输血量相当于患者自身血容量,约70 ml/kg);③血液回收洗涤红细胞量达到30%自身血容量时;④无凝血酶原复合时紧急对抗华法林的抗凝血作用(5~8 ml/kg);⑤抗凝血酶Ⅲ缺乏引起肝素耐药者。
1.5 数据采集 数据收集时间见临床研究流程表(表2)。 数据将从电子医疗记录中收集,输入一个定制的数据库,并存储在一个安全的服务器上。 本研究收集血样两次,在术前2 h 及术后24 h 内,分别收集血样1 ml,用于检测血管紧张素(angiotensin,Ang)与中性粒细胞外诱捕网(neutrophilextracellular traps, NETs),检测方法为双抗体夹心法酶联免疫吸附检测技术。

表2 临床研究内容及流程表
1.6 随机与盲法 确认受试者符合入排标准并取得受试者书面签署的知情同意后进行随机分组。 通过计算机随机数字生成程序进行区组随机化分组。随机由一名研究人员完成,负责保管随机序列,隐藏区组大小,并与分配的研究人员沟通。 研究人员将尽可能在手术开始时进行随机分组,若受试者因任何原因在分组后无法接受手术,被保留该名受试者的试验编号和随机分组情况。 受试者及其家属将不知晓受试者的分组分配结果。
2 研究结果指标
主要结局指标为围ECC 期红细胞输注率。 定义为ECC 开始至患者出院期间的红细胞输注率。次要结局指标包括:①围ECC 期其他血制品输注率,包括:血小板及新鲜冰冻血浆;②围ECC 期血制品输注总量,包括:红细胞、血小板及新鲜冰冻血浆;③术后12~24 h 内血红蛋白;④术后12~24 h 内C反应蛋白及炎性因子,包括白介素(interleukin,IL)-1ß,IL-2,IL-4,IL-5,IL-6,IL-8,IL-10,IL-12p70,IL-17,肿瘤坏死因子-α,干扰素(interferon,IFN)-α,IFN-γ;⑤术后12 ~24 h 内PT,APPT,纤维蛋白原,纤维蛋白原降解产物,D 二聚体;⑥术后12 ~24 h 内NETs;⑦术后12~24 h 内Ang;⑧围ECC 期主要并发症发生率,包括:围术期心梗(术后48 h 内,肌钙蛋白I>28 mg/L 或肌酸激酶同工酶>240 IU/L)、感染(病原体培养阳性)、急性肾损伤(术后一个月内最高血肌酐值/术前最近一次血肌酐值>2 或术后最高血肌酐值≥354 mmol/L)、脑血管事件(术后影像学检查证明发生出血性或缺血性卒中);⑨院内死亡率;⑩术后机械通气时间、ICU 时间及住院时间;术后24 h 胸腔引流量;ICU 花费及住院花费。
3 讨 论
3.2 受试者的选择标准及理由 本研究数据统计应基于意向治疗的原则,即无论最终所使用的治疗方案如何,须按照随机时所指定的治疗方案进行分析。
全分析集(full analysis set, FAS):按照意向治疗原则确定的受试者集指所有进入随机且完成ECC下心脏直视手术的受试者,构成本试验的FAS。 FAS用于基线信息和终点指标的分析,是本试验终点评价的主要数据集。
符合方案集(per protocol set, PPS):所有随机化,完成ECC 下心脏直视手术,并完成所有访视信息,且排除严重违背方案的受试者,构成本试验的PPS。 严重违背方案的将在数据审核时最终确定。PPS 用于终点指标的分析, 是本试验终点评价的次要数据集。
3.3 数据缺失处理方法 在分析前的数据核查阶段排查数据缺失或数据,尽最大可能恢复或修正缺失及错误的数据。 如缺失数据无法避免,则采用尽量保守的缺失数据统计方法加以完善。 对于主要终点的缺失,本研究采用对照组平均数插值。 对于一般变量的缺失,本研究仅分析非缺失的部分。 在数据核查阶段,还应注意离群值,原则上离群值由研究者确定数值是否保留,统计上可对离群值进行敏感性分析。
3.4 统计描述和假设检验方法 统计分析软件采用STATA©15 软件。 所有的统计检验均采用双侧检验,P<0.05 将被认为所检验的差别有统计意义。 定量指标的描述将计算均值、标准差、中位数、最小值、最大值、下四分位数(Q1)、上四分位数(Q3),分类指标描述各类的例数及百分数。 对两组一般情况的比较将根据指标的类型采用适当的方法进行分析,定量资料的组间比较采用根据数据分布情况采用成组t检验或Wilcoxon 秩和检验,分类数据采用卡方检验或精确概率法(若卡方检验不适用),等级资料采用Wilcoxon 秩和检验。
3.5 伦理原则及受试者保护 本试验遵循赫尔辛基宣言(2013 年)、《涉及人的生物医学研究伦理审查办法》(2016)及中国有关临床试验研究规范及法规。
本研究干预组应用的FUWAI-SAVE 已在本中心应用超过十年,与常规ECC 系统风险相同,随机分配后不会增加临床风险。 本研究拟收集血样两次,收集血样与临床常规采集血气分析用血同时进行,不增加临床采血风险。 检测完成后,受试者的剩余血样将会被销毁。 同时,为降低患者个人数据泄露风险,研究对所有个人信息进行匿名化处理,数据导出过程遵循保密原则,导出的数据库由本研究的研究者在不连接外网的电脑单独存储,确保数据库不对外泄漏。
试验退出标准如下:①试验过程中发现严重安全性问题,应及时保护受试者安全,必要时中止试验;②在试验中发现FUWAI-SAVE 系统不具有临床价值,应停止试验;③试验中发现临床试验方案有重大失误,或出现重大的偏差,难以评价FUWAISAVE 系统的安全性和有效性,应中止试验。

