泡椒凤爪加工过程中细菌群落组成及变化分析
尹含靓,杜秋,谭益升,孙军华,,刘洋,3,蒋立文,3*
(1.湖南农业大学食品科学技术学院,湖南长沙 410128)(2.盐津铺子食品股份有限公司,湖南长沙 410000)(3.食品科学与生物技术湖南省重点实验室,湖南长沙 410128)
泡椒凤爪是用鸡爪加工成的一种休闲食品,主要流行于川渝地区[1],其鲜脆开胃,且富含蛋白质、矿物质、氨基酸、维生素等[2],具有维持钾钠平衡、提高免疫力、美容养颜等功效,经常食用有利于人体健康[3]。泡椒凤爪生产过程比较复杂,主要生产工艺包括原材料解冻、切分、去血水、漂烫、卤制调味、真空包装、辐照处理等工序,且泡椒凤爪属于动物性食品,其营养物质丰富,在加工贮藏过程中常被微生物污染。高温热杀菌技术不适用于泡椒凤爪,因为泡椒凤爪经高温处理或低温长时间处理后,会导致胶原蛋白析出影响产品脆度和外观。而国家在2015 年明确提出禁止鸡爪加工中使用过氧化氢后,添加食品防腐剂结合辐照杀菌成为了泡椒凤爪常用的保质方法[4]。辐照杀菌是一种冷杀菌的方式,它可以最大限度保留食品的风味及品质[5],但其杀菌效果受多种因素的影响,如微生物对辐照的耐受性、辐照剂量等[6],而不同的食品防腐剂对不同微生物的抑制效果也不同。目前泡椒凤爪产品中依然存在微生物导致的溶烂、涨气等腐败现象,而国内外有关泡椒凤爪产品中腐败微生物的研究较少。杨琴[2]发现导致泡椒凤爪胀袋的微生物包括解脂耶氏酵母(Y.lipolytica)、毕赤氏酵母(P.guilliermondii)、肠膜明串珠菌(L.mesenteroides)和产朊假丝酵母(Candida utilis)。马含笑[7]对发软泡椒凤爪中微生物进行分离,得到一株小鳟鱼大洋芽孢杆菌(Oceanobacillus oncorhynchi)。因此探究泡椒凤爪加工过程中微生物多样性变化,有利于生产过程中的微生物控制及防腐保鲜技术研究。
传统微生物培养法被广泛用于计数和分离鉴定食品中的微生物,可以直接反映样品中可培养微生物的数量级及食品的变质程度[8],但对不可培养微生物的研究存在局限性[9]。近年来应用于检测食品中微生物群落组成的高通量测序技术是一种高效、准确的检测技术[10],可以更全面分析样品中微生物群落的组成及相对丰度。目前研究中常采用传统培养法与高通量测序法结合详细分析食品中微生物存在情况。张欣等[11]利用高通量测序及传统培养方法分析了发酵普洱茶细菌多样性,发现高通量测序可以更全面揭示发酵普洱茶样品的细菌群落构成。Cauchie 等[12]对288 份猪肉末样品进行高通量测序并结合耐冷菌和乳酸菌计数,发现两种方法结合可以提供互补的结果。因此,本研究采用传统培养方法结合高通量测序技术测定了泡椒凤爪加工过程中微生物数量及群落组成的变化情况,确定其加工过程中的主要污染及微生物组成变化情况,旨在为泡椒凤爪加工过程中微生物污染防控和品质及安全性提升提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
泡椒凤爪不同加工阶段的样品来自湖南某食品企业生产车间,其加工阶段主要包括解冻、切分、漂洗、煮制、泡制、真空包装、辐照杀菌。采集同一批次生产过程中各个步骤的样品装至透明PE 袋中,置于含有冰袋的泡沫采样箱中低温运回实验室,部分样品直接用于菌落总数测定,部分样品加入适量无菌水混合均匀并使用孔径为0.22 μm 的水系滤膜进行过滤,过滤后将滤膜装入已灭菌的50 mL 离心管中,置于-20 ℃冰箱保藏待高通量测序分析。

表1 泡椒凤爪样品信息表Table 1 Chicken feet with pickled peppers sample information sheet

图1 泡椒凤爪的主要制作流程Fig.1 The main production process of chicken feet with pickled peppers
1.1.2 主要试剂
平板计数琼脂(PCA),广东环凯微生物科技有限公司;氯化钠,分析纯,国药集团化学试剂有限公司;Pusion Hot start flex 2X Master Mix,上海仪涛生物仪器有限公司;DL2000 DNA Maker,Takara;Gene colour,北京金博益生物技术有限公司;Qubit dsDNA HS Assay Kit,Invitrogen,Life technologies;Biowest Agarose G-10,BIOWEST;生工50×TAE Buffer,上海生工生物工程股份有限公司;AxyPrep PCR Cleanup Kit,AXYGEN,Life Science Research;Stool DNA Kit,OMEGA biotek。
1.2 仪器与设备
LDZX-50 KBS 型立式高压蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-1FD 型无菌操作台,苏州净化设备有限公司;SPX-250BⅢ型恒温培养箱,天津泰斯特仪器有限公司;DW-HL388 型超低温冷冻储存箱,中科美菱低温科技有限责任公司;Centrifuge 5424 型常温离心机,Eppendorf;Microfuge R 22R Centrifuge 冷冻离心机,上海鹏仪电子科技有限公司;WH-861 型旋涡振荡仪,太仓华利达实验室设备公司;DK-8D 型三温三控恒温水浴锅,上海博迅实业有限公司;A200型PCR 仪,杭州朗基科学仪器有限公司;MiSeq 测序仪,Illumina 公司;Tanon EPS300 型电泳仪、Tanon-2500型凝胶成像仪,上海天能公司。
1.3 试验方法
1.3.1 菌落总数测定
参照GB 4789.2-2016《食品安全国家标准-食品微生物学检验菌落总数测定》进行测定。
1.3.2 总DNA 的提取
采用E.Z.N.A.Soil DNA Kit 试剂盒提取泡椒凤爪样品中细菌总DNA。并通过琼脂糖凝胶电泳检测DNA 质量,同时用紫外分光光度计对DNA 进行定量。
1.3.3 PCR 扩增
利用16S rDNA V3~V4 区引物341F~805R 进行扩增。PCR 扩增体系总体积为25 μL,其中包含25 ng模板DNA,2×Taq master Mix 12.5 μL,上下游引物各2.5 μL,ddH2O 补齐至25 μL。PCR 扩增条件为:98 ℃预变性30 s;98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸45 s,32 个循环,72 ℃延伸10 min,4 ℃保存。取PCR 产物10 μL 用2%琼脂糖凝胶电泳进行检测,将检测合格样品送至杭州联川生物技术有限公司进行高通量测序。
1.3.4 数据处理
对下机数据首先根据样品的条形码(Barcode)信息对数据进行拆分,再根据双端序列的重叠(Overlap)关系,将序列拼接成长的tags,并将序列上建库引入的Barcode 和引物序列去除。使用Vsearch(V2.3.4)软件过滤掉质量值低的序列以及嵌合体序列[13],再将具有97%以上相似性的序列分配给相同的可操作分类单元(Operational Taxonomic Units,OUT)。每个OTU 选择代表性序列,然后使用核糖体数据库项目(Ribosomal Database Project,RDP)分类器将数据归类到每个代表性序列[14]。利用MAFFT(V7.310)软件对不同类群优势种群的差异进行多序列比对,研究不同OTU 间的系统发育关系。以Chao1、Shannon、Simpson 和Observed OTUs 为指标,用QIIME(1.8.0 版)计算了所有样品的各项指标并进行聚类,再通过Alpha 及Beta 多样性分析单个样本中物种的多样性以及样本间菌群结构之间的差异[15,16],根据每个OTU 代表序列与RDP 数据库和Unite 数据库的比对,得到各个样本所有OTU 的物种注释,对OTU 进行物种分类统计后获得门水平和属水平上的物种丰度表。
1.4 数据分析
使用Excel 对数据进行处理及柱状图绘制,使用在线网址 https://www.omicstudio.cn/tool 上的OmicStudio 工具进行PCA 图绘制。
2 结果与分析
2.1 泡椒凤爪不同加工过程菌落总数的变化
表2 为不同加工过程泡椒凤爪菌落总数的变化情况,解冻前后凤爪原料中就有一定数量的细菌,达103~104。将凤爪原料经过切分后(Y5),其细菌总数较解冻后(Y3、Y4)增加,达2.20×104CFU/g,凤爪原料受污染较重[17]。漂洗后的凤爪(Y6)中微生物数量降低至1.63×104CFU/g,说明漂洗对凤爪中的微生物具有一定的清洁作用但效果不显著。经过煮制工序(Y7)后,由于热处理对微生物杀灭有效果,微生物数量下降明显,降低至<10 CFU/g。在后续的泡制(Y8)和真空包装(Y9)工序微生物防控效果较好,微生物数量依然保持在较低水平。
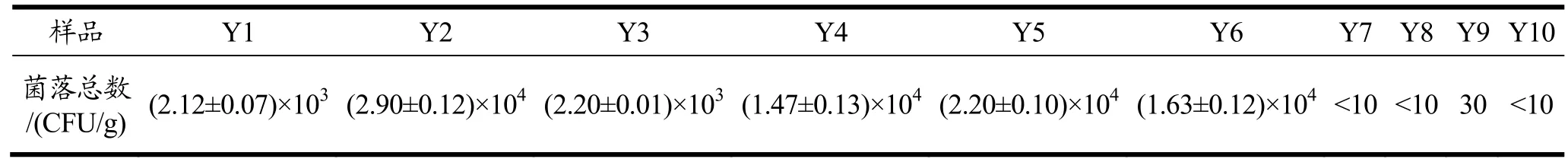
表2 不同加工过程泡椒凤爪样品菌落总数变化Table 2 Changes of total number of bacteria in Chicken Feet with Pickled Peppers samples during different processing processes
2.2 泡椒凤爪不同加工过程的clean data
为了明确泡椒凤爪加工过程中主要细菌污染情况,对泡椒凤爪各加工工序样品进行了细菌高通量测序分析。由表3 可知,将原始数据进行拼接、质控和过滤之后,所有样品最终均得到70 000 个以上有效序列,且Q20 值均大于95%,Q30 值均大于90%,说明测序结果质量高,达到了16s rDNA 分析测试的要求。
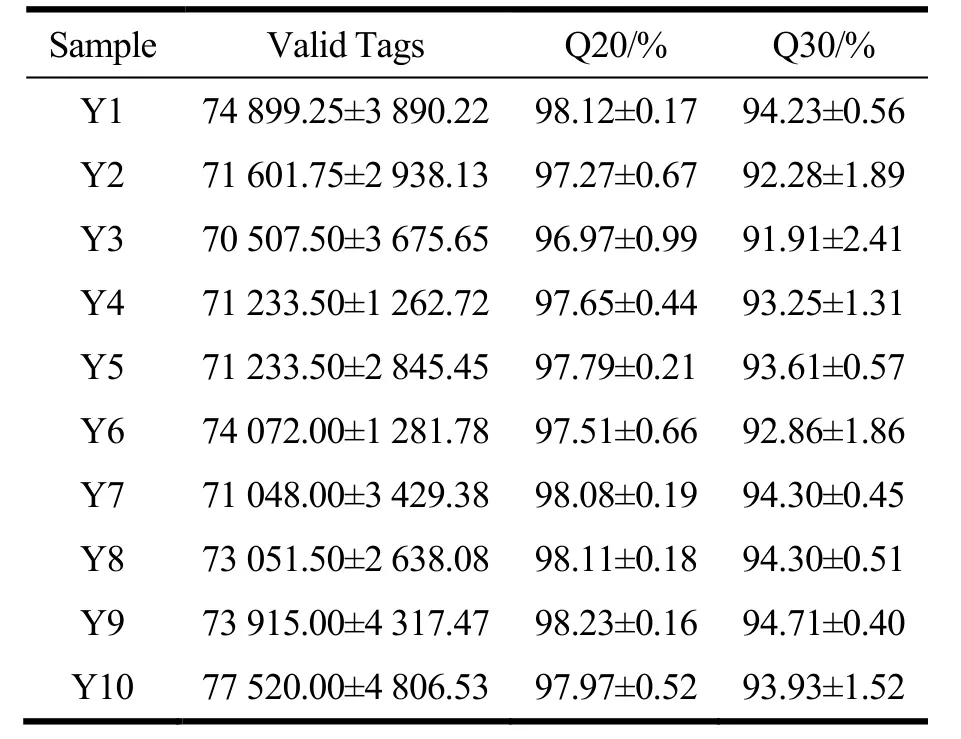
表3 不同加工过程泡椒凤爪clean dataTable 3 Clean data of chicken feet with pickled peppers during different processing processes
2.3 泡椒凤爪不同加工步骤细菌α多样性分析
α多样性可以反映样品中物种组成的丰富度和多样性。通常,Observed OTUs 和Chao1 用来反映物种丰富度[18],而Simpson 和Shannon 主要反映物种多样性。由表4 可知,所有样品的Goods coverage 均达0.99 以上,说明本次检测基本可以真实反映样品中微生物群落的多样性情况。Y10(辐照)和Y7(煮制)被检测到Observed OTUs 和Chao1 值最低,反映其群落中包含的物种数目较少,说明煮制和辐照的杀菌工序均能有效杀灭泡椒凤爪中存在的部分微生物。而Y9(真空包装)被检测到Shannon 和Simpson 值最高,微生物多样性最高,可能是真空包装袋等给样品带来了一定的污染。

表4 不同加工过程泡椒凤爪细菌α 多样性Table 4 α diversity of bacteria from Chicken Feet with Pickled Peppers during different processing processes
2.4 泡椒凤爪不同加工过程细菌β多样性分析
主成分分析(Principal Component Analysis,PCA)可以用来直观地分析样品之间的差异。如图2 所示,Y1(冻凤爪)、Y7(煮制)、Y8(泡制)、Y9(真空包装)、Y10(辐照后成品)的组内样本较为分散,但组间距离较近且有一定的重叠,说明这五个工序细菌群落组成相似。而Y2(冻鸡脚杆)、Y3(解冻凤爪)、Y4(解冻鸡脚杆)、Y5(切分)、Y6(漂洗)五个工序的样品间细菌群落结构较相似,且与煮制工序后(Y7、Y8、Y9、Y10)的细菌群落组成结构有一定的差异。可能是因为Y7(煮制)工序除去了大部分Y3(解冻)~Y6(漂洗)工序中的污染微生物,而凤爪原料(Y1)中存在的微生物比较耐高温,导致Y7(煮制)工序后微生物群落结构与凤爪原料中相似。

图2 泡椒凤爪不同加工过程细菌组成PCA 分析Fig.2 PCA analysis of bacterial composition in different processing processes of chicken feet with pickled peppers
2.5 泡椒凤爪不同加工步骤细菌群落组成变化
Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门)是泡椒凤爪加工过程中的优势菌门,其次为Actinobacteria(放线菌门)和Chloroflexi(绿弯菌门)等(图3)。其中Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门)在多种肉制品中被检测到为优势菌门[17,19,20]。Proteobacteria(变形菌门)是泡椒凤爪所有工序样品中最优势的菌门(33.78%~87.34%),Y5(切分)中变形菌门相对丰度最高(87.34%),这可能是切分的仪器导致变形菌门细菌污染。Firmicutes(厚壁菌门)在Y8(泡制)工序中相对丰度增加(29.74%),说明泡制的卤水带来了厚壁菌门细菌污染,而经Y10(辐照后成品)工序后其相对丰度达到最高(33.53%),可能是由于厚壁菌门细菌较耐受辐照。Bacteroidetes(拟杆菌门)可能不耐受高温,其在Y1(冻凤爪)中相对丰度最高(30.78%),而经Y7(煮制)后其相对丰度显著降低。

图3 泡椒凤爪不同加工过程门水平细菌相对丰度变化Fig.3 Changes of phylum bacterial relative abundance during different processing processes of Chicken Feet with Pickled Peppers
图4 为泡椒凤爪不同工序样品中细菌在属水平上的分布,Acinetobacter(不动杆菌属)、Pseudomonas(假单胞菌属)、Psychrobacter(嗜冷杆菌属)等是样品最优势的菌属,平均相对丰度分别为21.50%、9.29%、5.99%。在Y7(煮制)工序前的鲜凤爪中,Acinetobacter(不动杆菌属)、Pseudomonas(假单胞菌属)和Psychrobacter(嗜冷杆菌属)是相对丰度最高的三种菌属。这三种菌属在多种鲜肉制品中被检测到为优势菌属[17,21-23],与本研究结果一致。Acinetobacter(不动杆菌属)在Y2(冻鸡脚杆)~Y6(漂洗)样品中被检测到相对丰度较高(23.44%~62.15%),在Y5(切分)工序中达到最高(62.15%),可能是由于切分仪器的道具、传送带等一直接触新鲜凤爪导致不动杆菌属细菌的积累和增殖,使切分后的凤爪受到仪器上不动杆菌属的污染,相对丰度增加。Pseudomonas(假单胞菌属)常与食品腐败有关[22,24],可导致蛋白质和脂肪分解[25,26],在Y2(冻鸡脚杆)~Y6(漂洗)工序中相对丰度较高(10.87%~30.80%),而Y7(煮制)工序能有效降低其相对丰度。Psychrobacter(嗜冷杆菌属)在Y2(冻鸡脚杆)中相对丰度最高(28.15%),它是多种低温贮藏食品中的优势腐败菌[27,28],经过Y7(煮制)工序后其相对丰度迅速降低(0.47%)。

图4 泡椒凤爪不同加工过程属水平细菌相对丰度变化Fig.4 Changes of genus bacterial relative abundance during different processing processes of chicken feet with pickled peppers
冻凤爪原料中(Y1、Y2)相对丰度较高的菌属为Acinetobacter(不动杆菌属)、Pseudomonas(假单胞菌属)、Psychrobacter(嗜冷杆菌属)和Soonwooa,它们都不是鸡肠道或粪便中检测到的优势菌属[29],说明凤爪原料中的微生物污染不源于鸡粪便,可能来源于宰杀的环境、工作人员、设备刀具或冷冻运输过程中的污染。此外,Y10(辐照后成品)中相对丰度较高的Acinetobacter(不动杆菌属)(3.23%)、Serratia(沙雷氏菌属)(4.86%)、Staphylococcus(葡萄球菌属)(6.26%)和Bacillus(芽孢杆菌属)(4.59%)等都具有一定的产蛋白酶和脂肪酶的能力[30-32],容易导致肉类食品的腐败变质。有研究表明,革兰氏阳性菌比革兰氏阴性菌更耐辐照[33],Bacillus(芽孢杆菌属)、Acinetobacter(不动杆菌属)、Staphylococcus(葡萄球菌属)等是辐照后无菌袋样品中存在的耐辐照的微生物[34],且辐照效果受辐照剂量及季节(温度)的影响[35],因此探究更合适的方法对泡椒凤爪中耐辐照微生物进行防控才能预防产品在贮藏及销售过程中的腐败变质。虽然可培养结果显示Y10(辐照后成品)中菌落总数<10 CFU/g,但Y10(辐照后成品)中检测到相对丰度较高的Serratia(沙雷氏菌属)、Staphylococcus(葡萄球菌属)和Bacillus(芽孢杆菌属),这些菌属中包含部分致病菌株。因此在后续研究中还需考虑对Y10(辐照后成品)进行致病菌株纯培养检测,以保障产品的安全性。
3 结论
本研究利用传统培养方法及高通量测序法探究了泡椒凤爪解冻、切分、漂洗、煮制、泡制、真空包装和辐照工序中的细菌污染情况。由两种方法的分析结果可知,Y5(切分)是其主要污染环节,菌落总数增加至2.20×104CFU/g,而Y7(煮制)和Y10(辐照)工序能有效降低泡椒凤爪中微生物的数量(<10 CFU/g),达到一定的杀菌效果。Acinetobacter(不动杆菌属)、Pseudomonas(假单胞菌属)、Psychrobacter(嗜冷杆菌属)等为所有工序样品中最主要的微生物菌属。然而,经过煮制及辐照两次杀菌工艺后,在Y10(辐照后成品)中依然检测到一定丰度的Acinetobacter(不动杆菌属)(3.23%)、Serratia(沙雷氏菌属)(4.86%)、Staphylococcus(葡萄球菌属)(6.26%)和Bacillus(芽孢杆菌属)(4.59%)等。这些产蛋白酶及脂肪酶的微生物是肉制品中常见的优势腐败微生物,且可能包含部分致病菌株,会给泡椒凤爪产品带来一定的质量及安全问题。因此在生产过程中可以考虑改变辐照剂量和时间,或调整防腐剂的用量或种类来抑制耐高温及耐辐照的腐败微生物,从而保障产品在贮藏及销售过程中的质量及安全性。目前国内外有关泡椒凤爪产品中腐败微生物的研究还较少,明确导致产品腐败等问题的微生物及其相关防控方法还有待进一步探究。

