儿童配方奶粉对Caco-2 细胞钙转运及对成骨细胞增殖、矿化的影响
何泽琪,林倩如,黄文,刘果,2,贺丽苹,苗建银,曹庸*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东省天然活性物工程技术研究中心,广东广州 510642)(2.华南农业大学园艺学院,广东广州 510642)
钙是人体中最丰富的矿物质,在骨骼形成、肌肉收缩、心脏功能、神经和大脑思维活动中起重要作用[1]。世界上多数国家都存在儿童低钙摄入问题,由于膳食结构、食品来源、多谷物饮食习惯等的影响,目前我国儿童的膳食钙摄入量对于其生长发育和获得最佳峰值骨量是不够的[2]。研究早已证明儿童低钙期摄入可导致低骨量和骨生长迟缓,严重的可导致缺钙性佝偻病[3]。再加上我国儿童蔬菜摄入比例高,植酸及纤维素摄入量大,使得儿童钙吸收利用变得更加困难[2]。同时,国外大量研究均表明,补充钙剂可促进骨矿沉积,并在受到胞外基质的刺激和成骨生长因子的作用后,可以加速分化进程、不断产生和分泌胞外基质蛋白,释放碱性磷酸酶等,加速矿物沉积,产生新骨[4]。而在年幼时最大限度地增加骨量,可以使骨矿含量显提高,还可以有效减少由于年龄增加所引发得骨量丢失[5]。
奶粉作为婴幼儿的主要摄入食品之一,提供给婴幼儿日常所需营养,对婴幼儿个体发育至关重要。奶粉中含有多种蛋白,对婴幼儿骨骼发育影响显著。Caco-2 细胞系自发分化表现出人类小肠上皮细胞的典型结构和功能特征[6],Caco-2 小肠上皮细胞模型被广泛应用模拟食品、药物吸收研究。成骨细胞是骨组织中形成新骨的功能细胞,受到刺激或生长因子作用后,可加速分化进程,产生新骨,还可以通过产生骨保护素,促进骨形成[4,7]。目前,利用Caco-2 和成骨细胞模型评价成品配方奶粉促钙转运及对骨骼健康的研究较少。故本研究拟利用Caco-2 小肠上皮细胞和MC3T3-E1 成骨细胞两种模型,系统评价某种市售儿童配方奶粉促进钙吸收的作用。
1 材料与方法
1.1 实验材料与设备
1.1.1 主要实验试剂
Caco-2 细胞购自中国科学院上海生物科学研究所细胞资源中心;MC3T3-E1 成骨细胞购自中国科学院上海生物科学研究所细胞资源中心;胎牛血清、MEM 培养基、MEM-α培养基、青霉素、链霉素、0.25%体积分数胰蛋白酶、Glutamax、非必需氨基酸、丙酮酸钠,均购自Gibco 公司,盐酸、硝酸等其他试剂均为分析纯。
1.1.2 主要实验材料
某品牌儿童成长配方奶粉(ZHG),主要配料:全脂奶粉、脱盐乳清粉、脱脂奶粉等;市售纯牛奶A,主要配料:生牛乳。以上两种产品均购自当地市场。
1.1.3 主要仪器与设备
超净工作台、二氧化碳培养箱,Esco;喷雾干燥,无锡市现代喷雾干燥设备有限公司;酶标仪,Enspire;Millicell ERS-2 细胞电阻仪;Wahli 火焰原子吸收光谱仪。
1.2 实验方法
1.2.1 样品制备
实验选择国内市场最广泛销售的乳业品牌,并选取其中最畅销的产品市售纯牛奶A 作为对照。为确保细胞实验上样量一致,对市售纯牛奶A 进行喷雾干燥处理,喷雾干燥条件为进风温度180 ℃,出风温度90 ℃,雾化器40 Hz,恒流泵50 r/min。市售纯牛奶A粉剂保藏于4 ℃,直至开展实验。
1.2.2 钙转运实验
1.2.2.1 Caco-2 单层细胞模型的建立
选择30~60代的Caco-2细胞建立小肠上皮单层细胞模型。根据中科院细胞库推荐配方,细胞完全培养基配方为77% MEM,20%胎牛血清,1%双抗,1%Glutamax,1%非必需氨基酸和1%丙酮酸钠(比例均为体积分数),培养环境为37 ℃,体积分数5%的CO2浓度。待细胞长至80%时,以每毫升2×105个的密度,将细胞接种至12 孔transwell 转运板上层的小室中,上层培养基体积为0.5 mL,并在下层补充1.5 mL 完全培养基。培养21 d,每2 d 换液直至细胞形成完整的膜。通过跨膜电阻的检测来确定细胞单层的完整性,当电阻超过500 Ω·cm2时,将单层膜用于转运实验。
1.2.2.2 钙转运测定
采用本实验室前期已报道的方法[8]进行钙转运量的测定,并根据具体实验情况稍作修改。Caco-2 细胞培养21 d 后弃去培养基,单层细胞立即用37 ℃的HBSS(不含钙和镁)清洗两次,然后转移至新的12孔板中,与HBSS 在培养箱中共孵育30 min。将不同浓度预先混合好的样品加至transwell 小室上层,儿童配方奶粉加钙螯合物(每孔分别加50、100、150 μg样品与150 μg 钙混合)、纯牛奶A 粉剂加钙螯合物(每孔100 μg 样品与150 μg 钙混合)、CaCl2(每孔150 μg)。在不同的时间点(60、90、120 min),从下层小室收集0.5 mL HBSS 缓冲液以测量钙离子浓度,同时补充0.5 mL 新鲜的HBSS 缓冲液以保持恒定体积。每个时间点的钙浓度使用火焰原子吸收检测。每个孔的钙含量按以下公式计算:
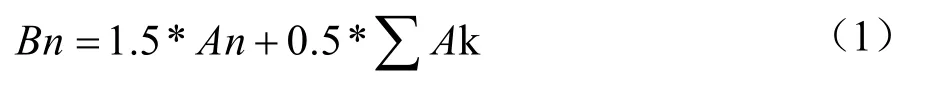
式中:
Bn——在各时间点(60、90、120 min)每孔下层1.5 mL HBSS 缓冲液中钙含量,μg/孔;
1.5——一个常数,代表基底外侧的1.5 mL HBSS 缓冲液每个孔;
An——在不同时间点在每个孔下层HBSS 的钙离子浓度,原子吸收测定,μg/mL;
0.5——一个常数,代表从基底外侧收集的0.5 mL HBSS缓冲液;
n——自变量,对于本研究,它可以是1、2、3,分别代表时间点60、90 和120 min。
火焰原子吸收光谱法测定钙离子含量的具体流程同《GB 5009.92-2016 食品安全国家标准食品中钙的测定》中的火焰原子吸收光谱法,选用王水消解法消解样品,王水与样品体积比为1:1。
1.2.3 成骨细胞实验
购买成骨细胞后,按细胞培养指引对细胞进行复苏、培养、传代。培养基配方为85%α-MEM 培养基,10%胎牛血清,1%双抗(比例均为体积分数)。考察样品对成骨细胞毒性,筛选适合浓度,进一步考察其对成骨细胞增殖、碱性磷酸酶分泌及矿化的影响。
1.2.3.1 细胞毒性
取第3 代对数生长期的MC3T3-E1 细胞,以每毫升5×104个的密度接种于96 孔板,每组6 复孔,每孔100 μL 完全培养液。待细胞完全贴壁后,去除培养基,分别加入100 μL 含有5、10、50、100、200、500 μg/mL样品的完全培养基;在培养24 h 后每孔加入100 μL MTT(0.5 mg/mL),37 ℃避光孵育4 h,孵育完成后终止培养,小心吸去上清培养液,每孔加入150 μL 二甲基亚砜,置摇床上低速振荡5 min,使结晶物充分溶解。在酶联免疫检测仪570 nm 处测量各孔的吸光光度值。
1.2.3.2 细胞增殖
取第3 代对数生长期的MC3T3-E1 细胞,以每毫升3×104个的密度接种于96 孔板,每组6 复孔,每孔100 μL 完全培养液。待细胞完全贴壁后,去除培养基,分别加入100 μL 含有5、10、50 μg/mL 样品的完全培养基;在培养72 h后每孔加入20 μL MTT(0.5 mg/mL),37 ℃避光孵育4 h,孵育完成后终止培养,小心吸去上清培养液,每孔加入150 μL 二甲基亚砜,置摇床上低速振荡5 min,使结晶物充分溶解。在酶联免疫检测仪570 nm 处测量各孔的吸光光度值。
1.2.3.3 碱性磷酸酶含量测定
取对数生长期的MC3T3-E1 细胞,以每毫升2×106个的密度接种于6 孔板,每组4 复孔,每孔2 mL 完全培养液。第二天小心除去培养基,分别加入2 mL 含有5、10、50 μg/mL 样品的诱导培养基;隔天换液。第7 天,小心除去培养基,并用4 ℃预冷的PBS 清洗细胞3 次,用细胞刮刀收集细胞后,使用超声破碎仪裂解细胞(功率300 W,冰水浴,每3~5 s 超声1 次,间隔4 次,间隔时间30 s)。BCA 法测定蛋白含量,试剂盒定量,后使用碱性磷酸酶试剂盒测定碱性磷酸酶含量。
1.2.3.4 成骨细胞矿化实验
取生长状态良好的MC3T3-E1 细胞,用体积分数0.25%胰酶及体积分数0.02% EDTA 消化,制成密度为每毫升1×106个的细胞悬液,接种于6 孔细胞培养板,每孔接种完全培养基2 mL,第二天小心除去培养基,分别加入2 mL 含有5、10、50 μg/mL 样品的诱导培养基,隔天换液。21 d 后进行茜素红染色。除去培养基,以4 ℃预冷的PBS 缓冲液小心漂洗2 次;注意不要把矿化结节吸掉。预冷的体积分数4%多聚甲醛室温条件下固定15 min,去离子水充分冲洗;体积分数1%茜素红染液室温染色15 min,使用蒸馏水洗去染液,并用蒸馏水反复冲洗,直至洗液透明。风干后在倒置显微镜下观察钙结节形成情况并拍照。最后,分别添加1 mL 100 mmol/L 西吡氯铵溶液,室温放置1 h,使与钙结合的茜素红充分溶液,用酶标仪测570 nm 处溶液的吸光值,对矿化结晶进行定量。
1.3 数据统计分析
所有试验均重复3 次,使用SPSS 23.0 软件和Prism 8.4.0 进行数据统计和显著性分析,数据表示为平均值±标准差(SD),p<0.05 被认为具有显著差异。并使用Prism 8.4.0 及Origin 2018 制作图表。
2 结果与分析
2.1 钙转运实验
Caco-2 单层模型被广泛运用于模拟物质吸收。将不同浓度的奶粉与钙混合物添加到transwell 小室上层,并测定下层中钙的含量,将150 μg/mL 的CaCl2(与样品组含钙量相同)作为对照。Caco-2 单层细胞模型的钙转运实验结果如图1 所示。由图1 可知,随着转运时间的延长,CaCl2组和样品组的钙转运含量均有增加。转运60 min 时,儿童配方奶粉低剂量样品组(50 μg/mL)效果最佳,下层接收液钙离子浓度为1.09 μg/well,而中剂量组和高剂量组转运的钙离子浓度依次下降,分别为每孔0.93 μg 和每孔0.83 μg。所有剂量儿童配方奶粉的钙转运量均大于纯牛奶A粉剂的钙离子转运浓度0.82 μg/well,说明60 min 时儿童配方奶粉的钙离子转运能力优于纯牛奶A 粉剂,但各样品钙转运量与空白对照组钙含量0.89 μg/well 相比,均无显著性差异(p>0.05)。转运90 min 时,儿童配方奶粉中剂量样品组(100 μg/mL)钙转运效果最佳,下层接收液钙离子浓度为每孔1.38 μg,其次为高剂量组的每孔1.36 μg 和低剂量组的每孔1.32 μg。同样,90 min 时儿童配方奶粉各剂量组的钙离子转运能力优于纯牛奶A 粉剂(每孔1.27 μg),但与空白对照组相比均无显著性差异(p>0.05)。转运120 min 时,下层接收液钙离子含量从高到低分别为儿童配方奶粉中剂量样品组每孔1.46 μg,低剂量样品组每孔1.46 μg,高剂量样品组和纯牛奶A 粉剂每孔1.39 μg,所有样品组钙离子转运含量与空白对照组(每孔1.30 μg)相比依旧无显著性差异(p>0.05)。
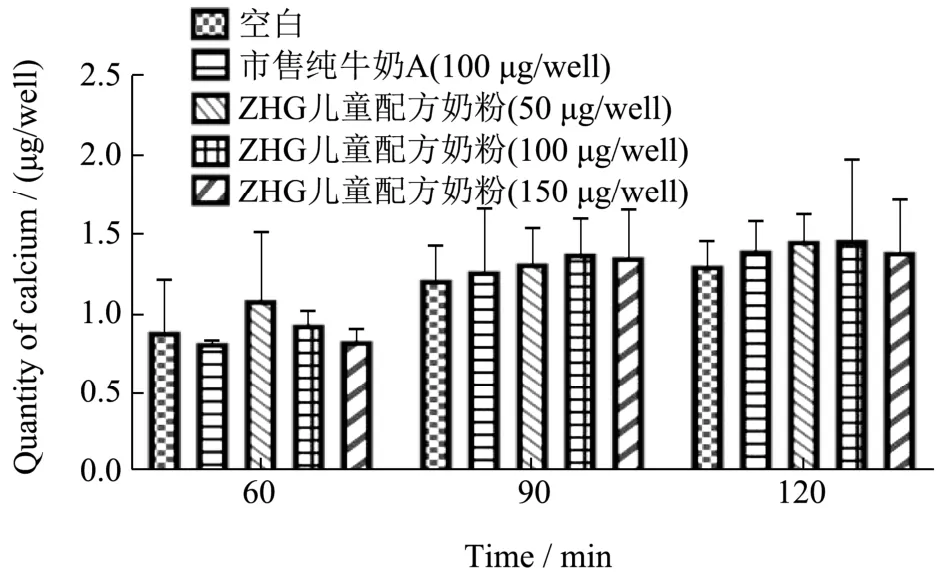
图1 儿童配方奶粉与市售纯牛奶A 对各时间段Caco-2 细胞钙离子转运量的影响Fig.1 Effect of children's formula and commercially available pure milk A on calcium ion transport in Caco-2 cells at various time
根据Caco-2 钙离子转运实验结果,儿童配方奶粉钙离子转运能力优于纯牛奶 A 粉剂,但转运60~120 min 间与同时空白对照组相比,各剂量下层接收液钙离子含量没有显著性差异。对比其他牛乳促钙吸收物质,相同钙离子添加剂量和转运时间下,文献中牛乳酪蛋白促钙吸收肽转运时间为120 min 时,下层钙离子浓度为每孔30~50 μg,较空白对照(<10 μg每孔)显著提高[8]。综上所述,儿童配方奶粉不具有促进钙离子转运的能力。牛乳中的多肽常被发现具有促进钙转运的活性[9,10]。这可能是由于牛乳多肽,促钙吸收肽通过与钙通道TRPV6 的相互作用调节Caco-2 细胞中的钙摄取[11],也可能由于促钙吸收肽刺激细胞因子IL-6 的分泌[11],也可能是由于样品中促进钙离子转运的有效成分含量差异。
2.2 成骨细胞毒性实验
MTT 比色法是一种检测细胞存活和生长的方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性 MTT 还原为水不溶性的蓝紫色结晶甲臜(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲臜,用酶联免疫检测仪在570 nm 波长处测定其光吸收值,可间接反映活细胞数量。在不同浓度的奶粉作用下,成骨细胞的MTT 毒性实验结果如图2 所示,儿童配方奶粉的加样量为5、10、50 μg/mL 时,与对照组比较,成骨细胞的存活率达到102.00%~107.64%,生长状态良好,对细胞无毒害作用。故选择5、10、50 μg/mL作为后续实验样品的低、中、高浓度添加量。
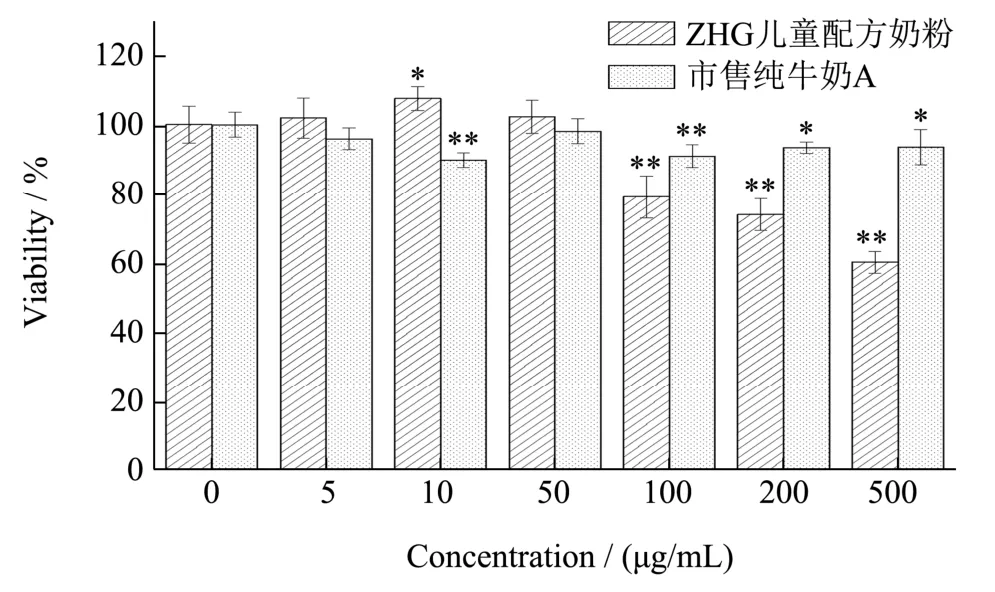
图2 儿童配方奶粉和市售纯牛奶A 对成骨细胞的毒性作用Fig.2 Toxic effects of children's formula and commercially available pure milk A on osteoblasts
2.3 样品对成骨细胞增殖的影响
细胞增殖也使用MTT 法。在不同质量浓度的儿童配方奶粉和市售纯牛奶A 作用下,成骨细胞的MTT实验结果如图3 所示,在5、10、50 μg/mL 质量浓度下,儿童配方奶粉和市售纯牛奶A 对成骨细胞都有促进增殖作用,其中儿童配方奶粉组的增殖速度均在25%以上,且在低浓度时已到达最高值,为31.16%;而市售纯牛奶A 组的增殖速度为10%~15%。相同浓度下,儿童配方奶粉促进成骨细胞增殖速度是市售纯牛奶A 的1.70~3.00 倍,说明儿童配方奶粉在促进成骨细胞增殖上优于市售纯牛奶A。
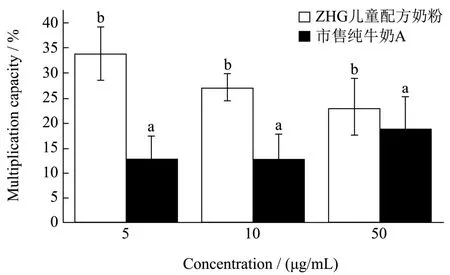
图3 儿童配方奶粉和市售纯牛奶A 对成骨细胞增殖的影响(显著性差异p<0.05)Fig.3 Effect of children's formula and commercially available pure milk A on osteoblast proliferation
2.4 样品对成骨细胞碱性磷酸酶(ALP)活性的影响
碱性磷酸酶是成骨细胞胞外基质形成的关键酶,具有磷酸酯酶活性,可以水解天然存在的含磷底物,释放游离磷酸根离子,参与胞外基质的矿化沉积。如图4 所示,在5、10、50 μg/mL 质量浓度下,儿童配方奶粉能够显著或极显著提高成骨细胞的碱性磷酸酶活性,且呈现浓度依赖,50 μg/mL 质量浓度时达到7.79 U/g 蛋白;市售纯牛奶A 作用质量浓度为,在5 μg/mL 时,对成骨细胞碱性磷酸酶的活性无显著性影响,质量浓度提高至10 μg/mL 时极显著提高酶活性,达到7.71 U/g 蛋白,但在50 μg/mL 时效果降低至5.83 U/g 蛋白。综合实验结果,儿童配方奶粉和市售纯牛奶A 都对碱性磷酸酶活性有积极影响,且儿童配方奶粉的效果在5~50 μg/mL 质量浓度范围内更加稳定。
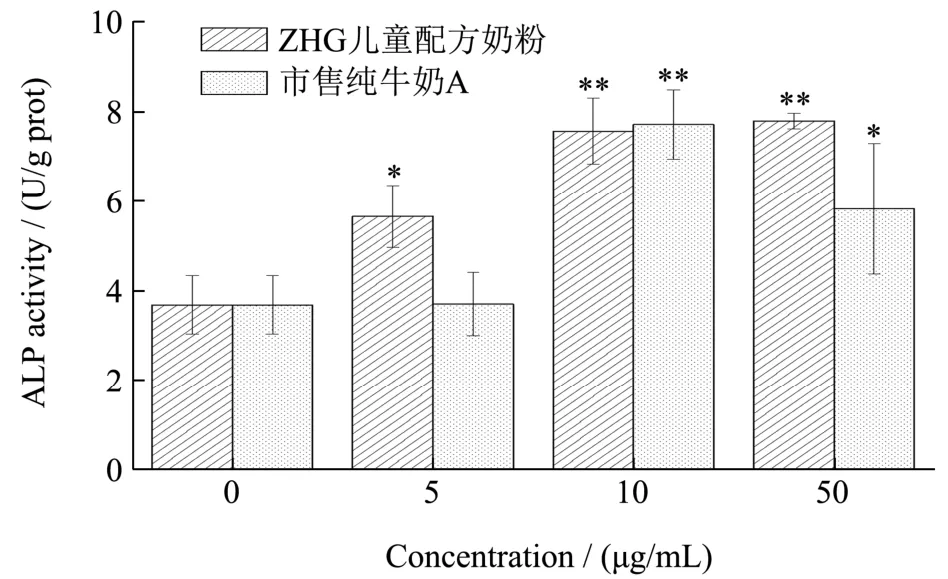
图4 儿童配方奶粉和市售纯牛奶A对成骨细胞碱性磷酸酶活性的影响Fig.4 Effect of children's formula and commercially available pure milk A on alkaline phosphatase activity in osteoblasts
2.5 样品对成骨细胞矿化的影响
茜素红染色的原理是茜素红会和钙发生显色反应,产生一种深红色的化合物。诱导后的成骨细胞,其外面沉积的钙结节会被染成深红色。而西吡氯铵能够溶解茜素红显色,利用这一特性对矿化结晶进行定量分析。将培养了21 d 后的成骨细胞进行染色,显微镜下观察不同浓度样品培养后的成骨细胞(图5)。发现与对照组比较,儿童配方奶粉和市售纯牛奶A 作用的成骨细胞有明显的矿化结节产生,形状多呈圆形或椭圆形,少数呈不规则形,而空白对照组结节较少。矿化结节与茜素红染液结合成深红色物质,表明儿童配方奶粉和市售纯牛奶A 能够促进成骨细胞矿化。进一步利用西吡氯铵对矿化结节进行定量分析,结果如图6 所示,添加量为5 μg/mL 时,儿童配方奶粉组、市售纯牛奶A 组的吸光值均为0.18,表明矿化结节生成量接近。当添加量增大至10 μg/mL 和50 μg/mL,市售纯牛奶A 组的吸光值分别为0.17、0.15,矿化量稍有降低,而儿童配方奶粉组的吸光值均为0.180,促进成骨细胞矿化量随剂量改变无显著变化,相较空白对照组提高50%以上,说明奶粉的作用效果更为稳定。根据实验结果,两种样品在较低浓度下对骨有明显促进作用,但在高浓度下促进作用反而有所下降,与曾祥伟等[12]的研究结果相一致。
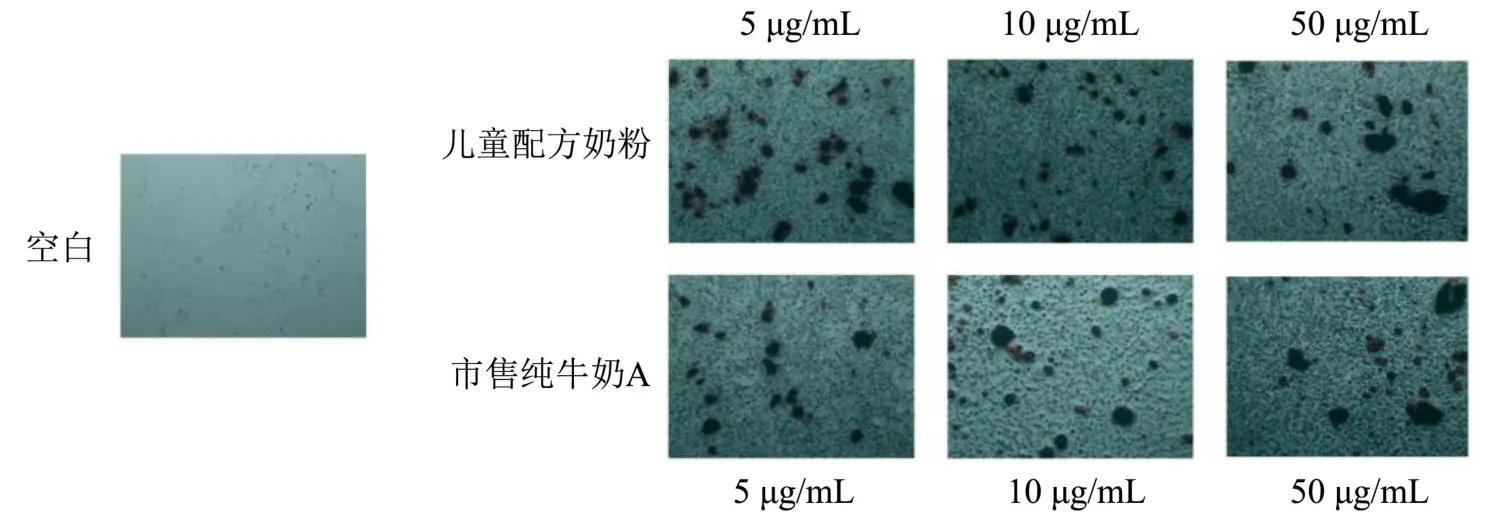
图5 儿童配方奶粉和市售纯牛奶A 对成骨细胞矿化结晶的影响(400×)Fig.5 Effect of children's formula and commercially available pure milk A on mineralized crystals in osteoblasts (400×)
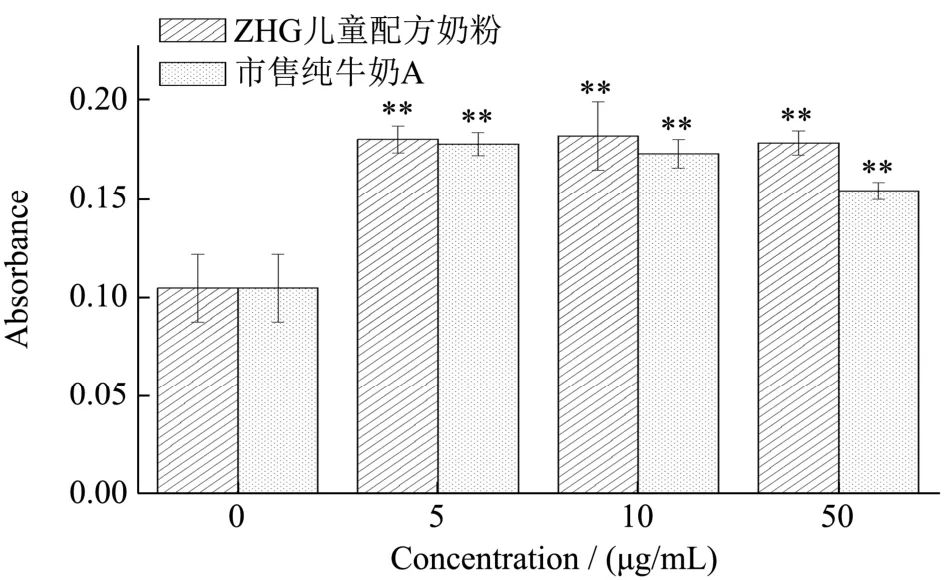
图6 儿童配方奶粉和市售纯牛奶A 对成骨细胞矿化的影响Fig.6 Effect of children's formula and commercially available pure milk A on osteoblast mineralization
MC3T3-E1 细胞是小鼠颅盖骨细胞的前体细胞,具有成骨细胞形成过程中的生物学特性,包括ALP 活性和基质成熟及矿化等,已成为体外研究骨质疏松比较有价值的细胞模型[13]。张伟[5]也发现牛乳具有促骨生长功能,利用成骨细胞模型证明了乳铁蛋白可以有效促进分化标志物碱性磷酸酶活性以及骨钙素的表达,且能提高骨细胞矿化结节的形成,与本研究结果有类似之处。推测儿童配方奶粉中,可能存在有较高活性的促成骨细胞增殖和矿化的物质,因此具有潜在的增强骨硬度,抗骨质疏松或骨质吸收的效果[14]。
3 结论
实验以市售儿童配方奶粉为样品,评价其促进钙离子转运能力及对骨骼健康的作用。发现在体外细胞实验中,儿童配方奶粉虽不能够明显促进钙离子转运,但对成骨细胞增殖和矿化均有正向调节作用,说明其具有潜在的调节儿童骨骼健康作用。

