基于网络药理学和分子对接技术探讨龙胆泻肝汤治疗孤独症谱系障碍的活性成分及作用机制
张梦佳,于娇妍,刘庆庆,李佳敏,王 斌,杨 奇
(1陕西中医药大学药学院,陕西省中医药管理局中药药效机制与物质基础重点研究室,陕西 咸阳 712046;2空军军医大学唐都医院药剂科,陕西 西安 710038)
孤独症谱系障碍(autism spectrum disorder,ASD)是一种神经发育障碍疾病,表现为语言障碍、社交互动障碍和重复运动[1]。近年研究报道表明,ASD的发病率逐渐增加,据美国疾病预防控制中心数据显示,2018年ASD的患病率为1/59,比2014年上升了16%[2-4]。但由于ASD的病因和病理机制尚不清楚,目前尚无明确的药物或手术治疗方法,给个人和家庭带来了较大精神压力和经济负担。因此,国内外在临床上对于ASD的研究越来越多。中医药是我国医学科学的特色,具有丰富的治疗手段且疗效显著,适用范围广泛。近年来,中医治疗ASD的报道越来越多。中医典籍中虽然没有“孤独症谱系障碍”疾病名,但有“呆病”“清狂”“无慧” “五迟”“胎弱”等描述[5]。
中医学上把ASD分为:心肝火旺证、肾精不足证、痰蒙心窍证、心脾两虚证这四大证型。临床上最常见的是心肝火旺证,同时也是ASD最主要的证型。该证型主要位于心肝,也影响肾脾,火与痰是主要的病变原因,心肝火旺、痰热内扰则是主要病机[6]。中药治疗此证采用清心平肝、豁痰开窍、安神定志的方法,大多为口服用药[5]。龙胆泻肝汤是临床常用方剂,来源于《医方集解》,主要成分为龙胆草、柴胡、黄芩、栀子、泽泻、木通、车前子、当归、地黄、甘草,具有泻肝胆实火、清下焦湿热的功效,且免疫调控作用明显,属于中医心肝火旺证治疗范畴。临床应用广泛,效果较好,能显著改善ASD患儿的症状,但龙胆泻肝汤的具体有效成分及药理作用机制尚不清楚[7]。网络药理学是根据系统生物学理论,研究生物活性成分及作用靶点的一种方法。本研究以网络药理学为出发点,从口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL)两个方面来筛选龙胆泻肝汤的已知活性成分,并对龙胆泻肝汤的入血活性成分及作用靶点进行预测。采用蛋白质相互作用(protein-protein interaction,PPI)网络分析预测龙胆泻肝汤治疗ASD的靶点,并通过富集分析讨论可能的分子机制,然后通过分子对接对这些靶点进行初步验证[8]。
1 材料与方法
1.1 材料
中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)数据库(https://tcmspw.com/tcmsp.php);Uniport数据库(https://www.uniprot.org/);GeneCards数据库(https://www.genecards.org/);在线人类孟德尔遗传(Online Mendelian Inheritance in Man,OMIM)数据库(https://www.omim.org/);DisGeNET数据库(https://www.disgenet.org/);STRING 数据库 (https://stringdb.org/);Cytoscape(Version 3.8.0)可视化软件(http://www.cytoscape.org/);Metascape 数据库(http://metascape.org/gp/index.html)。
1.2 方法
1.2.1 龙胆泻肝汤主要活性成分筛选及靶点收集 利用 TCMSP数据库[9]对以下成分:龙胆、柴胡、黄芩、栀子、泽泻、木通、车前子、当归、地黄、甘草进行检索,筛选条件为:OB≥30%,DL≥0.18[10],依次收集主要的DL活性化合物及其对应的靶点信息。将靶点蛋白通过Uniport数据库进行标准化处理,获得靶点蛋白对应的基因名称。
1.2.2 龙胆泻肝汤化合物-靶点网络的构建 为了解龙胆泻肝汤活性成分与其相应靶点之间的复杂关系,我们使用Cytoscape 3.8.0软件构建活性成分-靶点之间的网络图。网络图中用“节点”代表有效活性成分及其作用靶点,用 “边”代表活性成分和作用靶点之间的相互作用关系,最后的可视化网络图由节点和边组成[11]。
1.2.3 ASD靶点的收集 采用GeneCards数据库、OMIM数据库、DisGeNET数据库以“Autism”为关键词进行检索,获取ASD的关键治疗靶点。
1.2.4 获取药物-疾病共表达靶点 将收集到的龙胆泻肝汤治疗靶点和ASD靶点导入 Venny 2.1.0在线平台进行分析,获取药物疾病共同靶点信息。
1.2.5 构建PPI 为了获得蛋白与蛋白之间的相互作用,我们将收集到的药物-疾病共同靶点导入STRING数据库,选择“Multiple proteins”,并将物种选择为“Homo sapiens”,获得蛋白与蛋白之间相互作用的数据,并将参数导入 Cytoscape 3.8.0软件进行可视化分析,绘制PPI 网络图,并利用 CytoHubba 插件进行网络拓扑学分析。
1.2.6 关键靶点的基因本体(Gene Ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析 为了研究龙胆泻肝汤对ASD治疗的潜在分子机制,运用 Metascape 数据库,对上述获得的关键靶点进行GO功能富集分析和KEGG通路分析,GO功能富集分析主要包括以下三个方面:生物过程、细胞组成和分子功能。
1.2.7 核心靶点与龙胆泻肝汤成分的分子对接 为进一步评估龙胆泻肝汤的核心成分与其相应靶点之间预测的相互作用的可靠性,我们通过分子对接将1.2.1中得到的主要活性有效成分与1.2.5中得到的核心靶点进行验证。从PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/) 查询1.2.1 中主要成分结构,对结构进行优化并以SDF 格式保存。从PDB数据库(http://www.wwpdb.org/)中下载核心靶点的三维结构并保存为PDB格式。使用Discovery Studio 2021软件删除蛋白质结构的水分子,加氢,能量优化;小分子配体、活性小分子进行构象和能量优化,再将活性成分和靶蛋白全部转化为PDBQT格式文件。最后,利用Discovery Studio 2021分别对活性成分和靶蛋白进行对接,并将最小结合能量数据保存,视为分子对接结果。结合能越低,说明活性成分与靶蛋白之间的结合能力越强,再用PyMOL进行可视化显示。
2 结果
2.1 利用TCMSP数据库筛选出龙胆泻肝汤的有效成分与靶点
通过 TCMSP 平台检索龙胆、柴胡、黄芩、栀子、泽泻、木通、车前子、当归、地黄、甘草对应的化合物,以 OB≥30%、DL≥0.18 为筛选条件,共收集到化合物成分201 个,其中龙胆10个,柴胡17个,车前子9个,地黄 2个,木通8个,泽泻10个,当归2个,栀子15个,黄芩36个,甘草92个,去重后共179个有效成分,其中有6个为共有成分(表1)。然后依次收集活性化合物及其对应的靶点信息,去重后共得到245个相关靶点,再采用 Uniprot数据库对相关靶点进行规范化处理。
2.2 利用Cytoscape软件构建龙胆泻肝汤主要成分靶点网络
根据2.1中得到的179个有效成分和245个靶点,利用Cytoscape 3.8.0软件构建龙胆泻肝汤“有效成分-靶点”网络,得到410个节点,2 944条边(图1)。一个节点的“度”值,定义为在网络中连接到它的边数,表示网络中该节点的重要性。因此,我们计算了网络图中所有节点的度值,并鉴定出排名前10的成分,包括槲皮素、山柰酚和豆甾醇等。
2.3 利用疾病数据库收集龙胆泻肝汤治疗ASD的潜在靶点
通过GeneCards、DisGeNET和OMIM 3个数据库,以“Autism”为关键词进行检索,去重后得到6 790个ASD治疗相关靶点。采用 Venny 2.1.0 软件对龙胆泻肝汤药物靶点和ASD疾病靶点取交集(图2),获得162个潜在治疗靶点,导入 STRING 数据库绘制PPI网络图(图3)。通过网络拓扑异构学对结果进行分析,并按照degree排名列举出前10的基因(表 2),degree值越大则越说明这些靶蛋白是网络中的关键靶点。
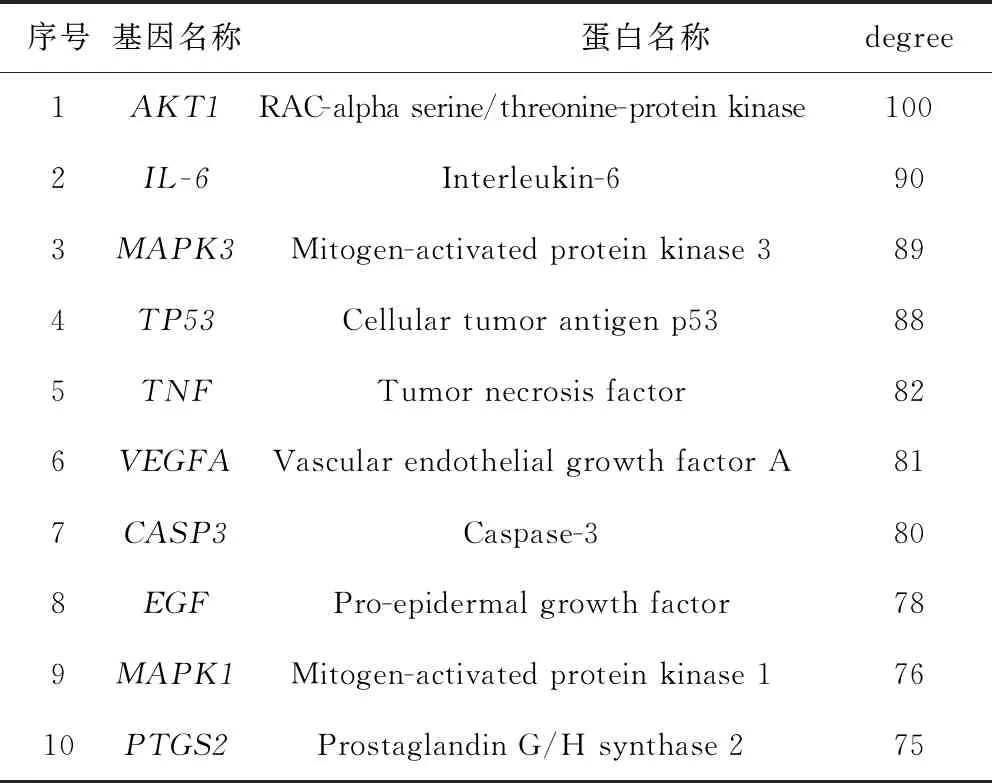
表2 degree排名前10的共表达基因拓扑学分析
2.4 利用Metascape数据库进行GO和 KEGG 通路富集分析预测龙胆泻肝汤治疗ASD的分子机制
将获得的162个龙胆泻肝汤成分和ASD的共同靶点,导入Metascape数据库中,进行GO和KEGG通路富集分析。GO功能富集分析结果显示2 115个生物过程,依照P值大小排名绘制条形图(图4)。这些结果表明龙胆泻肝汤与炎症反应、膜筏、核受体活性等相关。 KEGG信号通路富集分析共得到344个条目,根据P值大小排名绘制气泡图(图5)。这些结果表明龙胆泻肝汤主要与AGE-RAGE信号通路相关。
2.5 利用分子对接预测龙胆泻肝汤成分与核心靶点的关系
选取PPI网络(图3)中degree值排名靠前的疾病相关靶点蛋白(AKT1、IL-6、MAPK3、TP53、TNF、CASP3、PTGS2、CYP2C9),并与药物成分-靶点网络(图1)中排名前10的活性成分进行分子对接。能量越低,则说明配体与受体结合的构象越稳定,且发生相互作用的可能性就越大[12]。结果表明槲皮素与CASP3(结合能37.03 kJ/mol),异鼠李素与TNF(结合能-293.97 kJ/mol),山柰酚与 MAPK3(结合能29.85 kJ/mol)、IL-6(结合能29.39 kJ/mol)、AKT1(结合能28.78 kJ/mol),芒柄花素与TP53(结合能22.60 kJ/mol)、PTGS2(结合能2.85 kJ/mol),豆甾醇与CYP2C9(结合能-46.05 kJ/mol)结合后均有较好的结合活性(图 6)。结果证明,龙胆泻肝汤主要活性成分可通过多个核心靶点如AKT1、IL-6、MAPK3等发挥调控作用。
3 讨论
本文通过TCMSP 数据库收集龙胆泻肝汤化合物成分共179个,对应靶点数为245个,其中与ASD共同靶点有162个。PPI图分析数据显示,包含AKT1、IL-6、MAPK3、TP53、TNF等关键靶点。根据文献报道,AKT参与多种细胞过程,包括蛋白质合成、葡萄糖代谢、细胞迁移和神经可塑性等[12-13]。研究发现丙戊酸钠大鼠模型皮质中AKT及其下游组分磷酸化水平降低,提示ASD发病机制与PI3K-AKT-mTOR信号通路相关[14]。IL-6是最重要的神经免疫因子之一,许多研究显示,ASD患者血浆和脑脊液中IL-6失调[15],导致突触间信号传递不平衡,从而引起ASD样行为的产生。MAPK3基因是ERK信号通路的中心组成部分,对调节细胞生长和增殖具有重要作用[16]。还有研究表明,在ASD的产前丙戊酸钠模型中,神经炎症细胞因子如IL-6、IL-10和TNF-α水平有显著改变[17]。TP53是最早发现的肿瘤抑制基因之一,在细胞生长控制、细胞周期抑制和凋亡过程中发挥关键作用[18]。因此, AKT1、IL-6、MAPK3、TP53、TNF等分子可能是龙胆泻肝汤有效成分治疗ASD的潜在靶点。
通过GO富集分析结果可知,龙胆泻肝汤影响的生物过程包括炎症反应、细胞对有机化合物的反应等,并通过 KEGG 对药物影响的疾病通路进行富集,结果显示其对AGE-RAGE信号通路、癌症通路等有调控作用。有研究表明,AGE-RAGE 可以刺激促炎因子的产生,同时,还可以充当炎症因子来激活先天免疫细胞[19]。而且AGE-RAGE轴的激活可能通过增加脑氧化损伤在ASD的发病机制中发挥作用[20]。由此推测, AGE-RAGE信号通路可能介导龙胆泻肝汤对细胞凋亡、增殖和炎症反应的调节而达到治疗ASD的效果。
利用分子对接的方法对龙胆泻肝汤治疗ASD的机制进行探讨,结果表明,5种最重要的成分(槲皮素、异鼠李素、山柰酚、芒柄花素、豆甾醇)与8种重要的靶蛋白(AKT1、IL-6、MAPK3、TP53、TNF、CASP3、PTGS2、CYP2C9)之间具有良好的结合能力。其中山柰酚与MAPK3、IL-6、AKT1这3种蛋白均有较好的结合性,而且也是龙胆、柴胡和甘草的共有活性成分,说明山柰酚是治疗ASD的关键成分。还有研究显示,产前用槲皮素治疗可以防止氧化应激引起的行为改变和损伤,在自闭症动物模型中具有神经保护作用[21]。所以槲皮素是龙胆泻肝汤治疗ASD的关键有效成分。
综上所述,本研究采用网络药理学与分子对接相结合的方法,从“药物-疾病-靶点”角度探讨龙胆泻肝汤治疗ASD的药效活性成分和分子作用机制,试图找到新的药物和治疗靶点。分析结果表明龙胆泻肝汤中的主要活性成分槲皮素、异鼠李素、山柰酚等可能通过AKT1、IL-6、MAPK3等靶点,作用于AGE-RAGE、PI3K/AKT 等信号通路干预ASD,为龙胆泻肝汤的临床合理应用提供了一定的理论依据。

