JAK2/STAT3信号通路在低温暴露诱导白色/棕色脂肪组织转化中的作用机制
刘春燕,张建彬,薛 冲,沈学锋,阳盛洪,骆文静
(1空军军医大学军事预防医学系军队劳动与环境卫生学教研室,陕西 西安 710032; 2陆军第九四九医院,新疆 阿勒泰 836500)
低温环境广泛存在于自然界中。低温暴露能够影响机体的各个系统,其中机体能量代谢的改变在低温环境中最为显著[1],而机体通过寒颤产热和非寒颤产热来维持体温恒定[2]。寒颤产热仅在短期抗低温中发挥重要作用[3];长期暴露于低温环境,则需要机体进行非寒颤产热。研究表明,在低温环境中非寒颤产热可增加至30%,这一过程主要通过激活棕色脂肪组织来实现[4]。既往研究表明,在3 h低温暴露中,棕色脂肪供能占20%,并能将代谢率提高1.8倍[5]。最近发现这一过程与非寒颤产热以及棕色脂肪活化有关,但具体机制尚不清楚。棕色脂肪在基础代谢的情况下表达较低水平的解偶联蛋白1(uncoupling protein 1,UCP1)[6],而低温暴露可以促进白色脂肪向棕色脂肪转化,诱导UCP1的表达,从而促进机体产热和能量消耗[7]。在白色脂肪向棕色脂肪转化的过程中形成的UCP1、过氧化物酶体增殖物激活受体γ辅激活因子等标志性产热分子,反映出棕色脂肪产热的特点[8]。一种增加UCP1表达的转录共因子PRDM16被敲除后可以阻止白色脂肪棕色化[9]。也有研究认为,棕色样脂肪的维持与自噬有关[10]。除此之外,中枢神经系统对于白色脂肪棕色化也十分重要,交感神经释放去甲肾上腺素[11],通过广泛分布于棕色脂肪细胞的β3-肾上腺素能受体激活棕色脂肪组织,引发脂肪分解和产热。
信号转导因子和转录激活因子(signal transducer and activator of transcription,STAT)作为一种转录调节因子在各种组织细胞中广泛表达[12]。两面神激酶(janus kinase,JAK)是细胞因子信号途径过程中起重要作用的蛋白酪氨酸激酶[13],包括JAK1、JAK2、JAK3以及Tyk2四个家族成员,其中JAK2与STAT3的关系最为密切。通常是在Ⅰ型或Ⅱ型细胞因子受体与其相应配基结合后活化,进而通过磷酸化信号蛋白分子STAT促使其转位到细胞核,最终诱导目的基因表达。近年来研究发现JAK/STAT在细胞凋亡、增殖、分化和炎症反应的调控中发挥重要作用[14]。随着对JAK2/STAT3信号转导通路的深入研究,发现JAK2/STAT3信号转导通路在许多肿瘤的发生发展中起着非常关键的作用,且JAK2/STAT3信号通路可以成为调节细胞生命活动的关键点[15]。本研究建立C57BL/6小鼠低温暴露模型,进而探讨产热分子以及JAK2/STAT3信号通路的变化,为白色/棕色脂肪组织转化作用机制提供科学依据。
1 材料与方法
1.1 材料
6~8周龄雄性C57BL/6小鼠52只,体质量18~20 g,购自空军军医大学实验动物中心,本研究经空军军医大学动物实验伦理委员会批准(许可证号:IACUC-20201125)。JAK2/STAT3信号通路抑制剂WP1066(Mr 356.22)购自MCE公司。称取50 mg WP1066溶于100 μL的DMSO中作为母液,再将母液用PEG和去离子水按1∶1稀释125倍,使其充分溶解后分装在EP管中,存于-20 ℃备用。本实验中所用的抗体购自CST和Abcam公司。
1.2 方法
1.2.1 建立慢性低温暴露模型 从空军军医大学实验动物中心领取C57BL/6小鼠,在标准条件下(每笼5~6只,20~24 ℃,相对湿度为45%~65%,12 h光照/12 h黑暗循环)适应性饲养1周后,按体质量随机分为4组:对照组、低温暴露组、WP1066组、低温暴露+WP1066组,每组13只小鼠。WP1066组按照20 mg/kg剂量给药,用生理盐水配制,注射体积按0.5 mL/kg计;低温暴露组和低温暴露+WP1066组将C57BL/6小鼠放入冷库(4 ℃),低温暴露+WP1066组再给予20 mg/kg剂量腹腔注射WP1066。WP1066隔2 d注射1次,共注射2周。
1.2.2 监测体质量和肛温 建模期间,分别记录小鼠肛温和体质量。使用肛温计在每日早上8:00开始测量小鼠肛温,运用体质量秤测量小鼠的体质量。
1.2.3 HE染色检测脂肪组织的变化情况 建模28 d后,采用50 mL/L水合氯醛麻醉小鼠,将麻醉后的小鼠放于泡沫板上固定,剖开胸腹使心脏完全暴露,剪开右心耳,使用10 mL的注射器灌注9 g/L生理盐水20 mL于左心房,观察肝脏是否变白;然后再灌注40 mL/L多聚甲醛10 mL,观察小鼠尾巴或者肌肉是否抖动。取出皮下腹股沟白色脂肪,浸泡于多聚甲醛液中48 h,用150 g/L蔗糖脱水24 h,待沉底后用250 g/L蔗糖脱水24 h,石蜡切片,进行常规HE染色。在光学显微镜下观察白色脂肪组织变化情况。
1.2.4 Western blotting检测白色脂肪产热相关分子及JAK2/STAT3信号通路的相关蛋白 小鼠新鲜皮下腹股沟白色脂肪组织提取蛋白、BCA定量;按照晶彩生物公司SDS-PAGE凝胶制备试剂盒说明书配置所需浓度的凝胶,UCP1配置120 g/L凝胶,p-JAK2、JAK2、p-STAT3、STAT3配置100 g/L凝胶,在不同膜上分别发光。
1.2.5 RT-PCR检测白色脂肪产热相关分子 腹股沟白色脂肪提取RNA,先用剪刀剪碎白色脂肪,每个组织中加入1 mL Trizol试剂用匀浆机破碎,加入200 μL的三氯甲烷,4 ℃,12 000 r/min离心20 min,抽取上清;再加入等体积的异丙醇,4 ℃,12 000 r/min离心15 min;倒出上清后(切勿倒出沉淀)再加入750 mL/L乙醇1 mL,4 ℃,12 000 r/min离心10 min;倒出上清,晾干。RNA定量。将RNA反转录为cDNA(20 μL反应体系为:Prime Script RT Master Mix,4 μL;Total RNA 1 000 ng;加RNase-Free ddH2O至20 μL。反应条件为:37 ℃,15 min;85 ℃,5 s;4 ℃保存)。
RT-PCR:样品在ABI 7500 Fast Real Time PCR仪上进行扩增。使用20 μL的反应体系,包含如下:SYBR Premix Ex Taq II(Tli RNaseH Plus),10 μL;PCR Forward Primer(10 μmol/L),0.8 μL;PCR Reverse Primer(10 μmol/L),0.8 μL;ROX Reference DyeII,0.4 μL;DNA模板,2 μL;ddH2O,6 μL。反应条件为:步骤一,95 ℃,30 s;步骤二,95 ℃,3 s;58 ℃,30 s,进行40个循环;步骤三,溶解曲线的建立。内参为β-actin。
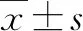
2 结果
2.1 低温暴露后小鼠生理指标和白色脂肪组织形态的改变
在小鼠建模过程中,分别记录低温暴露0、1、7、14、28 d小鼠肛温和体质量的改变。结果显示,与对照组相比,低温暴露组小鼠在低温暴露第1日,肛温显著下降(P<0.05),随着暴露时间的延长,肛温逐渐恢复,14 d后(小鼠出现冷适应现象)无明显差异(图1);低温暴露组小鼠体质量在第1日显著降低(P<0.01),14 d后并无显著差异(图1)。
HE染色结果显示,对照组小鼠白色脂肪呈单腔大泡状,其脂滴形态和结构正常(图2A);低温暴露组小鼠,白色脂肪组织的单腔大泡状中出现多腔脂滴状结构(图2B)。
2.2 低温暴露后产热分子蛋白水平和mRNA水平的改变
建模成功后,分别取两组小鼠腹股沟白色脂肪组织,检测其产热分子UCP1在蛋白水平和mRNA水平的变化。Western blotting和RT-PCR结果显示,与对照组相比,低温暴露组小鼠白色脂肪产热分子UCP1在蛋白水平(P<0.01)和mRNA水平的表达(P<0.05)均有显著性差异(图3)。
2.3 低温暴露后白色脂肪组织中JAK2/STAT3信号通路改变
分别取两组小鼠腹股沟白色脂肪组织,检测其JAK2/STAT3信号通路的变化。Western blotting结果显示,与对照组相比,低温暴露后p-JAK2/JAK2(Y1007)和p-STAT3/STAT3(Y705)显著增加(P<0.05,P<0.01,图4),表明在低温暴露后白色脂肪组织中JAK2/STAT3信号通路被激活。
2.4 低温暴露抑制JAK2/STAT3信号通路对产热分子的影响
通过Western blotting分别检测各组小鼠JAK2/STAT3信号通路相关分子的改变。结果发现,与低温暴露组相比,低温暴露+WP1066组p-JAK2/JAK2(Y1007)和p-STAT3/STAT3(Y705)表达显著降低(P<0.01,图5),JAK2/STAT3信号通路可能被抑制。与低温暴露组相比,低温暴露+WP1066组小鼠在低温暴露后腹股沟白色脂肪组织中的产热分子UCP1在蛋白和mRNA水平表达均显著增加(P<0.05,P<0.01,图6)。
2.5 低温暴露抑制JAK2/STAT3信号通路对白色脂肪棕色化的影响
腹股沟白色脂肪HE染色结果显示,对照组小鼠白色脂肪呈单腔大泡状,形态和结构正常;WP1066组小鼠白色脂肪的单腔大泡状结构中出现多腔脂滴结构;低温暴露组小鼠白色脂肪中也出现多腔脂滴结构,且较WP1066组脂滴小,密度大;低温暴露+WP1066组小鼠白色脂肪的多腔脂滴较低温暴露组脂滴更多,密度更高(图7)。
3 讨论
低温环境是当前和未来人们面临的主要极端环境之一。长时间暴露于低温环境,会对机体造成严重伤害[16]。外周组织代谢器官是低温暴露下机体重要的效应器官,其中脂肪组织分布遍及全身,在冷环境中脂肪组织对于机体能量代谢的调节具有非常重要的作用[17]。经典理论认为,哺乳动物的脂肪细胞有两大类,即白色脂肪组织和棕色脂肪组织[18]。白色脂肪组织主要位于小鼠皮下、腹股沟、附睾和肾周等部位[19],呈单腔大泡结构,含有较少的线粒体且氧化速率低,能量主要以甘油三酯的形式储存于脂滴中;棕色脂肪组织主要位于小鼠的肩胛区,其结构特征为多腔脂滴,存在大量线粒体,在低温刺激下“燃烧”脂肪酸和糖类底物产热。以往认为棕色脂肪组织只存在于婴儿体内,目前倾向于认为成人脊椎、锁骨上区以及颈部存在大量高表达 UCP1 的棕色样脂肪[20]。近年来,人们发现了一种新类型的脂肪细胞,称为棕色样脂肪细胞,其表达与棕色脂肪细胞典型相关的产热基因,棕色样脂肪细胞在结构和功能上与棕色脂肪细胞有许多相似之处[21]。本研究建立C57BL/6小鼠低温暴露模型,HE染色结果显示,低温暴露组小鼠白色脂肪组织的单腔大泡结构中出现多腔脂滴状结构;棕色样脂肪细胞表达的UCP1和线粒体比白色脂肪细胞丰富得多。UCP1是位于线粒体内膜上的一种蛋白质,被激活后,UCP1消除线粒体内膜两侧的质子浓度梯度,从而将氧化呼吸链和ATP合成解偶联,进而使能量以热的形式释放出来[22]。因此,UCP1可作为白色脂肪棕色化的依据。低温暴露后,小鼠的产热分子(UCP1)较对照组升高,说明低温暴露后,白-棕脂肪发生转化。然而目前还没有找到一条经典的信号通路来阐明这种现象。
JAK2/STAT3信号通路是细胞增殖的信号通路[23]。在本研究中,Western blotting结果显示,在低温暴露28 d后JAK2/STAT3信号通路被激活,在加入JAK2/STAT3信号通路抑制剂后,室温和低温暴露后p-JAK2、p-STAT3的表达均显著降低,而JAK2、STAT3的表达无显著差异,表明JAK2/STAT3信号通路被抑制;同时,小鼠的产热分子(UCP1)在蛋白和mRNA水平的表达明显升高(WP1066组高于对照组、WP1066+低温暴露组高于低温暴露组)。HE染色结果也显示,在室温暴露下,与对照组相比,WP1066组白色脂肪出现多腔脂滴状结构;与低温暴露组相比,WP1066+低温暴露组小鼠脂滴更小、密度更大。这些结果与生理监测肛温结果一致。因此,在低温暴露下,JAK2/STAT3信号通路被激活,UCP1的表达增强,HE染色和生理指标结果均表明低温暴露后白色脂肪向棕色脂肪转化;当JAK2/STAT3信号通路被抑制后,UCP1的表达较给予抑制剂前更高。具体原因尚不清楚,其机制还需进一步研究和探讨。
综上所述,JAK2/STAT3信号通路参与了白色脂肪向棕色脂肪的转化过程,这些结果显示低温暴露后可以通过抑制JAK2/STAT3信号通路来促进白色脂肪向棕色脂肪转化,从而产热。这表明抑制JAK2/STAT3信号通路对低温环境下产热发挥更大的作用,但是其中的机制还需更进一步的验证,进而制定可行的预防策略,以减轻低温环境对机体的损伤。

